Kovalentna vez. Molekularna struktura
6.2.1. Določanje vrste kemijske vezi z razliko
elektronegativnosti atomov, ki tvorijo vez
Nastanek različnih vrst kemičnih vezi je odvisen od sposobnosti atomov darovati ali privlačiti elektrone. Za to sposobnost je značilna velikost elektronegativnosti (EO). Večja je vrednost EO. večja je sposobnost atomov, da privlačijo elektrone. Če je razlika v EO (ΔEO) med atomoma, ki tvorita vezo, nič (ΔEO = 0), potem je taka vez nepolarna kovalentna. Ob 0< ΔЭО < 2 связь полярная ковалентная. Ионная связь образуется при Δ ЭО > 2.
Primer 3. Določite, kakšno vrsto vezi v spojinah KC1, H 2, SO 2.
Rešitev. Z uporabo vrednosti EO za vsak atom (Dodatek, Tabela A4) najdemo ΔEO.
Najbolj polarna je vez Na - H, saj je v tem primeru vrednost ΔEO največja.
6.2.2. Iskanje električnega momenta veznega dipola in molekule
Za oceno polarnosti vezi in molekule se uporabi električni moment dipola μ, ki je enak produktu dolžine dipola in električnega naboja q (q= 1,602 10-19 ° C), tj. μ = 1 q... Za polarne vezi in molekule μ> 0, za nepolarne μ = 0. Električni moment dipola - sistema dveh enakih in nasprotnih električnih nabojev v znamenju - je vektorska količina, usmerjena iz pozitivnega v negativni naboj. Merska enota μ - Debye ( D): D= 3,33 · 10 –30 Kl · m. Električni moment dipola dvoetažne molekule je enak električnemu momentu veznega dipola. Električni moment dipola poliatomske molekule je enak vektorski vsoti električnih momentov dipolov vseh vezi.
Primer 5. Določite električni moment dipola molekule HF in njegovo smer, če je μ vezi 1,9 D(Dodatek, tabela A5).
Rešitev. Molekula HF je dvoatomna, ima linearno strukturo: H - F. Posledično je električni moment veznega dipola enak električnemu momentu dipola molekule (1,91 D) in je usmerjen iz vodika, ki ima pozitiven naboj, v negativni fluor: H®F (EO H = 2,1; EO F = 4,0).
Primer 6. Molekula BeN 2 ima linearno strukturo. Vezni kot Н - Ве - Н je 180 °. Veze Be - H so polarne (EO Be = 1,5; EO H = 2,1). Molekula N 2 O ima kotno strukturo (vezni kot N - O - N je 104 ° 30 "). Veze N - O so polarne (EO H = 2,1; EO O = 3,5). Ali bosta obe molekuli polarni?
Rešitev. V molekuli BeH 2 so vezi polarne in vektor električnega trenutka dipola vezi Be-H 2 je usmerjen od (+) do (-); od berilija z nižjim EO do vodika z višjim EO, in sicer H. Vektorska vsota električnih momentov veznih dipolov, enakih po velikosti in nasprotnih po znamenju, je enaka nič. Zato je molekula nepolarna (= 0).
V molekuli Н 2 О se polarne vezi N - O nahajajo pod kotom 104 ° 30 "(slika 1). Zato njihovi električni momenti veznih dipolov niso medsebojno povezaniRiž. 1. Električni moment dipola
molekule Н 2 О
Rešitev. Električni naboj q= 1,602 · 10 –19 C. Električni moment dipola molekule najdemo po formuli
μ = 1 q= 1,602 · 10 -19 · 3,37 · 10 -11 = 5,4 · 10 -30 C · m. (1,63 D).
Odgovor: 5,4 · 10 –30 C · m. = (1,63 D).
6.2.3. Pojasnilo strukture molekul z metodo valenčnih vezi (BC)
Do tvorbe molekul po metodi VS lahko pride z izmenjalnim ali donorsko-akceptorskim mehanizmom. Prva temelji na prekrivanju enoelektronskih atomskih orbitalov; drugi je povezan s prisotnostjo donorskih atomov, ki imajo elektronski par, in akceptorskih atomov, ki imajo proste atomske orbitale.
Primer 8. Pojasnite nastanek kemičnih vezi v molekuli NH 3 in njeno strukturo z mehanizmom izmenjave.
Rešitev . Za razlago nastajanja kemičnih vezi v molekuli NH 3 z mehanizmom izmenjave je treba napisati elektronske formule atomov dušika in vodika; določiti njihove valenčne elektrone in kovalentnost vsakega atoma.
Dušik 7 N 1 s 2 2s 2 2R 3 – Rs 2 2R 3. Kovalentnost atoma je tri 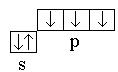 ... Zato nastanejo tri kovalentne vezi.
... Zato nastanejo tri kovalentne vezi.
Vodik 1 H 1 s 1 – ss 1; kovalentnost je 1, atom tvori eno kovalentno vez.
Pri tvorbi treh kemijskih vezi N-H v molekuli NH 3 tri enoelektronske R-orbitale dušikovega atoma in en enoelektron s-orbital vsakega od treh atomov vodika. Prekrivanje s-p orbitale poteka v smeri največjega raztezka R-orbitale v vesolju, ki se nahajajo pod kotom 90 °. Po prekrivanju je oblika molekule NH 3 trikotna piramida s kotom vezi H - N - H, ki je enak 107 ° 20 "(slika 2).
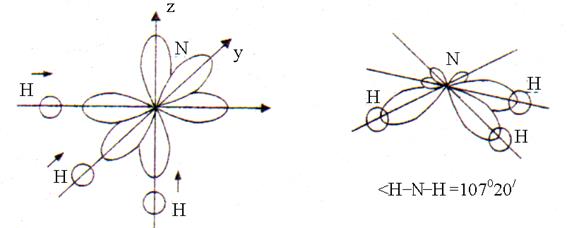
Riž. 2. Struktura molekule amoniaka
Odklon kota od 90 ° je posledica dejstva, da je vez N - H polarna (EO N = 3,0; EO H = 2,1). Vezni elektronski pari se rahlo premaknejo iz vodikovih atomov v dušikove atome (EO N> EO H). Zato se pozitivno nabiti atomi vodika in elektronski pari treh vezi N - H medsebojno odbijajo, kar vodi do povečanja kota vezi na 107 ° 20 ".
Primer 9. Pojasnite nastanek amonijevega iona NH 4 + iz molekule amoniaka NH 3 in vodikovega iona H + z donor-akceptorskim mehanizmom.
Rešitev. Tvorba vezi v molekuli NH 3 z izmenjevalnim mehanizmom je podana v primeru 8. Kot izhaja iz pojasnil, tri kovalentne vezi nastanejo z izmenjevalnim mehanizmom zaradi treh valentnih enoelektronov R-orbitale atoma dušika. Poleg tega ima atom dušika tudi dvoelektronsko valenco s-orbitalni (2 s 2), ki je lahko darovalec glede na akceptor - vodikov ion s prosto orbito. Zato lahko dušikov atom tvori četrto kovalentno vez z donor-akceptorskim mehanizmom. Nastanek četrte kovalentne vezi (donor-akceptor) v amonijevem ionu NH 4 + lahko predstavimo z naslednjo shemo:
Sprejemnik donatorjev
Amonijev ion ima zaradi tega obliko tetraedra s 1 R 3 -hibridizacija (glej odstavek 6.2.4).
6.2.4. Določitev vrste hibridizacije atomskih orbitalov
in prostorsko konfiguracijo molekule po metodi VS
Primer 10. Določite vrsto hibridizacije atomskih orbitalov, prostorsko konfiguracijo in polarnost molekule BH 3.
Rešitev.
Bor: 5 V l s 2 2s 2 2str 1 – R-element; valenčni elektroni 2 s 2 2str 1; kovalentnost atoma v normalnem (ne vzbujenem) stanju je ena ena 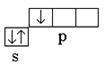 .
.
Vodik 1 H 1 s 1 – s-element; valenčni elektroni 1 s 1; kovalentnost je ena ena. V normalnem stanju lahko atom bora tvori samo eno kemično vez zaradi ene neparne R-elektron. Vendar sestava molekule BH 3 kaže, da bor tvori tri kemijske vezi, t.j. njegova kovalenca je tri. To je mogoče, ko se atom prenese iz normalnega v vzbujeno stanje (slika 3).
Riž. 3. Nastanek hibridnih orbitalov atoma bora
Tri hibridne orbitale se nahajajo simetrično v prostoru pod kotom 120 0 drug do drugega in so usmerjene v oglišča pravilnega trikotnika. Tri hibridne orbitale atoma bora tvorijo z enim elektronom s-orbitale treh vodikovih atomov, tri kemijske vezi v molekuli BH 3, ki ima obliko pravilnega trikotnika (slika 4).
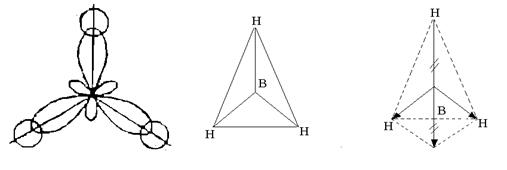
Riž. 4. Struktura molekule BH 3
Kljub temu, da so vezi B-H polarne (EO B = 2,0; EO H = 2,1), je molekula nepolarna, ker ima simetrično strukturo. Nastala vektorska vsota električnih momentov dipolov treh vezi B - H je nič (glej sliko 4).
Hibridizacija atomskih orbitalov določa prostorsko konfiguracijo molekul in ionov (tabela 2).
tabela 2
Prostorska struktura nekaterih molekul in ionov
6.2.5. Pojasnilo nastajanja in lastnosti dvoetažnih molekul tipa B 2 z metodo molekularnih orbitalov (MO)
Po metodi MO v molekuli ni atomskih orbitalov (AO), obstajajo pa vezne in protivezne MO, pridobljene z linearno kombinacijo (mešanjem) AO. Pri kombiniranju n Nastane AO n MO, pri čemer je število vezivnih sredstev enako številu energije AO. Energija veznih MO je manjša od energije AO, energija protiveznih MO pa je večja od energije AO. Postopek namestitve elektronov na MO je enak kot v primeru AO; najprej se nizkoenergijski MO (načelo minimalne energije) napolnijo v skladu s Paulijevim načelom in Gundovim pravilom.
Najenostavnejši primer nastajanja MO se pojavi, ko združimo AO dveh atomov istega elementa (B2). S kombinacijo dveh s-s AO tvorita dve MO, imenovani σ (sigma) orbitale. Eden od njih je zavezujoč (), drugi je zrahljajoč (). S kombinacijo dveh dobimo tudi dva s-MO p x-p x AO (-i). Kombinacija obeh r y-r y in dva p z -p z AO tvorita dva p sv -MO (in) in dva p -krat -MO (in).
Nastanek MO iz atomskih in spremembo njihove energije lahko predstavimo v obliki energetskega diagrama, kjer so vrednosti energije orbitalov narisane vzdolž navpičnice (slika 5).
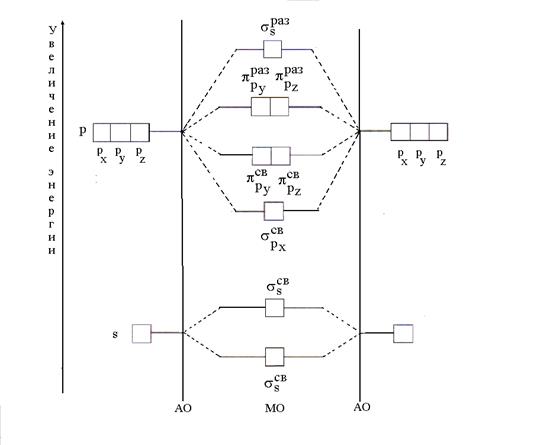
Riž. 5. Energetska shema tvorbe MO s kombinacijo AO dveh atomov istega elementa (B2)
Metoda MO vam omogoča, da določite magnetizem molekule. Torej prisotnost neparnih elektronov v molekuli določa njen paramagnetizem, odsotnost teh pa diamagnetizem. Z metodo MO lahko ugotovite frekvenco komunikacije. Množica w je enaka polovici razlike števila elektronov na vezi n sv in zrahljanje n krat MO:
Če je število elektronov na veznih in proti vezanih MO enako, je množica vezi nič. Posledično ti elektroni nimajo vpliva na tvorbo kemijske vezi.
Metoda MO lahko pojasni tudi stabilnost molekule. Stabilnost molekule je povezana z energetsko bilanco vseh veznih in protiveznih elektronov. Približno lahko domnevamo, da en protivezni elektron izniči učinek enega veznega elektrona. Tako je več elektronov na veznih MO in manj elektronov na protiveznih MO, bolj stabilna je molekula.
Primer 11. Z metodo MO razložite nastanek molekule O 2. Določite množico povezave in njen magnetizem.
Rešitev. Molekula O 2 je sestavljena iz atoma istega elementa - kisika. Njegova elektronska formula je naslednja: 8 O 1 s 2 2s 2 2str 4. Valentni elektroni atoma kisika 2 s 2 2str 4 sodelujejo pri tvorbi kemijske vezi, t.j. MO dobimo z linearno kombinacijo 2 s- in 2 R- AO dveh atomov kisika.
Porazdelitev dvanajstih valentnih elektronov v molekuli kisika poteka v skladu z načelom minimalne energije. Najprej so MO napolnjene z dvema elektronoma, vsaka z antiparalelnimi vrtljaji (Paulijev princip). Nato bo na tri vezne MO (;;) položeno šest elektronov, po dva elektrona z antiparalelnimi spini. Preostala dva elektrona bosta po Gundovem pravilu zasedla protivezujoče MO (e), po en elektron z vzporednimi vrtljaji. Po postavitvi elektronov na MO bo imel energetski diagram molekule kisika naslednjo obliko (slika 6).
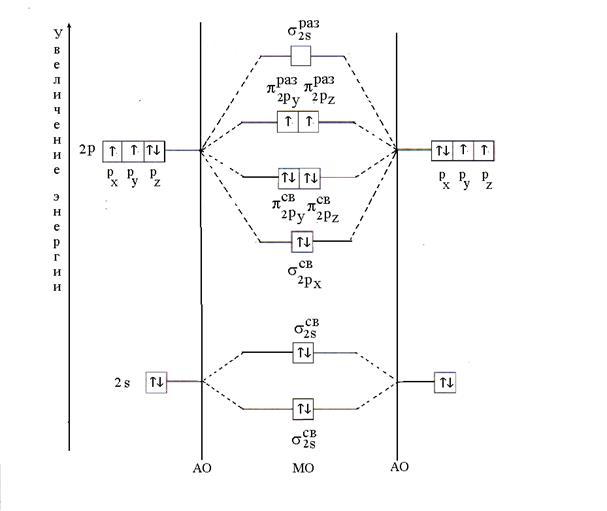
Riž. 6. Energetski diagram molekule O 2
Množica vezi v molekuli kisika, izračunana po formuli (2), je enaka dvema. Prisotnost dveh neparnih elektronov določa paragnetizem molekule.
KONTROLNE NALOGE
101. V molekuli etina (acetilena) C 2 H 2 je med ogljikovimi atomi trojna vez: ena s in dve p vezi. Do nastajanja dveh p vezi pride zaradi prekrivanja r y-r y in dva p z -p z atomske orbitale. Kako nastane obveznica? Določite vrsto hibridizacije pri nastanku s vezi. Narišite strukturo molekule etina in izračunajte energijo vezave s pomočjo podatkov v tabeli. 3.
Odgovor: Δ H= - 245 kJ / mol.
102. Z energetskim diagramom, dobljenim z metodo MO, pojasnite, zakaj je molekula nestabilna, vendar je ion stabilen. Izračunajte pogostost povezave v obeh primerih. Kako in zakaj se energija kemične vezi spreminja.
103. Pojasnite nastanek kemičnih vezi v molekuli H2O po BC metodi. Nariši prostorsko konfiguracijo molekule. Izračunajte dolžino vezi N - О s pomočjo podatkov v tabeli 2. Odgovor: 0,97 · 10 -10 m.
104. Pojasnite strukturo molekule CH 4 po BC metodi. Določite vrsto hibridizacije pri nastajanju kemičnih vezi. Z uporabo podatkov v tabeli 4 dokaži, da so vezi v molekuli kovalentno polarne. Zakaj je električni moment dipola molekule nič? ... Kateri atom deluje kot darovalec in kateri kot akceptor?
108. Pojasnite zgradbo molekule СCl 4 po BC metodi. Določite vrsto hibridizacije pri nastajanju kemičnih vezi. Izračunajte dolžino vezi C - Cl v tej molekuli s pomočjo podatkov v tabeli. 2. Odgovor: 1,765 · 10 -10 m.
109. Pojasni strukturo molekule CO 2 po BC metodi. Nariši prostorsko konfiguracijo molekule. Določite vrsto hibridizacije pri nastajanju kemičnih vezi. Uporaba podatkov v tabeli. 4, dokaži, da so vezi kovalentne polarne. Zakaj je molekula CO 2 nepolarna?
110. Molekula BF 3 ima ravninsko trikotno konfiguracijo, molekula NF 3 pa tridimenzionalno (piramidno) konfiguracijo. Z metodo VS pojasnite, kaj je razlog za razliko v strukturi teh molekul? Katera molekula je nepolarna in zakaj? Rezultat potrdite z vrednostmi električnih momentov dipolov molekul (glej tabelo 5).
111. Molekula CH 4 in ion imata enako prostorsko konfiguracijo. Kako je to mogoče razložiti v smislu hibridizacije atomskih orbitalov osrednjega atoma? Zakaj je električni moment dipola molekule CH 4 enak nič?
112. Z metodo valentnih vezi razložite strukturo molekule etana C 2 H 6 (H 3 C - CH 3). Kakšna je vrsta hibridizacije kemičnih vezi? Izračunajte energijo vezi C - C, če je standardna entalpija tvorbe C 2 H 6 iz plinastega ogljika in vodika - 2798,8 kJ / mol, energija vezi C - H pa –411,3 kJ / mol.
Odgovor: Δ H= - 331,0 kJ / mol.
113. Z metodo BC razložite, zakaj imata molekuli Н 2 О in Н 2 S kotno strukturo, medtem ko je vezni kot<(H–O–H) = 104 0 30¢ больше валентного угла <(H–S–H) = 92 0 . На основании данных табл.5 вычислите длины диполей молекул и покажите направления электрических моментов диполей связей в них.
Odgovor: 3,83 · 10 –11 in 1,55 · 10 –11 m.
114. Z metodo BC razložite molekularno strukturo PCl 3 in AlCl 3. Kakšna je razlika v geometrijski konfiguraciji molekul? Zakaj je molekula PCl 3 polarna in ima AlCl 3 ničelni električni dipolni moment?
115. Z metodo BC razložite zgradbo molekule CS 2. Določite vrsto hibridizacije. Kakšna je geometrijska konfiguracija molekule? Zakaj je električni moment dipola nič?
; ... Izračunajte frekvenco komunikacije in ugotovite, katera bo najbolj stabilna?120. Z uporabo metode MO sestavite energetske diagrame za; ; ... Izračunajte množico vezi in njihove magnetne lastnosti.







