9.2 Standardna vodikova elektroda. Potencial elektrode.
Možno je izmeriti z visoko natančnostjo EMF vezja, sestavljenega iz dveh elektrod. Vendar pa absolutne potencialne razlike na vmesniku kovina-raztopina ni mogoče niti izmeriti niti izračunati. Za praktične namene je dovolj, da imamo pogojne vrednosti, ki označujejo potenciale različnih elektrod, ki se nanašajo na potencial določene elektrode, izbrane kot standardne.
As pogojno nič izbrana zmogljivost potencial standardne vodikove elektrode:
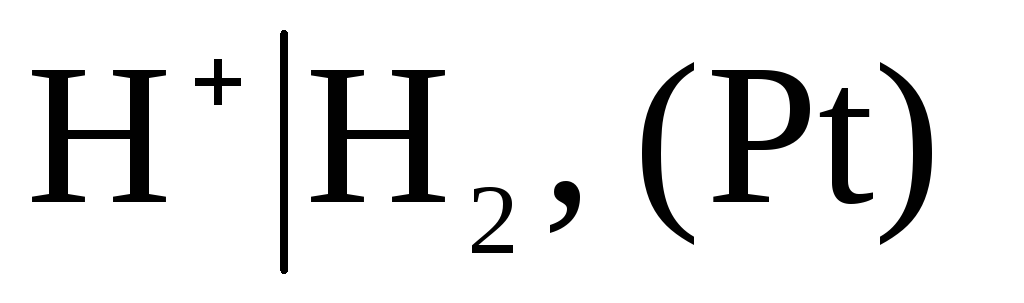 ,
,
pri katerem je tlak vpihanega vodika 1 atm, aktivnost vodikovih ionov v raztopini pa je enaka enoti (slika 1). Pri kateri koli temperaturi 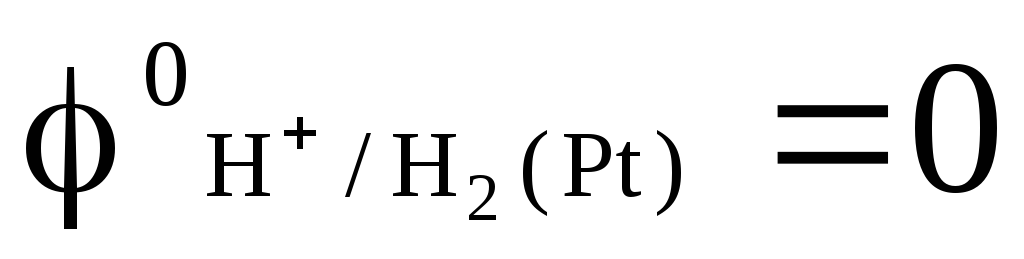 .
.
Elektrodna reakcija za vodikovo elektrodo je zapisana takole:
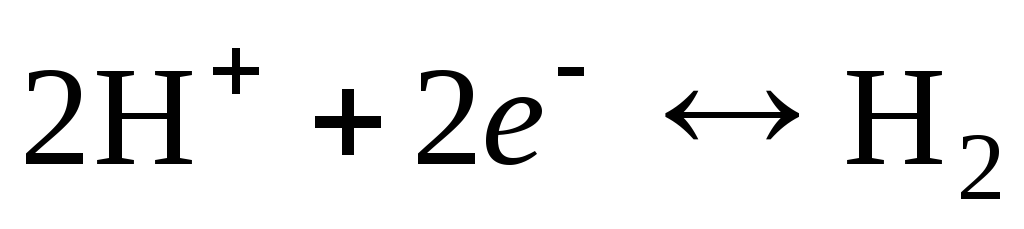 .
.
![]()
Riž. 1. Splošni pogled na vodikovo elektrodo.
Za elektrodni potencial katere koli elektrode je bilo odločeno, da se vzame EMF vezja, sestavljenega iz zadevne elektrode in standardne vodikove elektrode. V tem primeru se obravnavana elektroda nahaja na desni v vezju, standardna vodikova elektroda pa na levi.
Primer 9.1. Sestavite GE za določitev standardnega elektrodnega potenciala Cu 2+ / Cu in Zn 2+ / Zn elektrod.
1). Naredimo galvansko celico iz standardnih vodikovih in bakrenih elektrod:
Celotna reakcija tvorbe potenciala: t.j. prenos elektronov v vezju poteka od leve proti desni (od leve elektrode do desne). Pod standardnimi pogoji 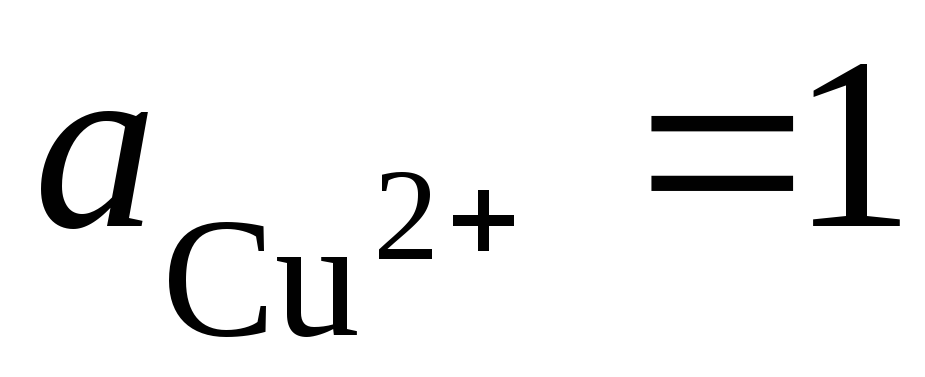 , EMF tega elementa bo E = 0,337 V. Zato,
, EMF tega elementa bo E = 0,337 V. Zato,
![]() .
.
2). Na podoben način pustimo galvansko celico iz standardnih vodikovih in cinkovih elektrod:
Celotna reakcija: tj. prenos elektronov v vezju poteka od desne proti levi. Pod standardnimi pogoji 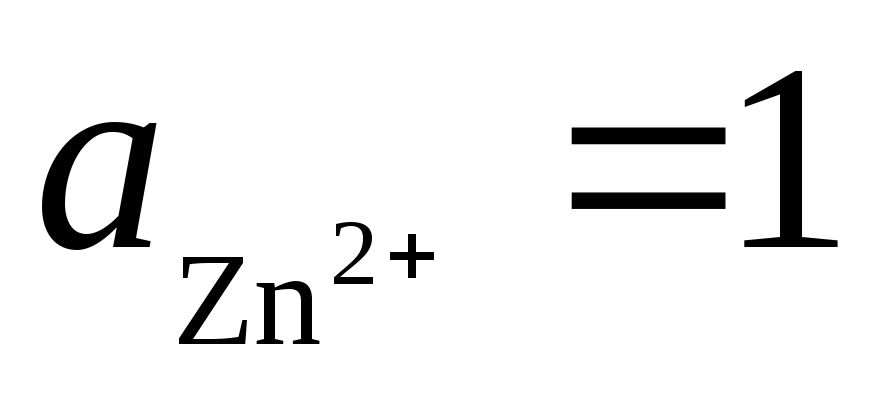
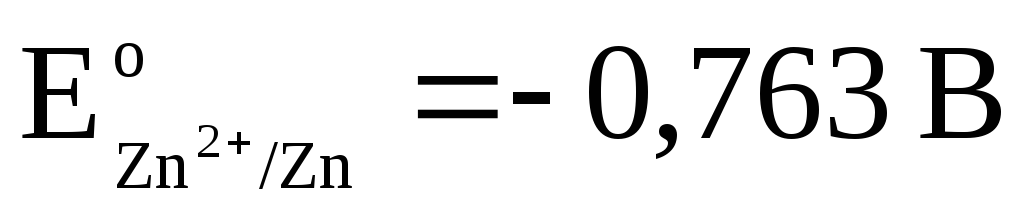 .
.
9.3 Nernstova enačba za elektromotorno silo galvanskega elementa.
Električna lastnost elektrode je potencial elektrode in galvansko celico (elektrokemično vezje) - elektromotorna sila (EMF),
EMF pravilno odprtega elektrokemičnega vezja v odsotnosti difuzijskega potenciala ustreza potencialni razliki desne (pozitivne) in leve (negativne) elektrode in je vedno pozitivna.
EMF galvanskega elementa
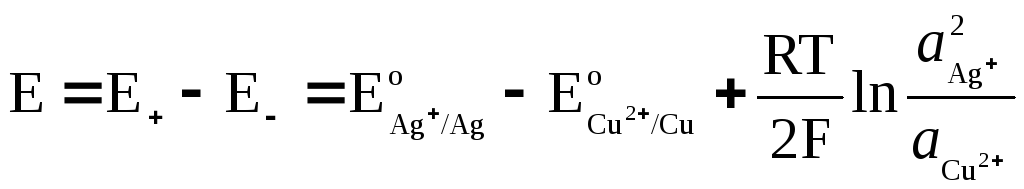
kje 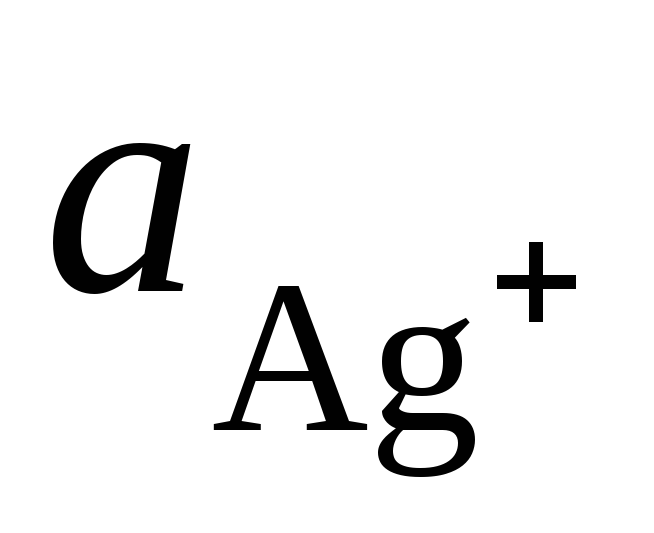 in
in 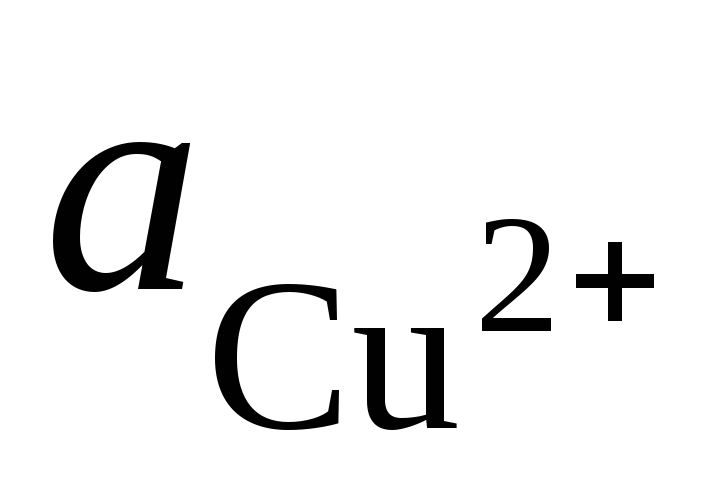 - aktivnost ionov Ag + in Cu 2+ v raztopinah njihovih soli.
- aktivnost ionov Ag + in Cu 2+ v raztopinah njihovih soli.
Označujemo
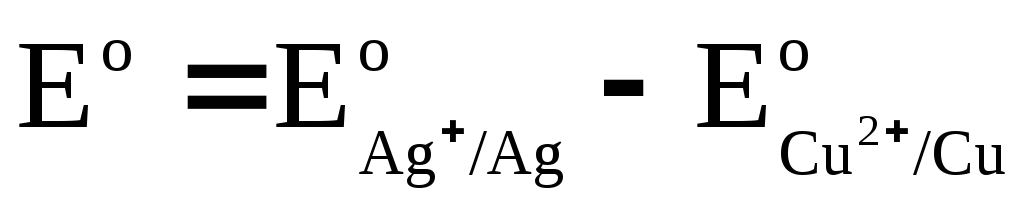 ,
,
kje E o - standardni EMF galvanskega elementa. Potem
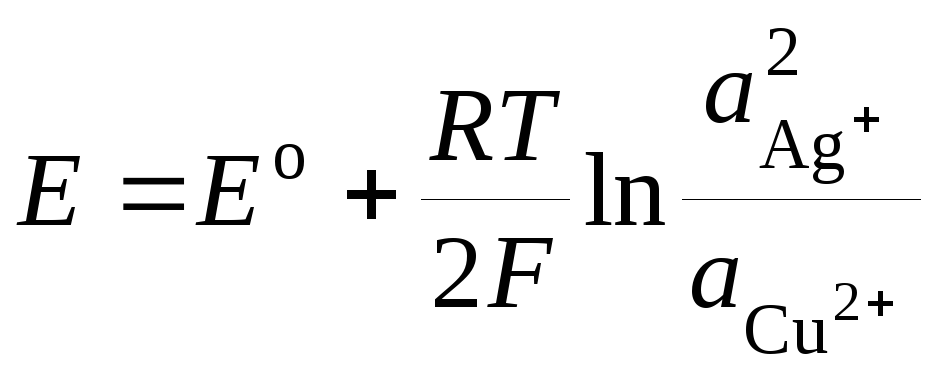 .(3)
.(3)
Enačba (3) se imenuje Nernstove enačbe za EMF galvanskega elementa.
Če v galvanskem elementu poteka reverzibilna kemična reakcija
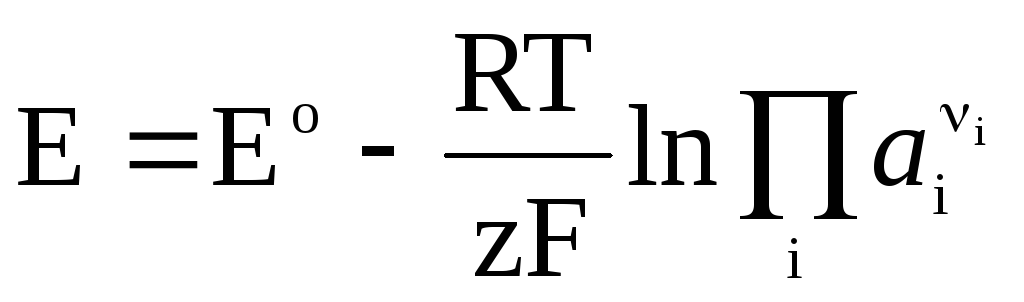 , (4)
, (4)
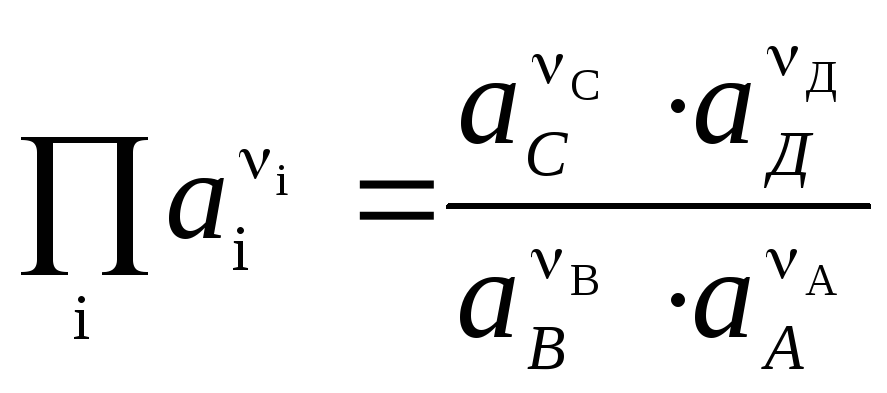
Nernstova enačba v obliki (4) je uporabna za izračun EMF katere koli galvanske celice (s celotno kemijsko reakcijo) in potenciala katere koli elektrode (z reakcijo elektrode). EMF je povezan s termodinamičnimi značilnostmi reakcije. Znano je, da
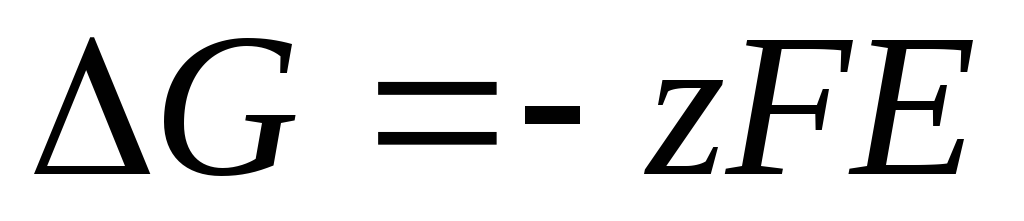 .
.
9.4 Razvrstitev reverzibilnih elektrod.
Razvrstitev reverzibilnih elektrod temelji na lastnostih snovi, ki sodelujejo v procesih določanja potenciala.
1. Elektrode prve vrste.
Prvorazredne elektrode Ali so kovinske elektrode reverzibilne glede na katione (vključno z amalgamskimi) ( 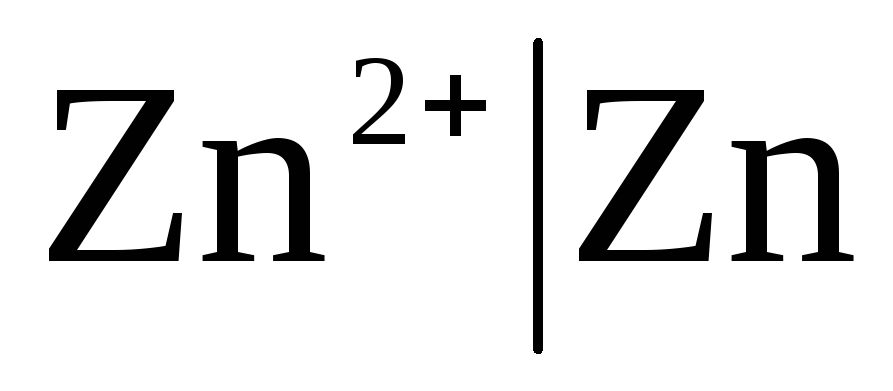 ) in metaloid, so elektrode reverzibilne glede na anione (
) in metaloid, so elektrode reverzibilne glede na anione ( 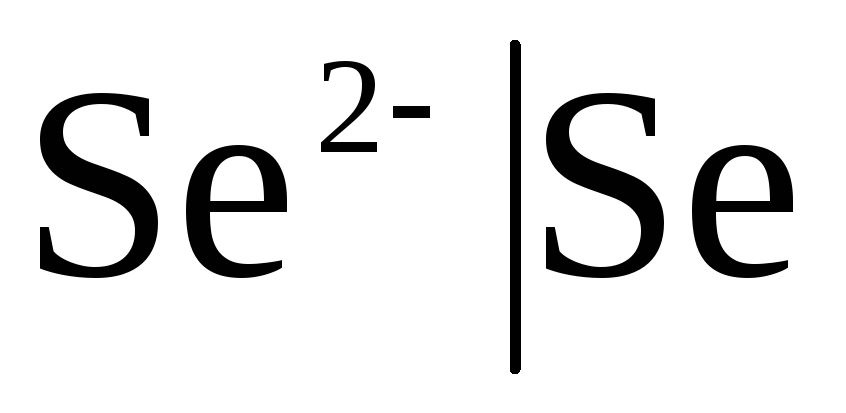 ).
).
Če je elektroda reverzibilna glede na kation Zn 2+ / Zn, potem lahko zanjo zapišemo:
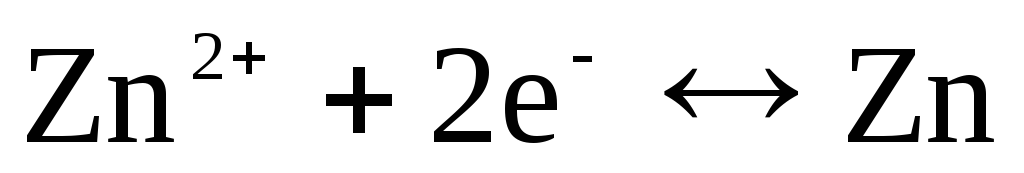 ,
,
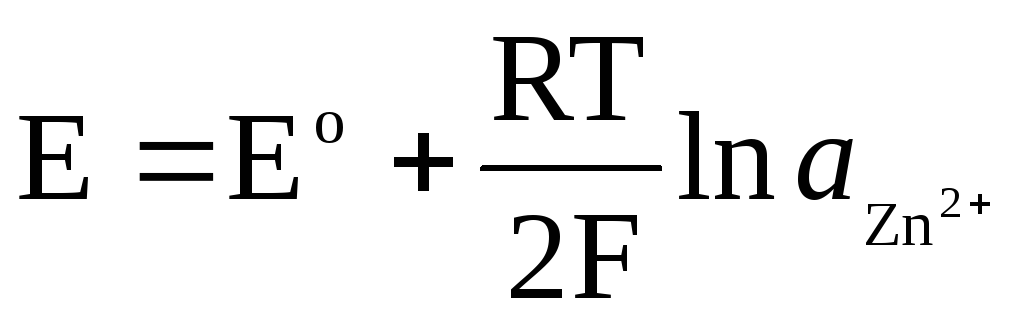
Za amalgamsko elektrodo Zn 2+ / Zn (Hg):
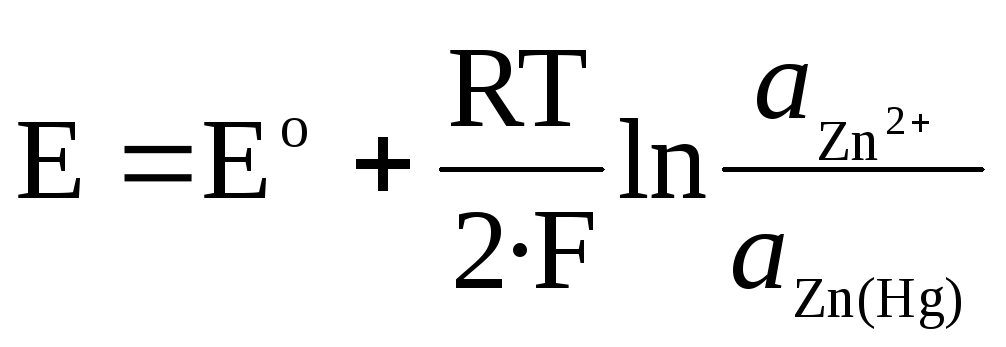 .
.
Če je elektroda reverzibilna glede na anion, potem
![]() ,
,
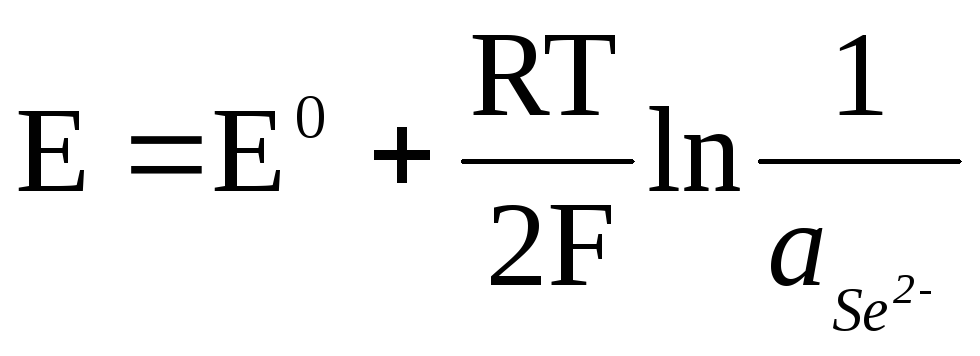 .
.
Elektrode prve vrste vključujejo tudi plin elektrode (vodik 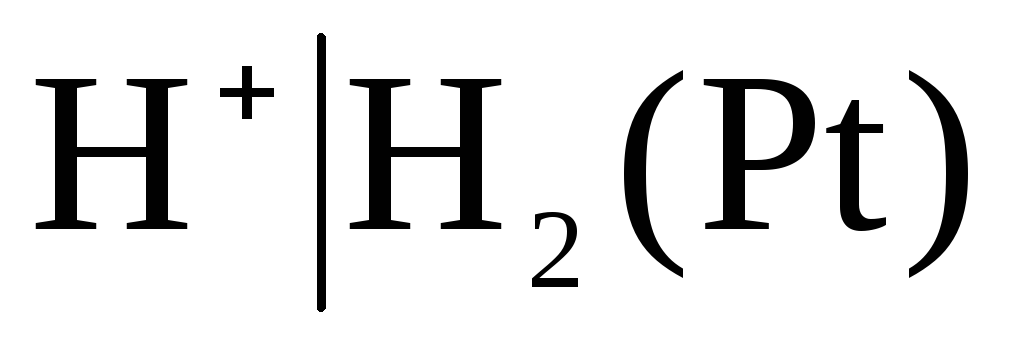 , klor
, klor 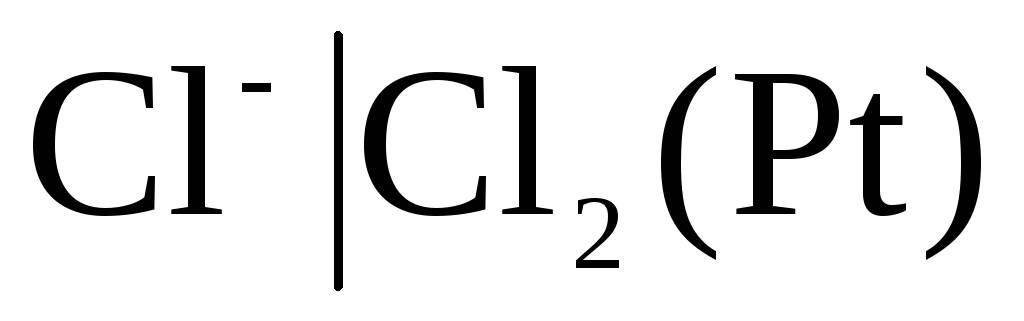 in itd.). Glede na kation (H +) ali anion (Cl -) so lahko reverzibilni. Na primer, vodikova elektroda je reverzibilna glede na kation. Enačbo elektrodnega procesa za to lahko zapišemo v obliki:
in itd.). Glede na kation (H +) ali anion (Cl -) so lahko reverzibilni. Na primer, vodikova elektroda je reverzibilna glede na kation. Enačbo elektrodnega procesa za to lahko zapišemo v obliki:
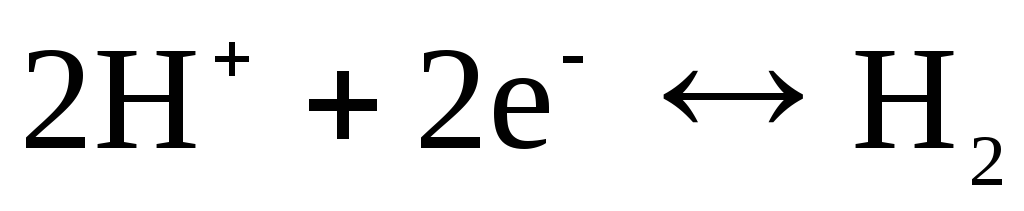 .
.
Potencial vodikove elektrode je določen z izrazom
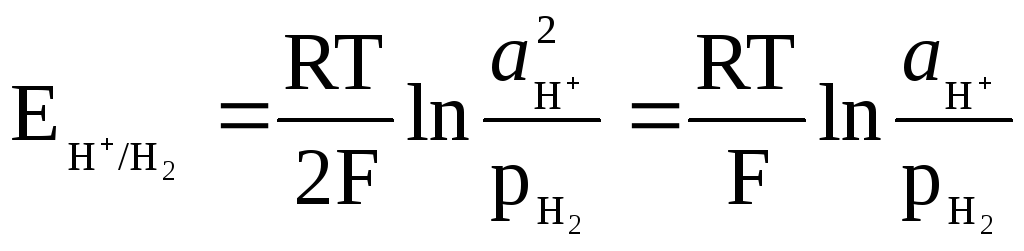 ,
,
in je lahko povezana s pH raztopine.
Za klorovo elektrodo 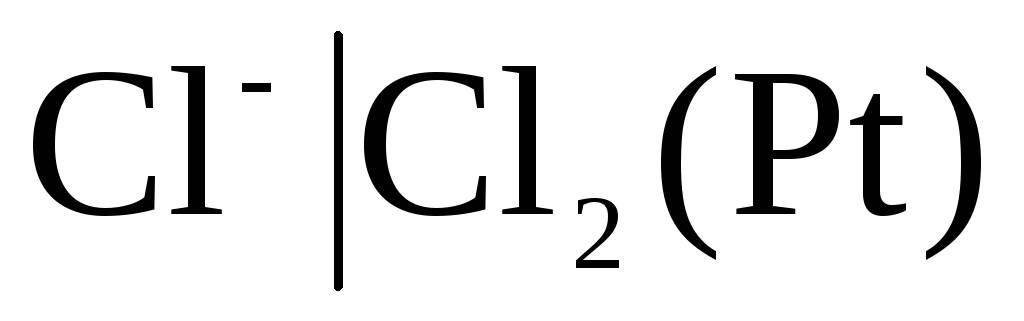 z odzivom, ki določa potencial
z odzivom, ki določa potencial
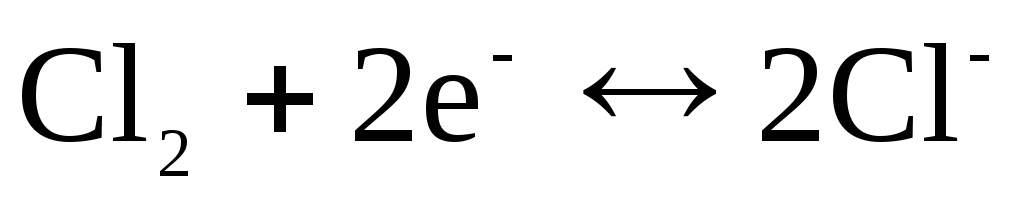 .
.
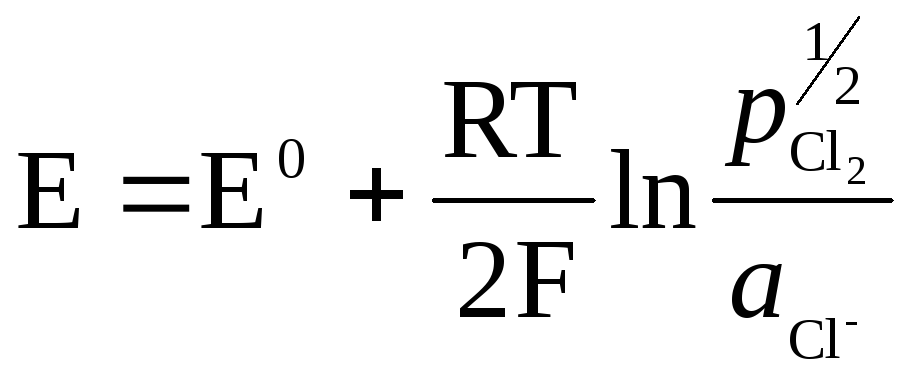
Kovina (Pt) v plinskih elektrodah je potrebna za ustvarjanje stika med plinom in raztopino, mora biti inertna glede na snovi v raztopini in lahko katalizira samo en proces določanja potenciala.







