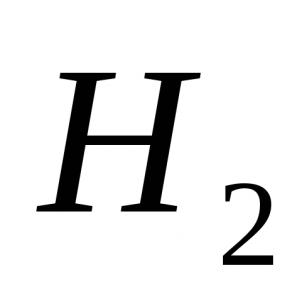Test “Azoto e suoi composti. Argomento: Azoto e suoi composti Test (testing) in chimica (grado 9) sul tema Test sul tema dell'azoto e dei suoi composti
Test "Azoto e suoi composti"
opzione 1 1. La molecola più forte a) H2; b) F2; c) O2; d) N 2 . 2. Colore della fenolftaleina in soluzione di ammoniaca: a) cremisi; b) verde; c) giallo; d) blu. 3. Lo stato di ossidazione è +3 all'atomo di azoto nel composto: a) NH 4 NO 3; b) NaNO 3 ; c) NO 2; d) KNO 2. 4. Durante la decomposizione termica del nitrato di rame (II), si formano:a) nitrito di rame (II) e O 2 ;b) ossido nitrico (IV) e O 2 ;c) ossido di rame(II), gas marrone NO 2 e O 2 ; d) idrossido di rame (II), N 2 e O 2. 5. Quale ione è formato dal meccanismo donatore-accettore? a) NH 4+; b) NO 3 - ; c) CI - ; d) SO 4 2–. 6. Specificare elettroliti forti: a) acido nitrico; b) acido nitroso; c) una soluzione acquosa di ammoniaca; d) nitrato di ammonio. 7. L'idrogeno viene rilasciato durante l'interazione: a) Zn + HNO 3 (razb.); b) Cu + HCl (soluzione); c) Al + NaOH + H 2 O; d) Zn + H 2 SO 4 (razb.); e) Fe + HNO 3 (conc.). 8. Scrivi un'equazione per la reazione dello zinco con acido nitrico molto diluito se uno dei prodotti di reazione è il nitrato di ammonio. Specificare il coefficiente davanti all'agente ossidante. 9.Denominare le sostanze A, B, C. opzione 2 1. È impossibile raccogliere con il metodo dello spostamento dell'acqua: a) azoto; b) idrogeno; c) ossigeno; d) ammoniaca. 2. Il reagente per lo ione ammonio è una soluzione di: a) solfato di potassio; b) nitrato d'argento; c) idrossido di sodio; d) cloruro di bario. 3. Quando si interagisce con HNO 3 (conc.) si forma gas con trucioli di rame: a) N 2 O; b) NH3; c) NO 2 ; d) H 2 . 4. La decomposizione termica del nitrato di sodio produce: a) ossido di sodio, gas marrone NO 2, O 2; b) nitrito di sodio e O 2; c) sodio, gas marrone NO 2, O 2; d) idrossido di sodio, N 2, O 2. 5. Il grado di ossidazione dell'azoto nel solfato di ammonio: a) -3; b) -1; c) +1; d) +3. 6. Con quale delle seguenti sostanze reagisce l'HNO concentrato? 3 in condizioni normali? a) NaOH; b) AgCl; c) Al; d) Fe; e) Cu. 7. Specificare il numero di ioni nell'equazione ionica abbreviata per l'interazione di solfato di sodio e nitrato d'argento: a) 1; b) 2; in 3; d) 4. 8. Scrivi un'equazione per l'interazione del magnesio con acido nitrico diluito se uno dei prodotti di reazione è una sostanza semplice. Specificare il coefficiente nell'equazione davanti all'agente ossidante. 9. Scrivi le equazioni di reazione per le seguenti trasformazioni:
Denominare le sostanze A, B, C, D.
Risposte
opzione 1 1 - G; 2 - un; 3 - G; 4 - in; 5 - un; 6 - anno Domini; 7 - CD; 8 – 10,


2Ag + + SO 4 2– = Ag 2 SO 4;
8 – 12, 9. A - NO, B - NO 2, C - HNO 3, D - NH 4 NO 3,
Opzione 1.
Segno chimico dell'azoto: a) P b) N c) As d) Ne
Una molecola di azoto contiene: a) un doppio legame b) un legame singolo c) un triplo legame
Formula molecolare dell'azoto: a) N b) N 2 c) N 3 d) Ne
Sulle proprietà fisiche dell'azoto non applicabile : a) gas b) inodore c) poco solubile in acqua d) marrone.
L'azoto nei composti non può mostrare lo stato di ossidazione a) +1 b) -3 c) +6 d) +5
L'azoto non reagisce con a) metalli b) fosforo c) idrogeno d) ossigeno
Quando l'azoto reagisce con l'idrogeno, si forma a) fosfina b) ossido nitrico (II) c) metano d) ammoniaca
Quando l'azoto reagisce con l'ossigeno, a) si forma ossido nitrico (II) b) ossido nitrico (I) c) ossido nitrico (IV) d) ossido nitrico (V)
I composti dell'azoto con i metalli sono chiamati a) nitriti b) nitruri c) nitrati d) ammoniti.
Lo stato di ossidazione dell'azoto nell'ammoniaca a) -3 b) +5 c) +3 d) +2
Quale delle proprietà non applicabile ad ammoniaca: a) gas c) poco solubile in acqua c) ha un odore pungente d) si liquefa facilmente sotto pressione
La soluzione di ammoniaca ha un mezzo: a) acido b) alcalino c) neutro d) leggermente acido
Ammoniaca non interagisce a) con acidi b) con alcali c) con acqua d) con ossigeno
Quando l'ammoniaca viene bruciata, a) si forma ossido nitrico (II) b) acqua c) azoto d) ossido nitrico (IV)
Durante l'ossidazione catalitica dell'ammoniaca, oltre all'acqua, si forma a) ossido nitrico (II) b) ossido nitrico (IV) c) ossido nitrico (III) d) ossido nitrico (V)
Quando l'ammoniaca reagisce con l'acido cloridrico, a) cloruro di ammonio b) cloruro di ammonio c) solfato di ammonio d) si forma nitrato di ammonio
L'ammoniaca può essere ottenuta in laboratorio facendo reagire a) sale di ammonio con alcali b) sale di ammonio con acido c) idrogeno con azoto d) sale di ammonio con altri sali.
L'ammoniaca viene prodotta nell'industria a) sali di ammonio con alcali b) sali di ammonio con acido c) idrogeno con azoto d) sali di ammonio con altri sali.
non può sali in forma a) acidi b) medi c) basici
I sali di ammonio non possono essere ottenuti a) dall'interazione di ammoniaca con acidi b) dall'interazione di una soluzione di ammoniaca con acidi c) dall'interazione di sali di ammonio con acidi d) dall'interazione di sali di ammonio con alcali.
Quale reazione è qualitativa per i sali di ammonio a) interazione con alcali b) interazione con acidi c) interazione con altri sali d) interazione con l'acqua.
Un segno di una reazione qualitativa allo ione ammonio è a) l'evoluzione di un gas che provoca la torbidità dell'acqua di calce b) l'evoluzione di un gas con odore di ammoniaca c) l'evoluzione di un precipitato bianco d) l'evoluzione del gas bruno .
Quando i sali di ammonio vengono riscaldati, a) viene rilasciata acqua b) decomposizione con rilascio di gas c) evaporazione d) un cambiamento nel loro colore.
La decomposizione del nitrato di ammonio produce: a) azoto e acqua b) ossido nitrico (I) e acqua c) ossido nitrico (II) e acqua d) ossido nitrico (IV) e acqua.
Azoto non si forma ossido con la formula a) NO 2 b) NO 3 c) NO d) N 2 O
L'ossido acido non è a) NO 2 b) N 2 O 3 c) N 2 O 5 d) NO
Gli ossidi non salini includono a) NO 2 b) N 2 O 3 c) N 2 O 5 d) N 2 O
L'acido nitrico non include a) liquido b) monobasico c) forte agente ossidante d) inodore
Lo stato di ossidazione dell'azoto nell'acido nitrico a) +3 b) +5 c) +1 d) -3
non formato
L'interazione dell'acido nitrico con i metalli non forma a) acqua b) idrogeno c) ossido nitrico d) sale
Quando l'acido nitrico concentrato interagisce con i metalli nella serie di tensioni dopo l'idrogeno, oltre all'acqua e al sale,
Quando l'acido nitrico diluito reagisce con il rame, oltre all'acqua e al sale,
a) ossido nitrico (II) b) ossido nitrico (I) c) ossido nitrico (IV) d) ammoniaca.
L'acido nitrico non reagisce con a) ossido di zolfo (IV) b) idrossido di sodio c) ossido di bario d) carbonato di calcio.
Test sull'argomento "Azoto e suoi composti".
Opzione 2.
Segno chimico dell'azoto: a) N b) Nb c) Ar d) S
Una molecola di azoto contiene: a) un legame idrogeno b) un legame polare covalente c) un legame covalente non polare
Formula strutturale dell'azoto: a) N=N b) N≡ N c) N- N d) :N::: N:
Sulle proprietà fisiche dell'azoto non applicabile : a) gas b) con odore pungente c) poco solubile in acqua d) più pesante dell'aria.
Azoto nell'aria in volume: a) 50% b) 65% c) 78% d) 85%
L'azoto nei composti non può mostrare lo stato di ossidazione a) -1 b) +3 c) +4 d) +5
L'azoto a temperatura ambiente reagisce con a) ossigeno b) litio c) idrogeno d) sodio
Quando l'azoto reagisce con l'idrogeno, a) si forma idrogeno solforato b) ossido di azoto (IV) c) ammoniaca d) ossido di azoto (II)
L'interazione dell'azoto con l'ossigeno produce a) ossido nitrico (II) b) ossido nitrico (I) c) ossido nitrico (IV) d) ossido nitrico (III)
I composti dell'azoto con i metalli sono chiamati a) nitrati b) nitriti c) nitruri d) sali di ammonio.
Lo stato di ossidazione dell'azoto nell'ammoniaca a) +3 b) +4 c) -3 d) +2
Quale delle proprietà non applicabile ad ammoniaca: a) gas c) altamente solubile in acqua c) inodore d) più leggero dell'aria
La soluzione di ammoniaca ha un mezzo: a) acido b) neutro c) alcalino d) debolmente alcalino
Ammoniaca non interagisce a) con ossigeno b) con idrogeno c) con acqua d) con acidi
Quando si brucia l'ammoniaca formato a) ossido nitrico (V) b) ossido nitrico (I) c) azoto d) acqua
Nell'ossidazione catalitica dell'ammoniaca, oltre all'acqua, si forma a) ossido nitrico (V) b) ossido nitrico (III) c) ossido nitrico (IV) d) ossido nitrico (II)
Quando l'ammoniaca reagisce con l'acido solforico, a) cloruro di ammonio b) cloruro di ammonio c) solfato di ammonio d) si forma nitrato di ammonio
L'ammoniaca può essere ottenuta in laboratorio facendo reagire a) cloruro di ammonio con idrossido di potassio b) solfato di ammonio con acido cloridrico c) idrogeno con azoto d) sali di ammonio con altri con acidi.
L'ammoniaca è prodotta nell'industria dall'interazione di a) idrogeno con azoto b) cloruro di ammonio con alcali c) sale di ammonio con acido d) sale di ammonio con altri sali.
Quando si interagisce con acidi, ammoniaca non può formare sali a) basici
b) medio c) acido
sali di ammonio non posso ottenere a) l'interazione dei sali di ammonio con gli alcali b) l'interazione della soluzione di ammoniaca con gli alcali c) l'interazione della soluzione di ammoniaca con gli acidi d) l'interazione dei sali di ammonio con gli acidi.
I sali di ammonio possono essere riconosciuti con l'aiuto di a) acido b) alcali c) un altro sale d) acqua.
Un segno di una reazione qualitativa allo ione ammonio è a) evoluzione di gas con odore di ammoniaca; evoluzione di gas; b) evoluzione di un gas che provoca torbidità dell'acqua di calce; c) evoluzione di gas bruno; d) evoluzione di un precipitato bianco.
Quando il carbonato di ammonio viene riscaldato non sta succedendo
a) rilascio di acqua b) anidride carbonica c) rilascio di ammoniaca d) rilascio di ossido nitrico (I).
La decomposizione del nitrito di ammonio produce:
a) azoto e acqua b) ossido nitrico (I) e acqua c) ossido nitrico (II) e acqua d) ossido nitrico (IV) e acqua.
Azoto non si forma ossido con la formula a) NO 2 b) N 2 O 5 c) NO d) N 2 O 7
Non è un ossido acido a) NO 2 b) N 2 O 3 c) N 2 O d) N 2 O 5
Gli ossidi non salini includono a) NO b) N 2 O 3 c) N 2 O 5 d) NO 2
L'acido nitrico non include a) liquido b) dibasico c) agente ossidante forte d) contenente ossigeno
Lo stato di ossidazione dell'azoto nell'acido nitrico a) -3 b) +5 c) +4 d) +3
Quando l'acido nitrico si decompone alla luce formato a) acqua b) ossigeno c) ammoniaca d) ossido nitrico (IV).
Quando l'acido nitrico reagisce con i metalli, non si forma
a) composto azotato b) sale c) acqua d) idrogeno
Nell'interazione dell'acido nitrico concentrato con l'argento, oltre ad acqua e sale, si forma a) ossido nitrico (I) b) ossido nitrico (IV) c) ossido nitrico (II) d) ammoniaca.
Quando l'acido nitrico diluito reagisce con l'argento, oltre all'acqua e al sale,
a) ossido nitrico (II) b) ossido nitrico (I) c) ossido nitrico (IV) d) ammoniaca.
L'acido nitrico non reagisce con a) ossido di fosforo (V) b) ossido di sodio c) idrossido di bario d) carbonato di sodio.
Opzione numero 1.
Compito numero 1
1. Non ha odore.
2. Ha un odore.
3. Brucia in ossigeno.
4. Interagisce con gli acidi per formare sali.
5. In una molecola tra atomi c'è un legame covalente non polare.
6. In una molecola tra atomi c'è un legame polare covalente.
7. Non brucia nell'aria.
8. Stato di ossidazione dell'azoto -3.
9. Leggermente solubile in acqua.
10. La soluzione acquosa ha un ambiente alcalino.
Compito numero 2
1. N 2 O 3 A) nitrato di ammonio
2. NH 3 B) solfato di ammonio
3. NH 4 NO 3 B) ossido nitrico (III)
4. NH 4 HSO 4 D) idrosolfato di ammonio
5. NO 2 D) ossido nitrico (V)
E) ossido nitrico (IV)
G) ammoniaca
Compito numero 3
N 2 NO NO 2 HNO 3 NO 2
Esercizio№4
C + HNO 3 \u003d CO 2 + NO 2 + H 2 O
Compito numero 5
NH 4 NO 2 = N 2 o + H 2 o
.
4) I nitrati solidi vengono gettati nel fuoco e se non c'è un lampo luminoso, è nitrato.
Test sull'argomento "AZOTO E SUOI COMPOSTI".
Opzione numero 2.
Compito numero 1
Distribuire quale delle proprietà appartiene all'azoto e quale all'ammoniaca? Registra i dati con i numeri di proprietà in una tabella.
1. Ha un odore pungente
2. Altamente solubile in acqua.
3. Non interagisce con l'aria.
4. In una molecola tra atomi, il legame è polare covalente.
5. In una molecola tra atomi, il legame è covalente non polare.
6. Gas incolore e inodore.
7. Stato di ossidazione dell'azoto -3.
8. La soluzione acquosa ha un ambiente alcalino.
9. Dà una reazione con l'ossigeno durante un temporale.
10. Utilizzato in tubi per conservare vecchi dipinti.
Compito numero 2
Abbina formule e nomi di sostanze.
1. N 2 O 5 A) solfato di ammonio
2. NO B) carbonato di ammonio
3. (NH 4) 2 SO 4 B) ossido nitrico (II)
4. NH 4 H CO 3 D) bicarbonato di ammonio
5.N 2 O D) ossido nitrico (V)
E) ossido nitrico (I)
G) idrosolfato di ammonio
Compito numero 3
Scrivi le equazioni di reazione per le seguenti trasformazioni.
NO NO 2 HNO 3 NaNO 3 NaNO 2
Esercizio№4
Disporre i coefficienti utilizzando il metodo del bilancio elettronico, indicare l'agente ossidante e l'agente riducente.
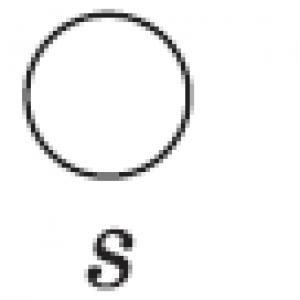
S + HNO 3 \u003d H 2 SO 4 + NO 2 + H 2 O
Compito numero 5
Trova 4 errori in questo testo, scrivi gli errori. Quindi annotalo correttamente accanto ad esso.
1) Quando riscaldati, i nitrati si decompongono. La reazione di decomposizione dei nitrati di metalli diversi procede allo stesso modo.
2) Solo il processo di decomposizione termica del nitrato di ammonio procede in modo peculiare:
NH 4 NO 2 = N 2 o + H 2 o
3) Le soluzioni di nitrati vengono determinate utilizzando rame senza riscaldamento.
4) I nitrati solidi vengono gettati nel fuoco e se non c'è un lampo luminoso, è nitrato.