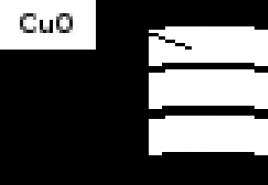Formule de solution de chlorure de cuivre 2. Cuivre et ses composés
Informations de base:
| Protecteur, empêchant les spores fongiques et les agents pathogènes de pénétrer dans les principaux tissus |
| Corps jaune corona (anhydre) à cristaux bleu-vert (dihydraté) |
Libérer:
chlorure de cuivre : comportement dans l'environnement
| Indicateur | Signification | Explication | ||
| Solubilité dans l'eau à 20 o C (mg/l) | 757000 Q4 Élevé||||
| Solubilité dans les solvants organiques à 20 o C (mg/l) | 680000 Q4 - Méthanol -||||
| Point de fusion (°C) | - - -||||
| Point d'ébullition (°C) | - - -||||
| Température de décomposition (o C) | - - -||||
| Point d'éclair (°C) | - - -||||
| Coefficient de partage octanol/eau à pH 7, 20 o C | P : - - -||||
| Gravité spécifique (g/ml) / Gravité spécifique | 3.39Q3-||||
| Constante de dissociation (pKa) à 25 o C | - - -||||
| Noter: | ||||
| Pression de vapeur à 25 o C (MPa) | 1,00 X 10 -10 Q1 Non volatil||||
| Constante de la loi de Henry à 25 o C (Pa * m 3 / mol) | - - -||||
| Constante de la loi de Henry à 20 o C (sans dimension) | 7,29 X 10 -21 Calculé Non volatil||||
| Période de décomposition dans le sol (jours) | DT50 (typique) - - -||||
| - | ||||
| Photolyse aqueuse DT50 (jours) à pH 7 | Signification: - - -||||
| - | ||||
| Hydrolyse aqueuse de DT50 (jours) à 20 o C et pH 7 | Signification: - - -||||
| - | ||||
| Précipitations d'eau DT50 (jours) | - - -||||
| Phase aqueuse uniquement DT50 (jours) | - - -||||
| Indice de potentiel de lessivage GUS | - - -||||
| Indice de croissance de la concentration dans les eaux souterraines SCI (µg/l) à un taux d'application de 1 kg/ha (l/ha) | Signification: - - -||||
| - | ||||
| Potentiel d'indice de transport lié aux particules | - - -||||
| Koc - coefficient de partage du carbone organique (ml/g) | - - -||||
| Résistance pH : | ||||
| Noter: | ||||
| Isotherme d'adsorption de Freundlich | kf :-- | -|||
| - | ||||
| Absorbance UV maximale (l/(mol*cm)) | - - -||||
chlorure de cuivre : écotoxicité
| Indicateur | Signification | Source / Indicateurs qualitatifs / Autres informations | Explication | |
| Facteur de bioconcentration | FBC :-- | -|||
| Potentiel bioaccumulatif | - - -||||
| DL50 (mg/kg) | 140 V3 Rat Modérément||||
| Mammifères - Nourriture à court terme NOEL | (mg/kg): -- | -|||
| Volaille - DL50 aiguë (mg/kg) | - - -||||
| Oiseaux - Toxicité aiguë (CK50 / LD50) | - - -||||
| Poisson - Aiguë 96 heures CK50 (mg/l) | 0,24 F4 truite arc-en-ciel Modérément||||
| Poisson - NOEC chronique sur 21 jours (mg/l) | - - -||||
| Invertébrés aquatiques - CE50 aiguë sur 48 heures (mg/L) | - - -||||
| Invertébrés aquatiques - CSEO chronique sur 21 jours (mg/L) | - - -||||
| Crustacés aquatiques - Aiguë 96 heures CK50 (mg/l) | 0,134 F3 mysida crevette Modérément||||
| Micro-organismes du fond - Aiguë 96 heures CK50 (mg/l) | 0,043 F4 Moustique chironome Haut||||
| NOEC , statique, Eau (mg/l) | - - -||||
| Micro-organismes du fond - NOEC chronique sur 28 jours, Roche sédimentaire (mg/kg) | - - -||||
| Plantes aquatiques - CE50 aiguë 7 jours, biomasse (mg/l) | - - -||||
| Algues - Croissance aiguë de la CE50 sur 72 heures (mg/l) | 0,55 H1 Espèce inconnue Modéré||||
| Algues - NOEC chronique sur 96 heures, croissance (mg/l) | - - -||||
| Abeilles - Aiguë 48 heures LD50 (mcg/individu) | - - -||||
| Lombrics - Aiguë 14 jours CK50 (mg/kg) | - - -||||
| Vers du sol - Concentration inactive maximale chronique sur 14 jours, Reproduction (mg/kg) | 15A4 Ver de terre, sous forme de Cu, 8 semaines Modéré||||
| Autres arthropodes (1) | LR50 (g/ha): - - -||||
| Autres arthropodes (2) | LR50 (g/ha): - - -||||
| Micro-organismes du sol | - - -||||
| Données disponibles sur le mésomonde (mésocosme) | NOEAEC mg/l : - - -||||
chlorure de cuivre : santé humaine
Caractéristiques principales:
| Indicateur | Signification | Source / Indicateurs qualitatifs / Autres informations | Explication | |
| Mammifères - DL50 orale aiguë (mg/kg) | 140 V3 Rat Modérément||||
| Mammifères - DL50 cutanée (mg/kg de poids corporel) | - - -||||
| Mammifères - Inhalation | ||||
Informations générales sur l'hydrolyse du chlorure de cuivre (II)
DÉFINITION
Chlorure de cuivre(II)- un sel moyen formé par une base faible - hydroxyde de cuivre (II) (Cu (OH) 2) et un acide fort - chlorhydrique (chlorhydrique) (HCl). Formule - CuCl 2.
Représente des cristaux de couleur jaune-brun (brun foncé); sous forme d'hydrates cristallins - vert. Masse molaire - 134 g / mol.
Riz. 1. Chlorure de cuivre (II). Apparence.
Hydrolyse du chlorure de cuivre(II)
Hydrolysé au niveau du cation. La nature du milieu est acide. Théoriquement, une deuxième étape est possible. L'équation d'hydrolyse a la forme suivante :
Première étape:
CuCl 2 ↔ Cu 2+ + 2Cl - (dissociation du sel);
Cu 2+ + HOH ↔ CuOH + + H + (hydrolyse cationique);
Cu 2+ + 2Cl - + HOH ↔ CuOH + + 2Cl - + H + (équation ionique);
CuCl 2 + H 2 O ↔ Cu(OH)Cl + HCl (équation moléculaire).
Deuxième étape:
Cu(OH)Cl ↔ CuOH + + Cl - (dissociation du sel);
CuOH + + HOH ↔ Cu(OH) 2 ↓ + H + (hydrolyse cationique);
CuOH + + Cl - + HOH ↔ Cu(OH) 2 ↓ + Cl - + H + (équation ionique);
Cu(OH)Cl + H 2 O ↔ Cu(OH) 2 ↓ + HCl (équation moléculaire).
Exemples de résolution de problèmes
EXEMPLE 1
EXEMPLE 2
| La tâche | Écrivez l'équation d'électrolyse pour la solution de chlorure de cuivre (II). Quelle masse de substance sera libérée sur la cathode si 5 g de chlorure de cuivre (II) sont soumis à une électrolyse ? |
| Solution | Nous écrivons l'équation de dissociation du chlorure de cuivre (II) dans une solution aqueuse : CuCl 2 ↔ Cu 2+ + 2Cl -. Nous écrivons conditionnellement le schéma d'électrolyse: (-) Cathode : Cu 2+ , H 2 O. (+) Anode : Cl -, H 2 O. Cu 2+ +2e → Cu o ; 2Cl - -2e → Cl 2. Ensuite, l'équation d'électrolyse pour une solution aqueuse de chlorure de cuivre (II) ressemblera à ceci : CuCl 2 \u003d Cu + Cl 2. Calculez la quantité de chlorure de cuivre (II) à l'aide des données spécifiées dans la condition problématique (masse molaire - 134 g / mol): υ (CuCl 2) \u003d m (CuCl 2) / M (CuCl 2) \u003d 5/134 \u003d 0,04 mol. D'après l'équation de réaction υ (CuCl 2) \u003d υ (Cu) \u003d 0,04 mol. Puis on calcule la masse de cuivre libérée à la cathode (masse molaire - 64 g/mol) : m (Cu) \u003d υ (Cu) × M (Cu) \u003d 0,04 × 64 \u003d 2,56 g. |
| Répondre | La masse de cuivre libérée à la cathode est de 2,56 g. |
§une. Propriétés chimiques d'une substance simple (st. ok. = 0).
a) Relation avec l'oxygène.
Contrairement à ses voisins du sous-groupe, l'argent et l'or, le cuivre réagit directement avec l'oxygène. Le cuivre montre peu d'activité vis-à-vis de l'oxygène, mais dans l'air humide il s'oxyde progressivement et se recouvre d'un film verdâtre, constitué de carbonates basiques de cuivre :
A l'air sec, l'oxydation est très lente, une fine couche d'oxyde de cuivre se forme à la surface du cuivre :
Extérieurement, le cuivre ne change pas, car l'oxyde de cuivre (I), comme le cuivre lui-même, est rose. De plus, la couche d'oxyde est si fine qu'elle transmet la lumière, c'est-à-dire brille à travers. D'une manière différente, le cuivre s'oxyde lorsqu'il est chauffé, par exemple à 600-800 0 C. Dans les premières secondes, l'oxydation passe à l'oxyde de cuivre (I), qui de la surface se transforme en oxyde de cuivre (II) noir. Un revêtement d'oxyde à deux couches est formé.
Formation de Q (Cu 2 O) = 84935 kJ.

Figure 2. La structure du film d'oxyde de cuivre.
b) Interaction avec l'eau.
Les métaux du sous-groupe du cuivre sont à la fin de la série électrochimique des tensions, après l'ion hydrogène. Par conséquent, ces métaux ne peuvent pas déplacer l'hydrogène de l'eau. Dans le même temps, l'hydrogène et d'autres métaux peuvent déplacer les métaux du sous-groupe du cuivre des solutions de leurs sels, par exemple :
Cette réaction est redox, car il y a un transfert d'électrons :
L'hydrogène moléculaire déplace très difficilement les métaux du sous-groupe du cuivre. Cela s'explique par le fait que la liaison entre les atomes d'hydrogène est forte et que beaucoup d'énergie est dépensée pour la rompre. La réaction a lieu uniquement avec des atomes d'hydrogène.
Le cuivre en l'absence d'oxygène n'interagit pratiquement pas avec l'eau. En présence d'oxygène, le cuivre réagit lentement avec l'eau et se recouvre d'une pellicule verte d'hydroxyde de cuivre et de carbonate basique :
c) Interaction avec les acides.
Étant dans une série de tensions après l'hydrogène, le cuivre ne le déplace pas des acides. Par conséquent, l'acide chlorhydrique et l'acide sulfurique dilué n'agissent pas sur le cuivre.
Or, en présence d'oxygène, le cuivre se dissout dans ces acides pour former les sels correspondants :
La seule exception est l'acide iodhydrique, qui réagit avec le cuivre pour libérer de l'hydrogène et former un complexe de cuivre (I) très stable :
2 Cu + 3 SALUT → 2 H[ CuI 2 ] + H 2
Le cuivre réagit également avec les acides - les agents oxydants, par exemple avec l'acide nitrique :
Cu+4HNO 3( conc .) → Cu(NON 3 ) 2 +2NO 2 +2H 2 O
3Cu + 8HNO 3( avoir dilué .) → 3Cu(NON 3 ) 2 +2NO+4H 2 O
Et aussi avec de l'acide sulfurique froid concentré :
Cu + H 2 ALORS 4(conc.) → CuO + SO 2 +H 2 O
Avec de l'acide sulfurique concentré chaud :
Cu+2H 2 ALORS 4( conc ., chaud ) → CuSO 4 + SO 2 + 2H 2 O
Avec l'acide sulfurique anhydre à une température de 200 0 C, il se forme du sulfate de cuivre (I) :
2Cu+2H 2 ALORS 4( anhydre .) 200°C → Cu 2 ALORS 4 ↓+SO 2 + 2H 2 O
d) Relation avec les halogènes et certains autres non-métaux.
Formation de Q (CuCl) = 134300 kJ
Formation de Q (CuCl 2) = 111700 kJ
Le cuivre réagit bien avec les halogènes, donne deux types d'halogénures : CuX et CuX 2 .. Sous l'action des halogènes à température ambiante, aucun changement visible ne se produit, mais une couche de molécules adsorbées se forme d'abord en surface, puis une très fine couche d'halogénures. Lorsqu'il est chauffé, la réaction avec le cuivre est très violente. Nous chauffons le fil ou la feuille de cuivre et le baissons chaud dans un pot de chlore - des vapeurs brunes apparaîtront près du cuivre, constituées de chlorure de cuivre (II) CuCl 2 mélangé à du chlorure de cuivre (I) CuCl. La réaction se produit spontanément en raison du dégagement de chaleur. Les halogénures de cuivre monovalents sont obtenus en faisant réagir du cuivre métallique avec une solution d'halogénure de cuivre divalent, par exemple :
Dans ce cas, le monochlorure précipite hors de la solution sous la forme d'un précipité blanc à la surface du cuivre.
Le cuivre réagit aussi assez facilement avec le soufre et le sélénium lorsqu'il est chauffé (300-400°C) :
2Cu+S→Cu 2 S
2Cu+Se→Cu 2 Se
Mais le cuivre ne réagit pas avec l'hydrogène, le carbone et l'azote, même à des températures élevées.
e) Interaction avec les oxydes de non-métaux
Lorsqu'il est chauffé, le cuivre peut déplacer des substances simples de certains oxydes non métalliques (par exemple, l'oxyde de soufre (IV) et les oxydes d'azote (II, IV)), tout en formant un oxyde de cuivre (II) thermodynamiquement plus stable):
4Cu+SO 2 600-800°C →2CuO + Cu 2 S
4Cu+2NO 2 500-600°C →4CuO + N 2
2 Cu+2 NON 500-600° C →2 CuO + N 2
§2. Propriétés chimiques du cuivre monovalent (st.c. = +1)
Dans les solutions aqueuses, l'ion Cu+ est très instable et disproportionné :
Cu + ↔ Cu 0 + Cu 2+
Cependant, le cuivre à l'état d'oxydation (+1) peut être stabilisé dans des composés très peu solubles ou par complexation.
a) Oxyde de cuivre (je) Cu 2 O
oxyde amphotère. Substance cristalline brun-rouge. Il se produit naturellement sous forme de minéral cuprite. Il peut être obtenu artificiellement en chauffant une solution de sel de cuivre (II) avec un alcali et un agent réducteur fort, par exemple du formol ou du glucose. L'oxyde de cuivre(I) ne réagit pas avec l'eau. L'oxyde de cuivre (I) est transféré dans une solution avec de l'acide chlorhydrique concentré pour former un complexe chlorure :
Cu 2 O+4 HCl→2 H[ CuCl2]+ H 2 O
Nous dissolvons également dans une solution concentrée d'ammoniaque et de sels d'ammonium :
Cu 2 O+2NH 4 + →2 +
Dans l'acide sulfurique dilué, il disproportionne au cuivre divalent et au cuivre métallique :
Cu 2 O+H 2 ALORS 4(dil.) →CuSO 4 + Cu 0 ↓+H 2 O
De plus, l'oxyde de cuivre (I) entre dans les réactions suivantes dans les solutions aqueuses :
1. Lentement oxydé par l'oxygène en hydroxyde de cuivre (II):
2 Cu 2 O+4 H 2 O+ O 2 →4 Cu(Oh) 2 ↓
2. Réagit avec les acides halohydriques dilués pour former les halogénures de cuivre(I) correspondants :
Cu 2 O+2 HG→2CuG↓ +H 2 O(G=CL, BR, J)
3.Réduit en cuivre métallique avec des agents réducteurs typiques, par exemple, l'hydrosulfite de sodium dans une solution concentrée :
2 Cu 2 O+2 Na SO 3 →4 Cu↓+ N / A 2 ALORS 4 + H 2 ALORS 4
L'oxyde de cuivre (I) est réduit en cuivre métallique dans les réactions suivantes :
1. Lorsqu'il est chauffé jusqu'à 1800 °C (décomposition) :
2 Cu 2 O - 1800° C →2 Cu + O 2
2. Lorsqu'il est chauffé dans un courant d'hydrogène, de monoxyde de carbone, d'aluminium et d'autres agents réducteurs typiques :
Cu 2 O+H 2 - >250°C →2Cu+H 2 O
Cu 2 O+CO - 250-300°C →2Cu+CO 2
3 Cu 2 O + 2 Al - 1000° C →6 Cu + Al 2 O 3
De plus, à haute température, l'oxyde de cuivre (I) réagit :
1. Avec de l'ammoniac (il se forme du nitrure de cuivre (I))
3 Cu 2 O + 2 NH 3 - 250° C →2 Cu 3 N + 3 H 2 O
2. Avec des oxydes de métaux alcalins :
Cu 2 O+M 2 O- 600-800°C →2 MCuO (M = Li, Na, K)
Dans ce cas, des cuprates de cuivre (I) se forment.
L'oxyde de cuivre (I) réagit nettement avec les alcalis :
Cu 2 O+2 NaOH (conc.) + H 2 O↔2 N / A[ Cu(Oh) 2 ]
b) Hydroxyde de cuivre (je) CuOH
L'hydroxyde de cuivre (I) forme une substance jaune et est insoluble dans l'eau.
Se décompose facilement lorsqu'il est chauffé ou bouilli :
2 CuOH → Cu 2 O + H 2 O
c) HalogénuresCuF, CuÀ PARTIR DEje, CuBrEtCuJ
Tous ces composés sont des substances cristallines blanches, peu solubles dans l'eau, mais facilement solubles dans un excès de NH 3 , d'ions cyanure, d'ions thiosulfate et d'autres agents complexants puissants. L'iode ne forme que le composé Cu +1 J. A l'état gazeux, des cycles de type (CuГ) 3 se forment. Réversiblement soluble dans les acides halohydriques correspondants :
CuG + HG ↔H[ Cug 2 ] (G=CL, BR, J)
Le chlorure et le bromure de cuivre (I) sont instables à l'air humide et se transforment progressivement en sels basiques de cuivre (II) :
4 CuJ +2H 2 O + O 2 →4 Cu(Oh)G (G=Cl, Br)
d) Autres composés de cuivre (je)
1. Acétate de cuivre (I) (CH 3 COOCu) - un composé de cuivre, se présente sous la forme de cristaux incolores. Dans l'eau, il s'hydrolyse lentement en Cu 2 O, dans l'air, il s'oxyde en acétate de cuivre divalent ; CH 3 COOSu est obtenu par réduction (CH 3 COO) 2 Cu avec de l'hydrogène ou du cuivre, sublimation (CH 3 COO) 2 Cu sous vide ou interaction (NH 3 OH) SO 4 avec (CH 3 COO) 2 Cu dans p- re en présence de H 3 COOH 3 . La substance est toxique.
2. Acétylénide de cuivre (I) - cristaux rouge-brun, parfois noirs. Une fois secs, les cristaux explosent à l'impact ou à la chaleur. Résistant à l'humidité. La détonation en l'absence d'oxygène ne produit aucune substance gazeuse. Se décompose sous l'action des acides. Il se forme sous forme de précipité lorsque l'acétylène est passé dans des solutions ammoniacales de sels de cuivre (I) :
À PARTIR DE 2 H 2 +2[ Cu(NH 3 ) 2 ](Oh) → Cu 2 C 2 ↓ +2 H 2 O+2 NH 3
Cette réaction est utilisée pour la détection qualitative de l'acétylène.
3. Nitrure de cuivre - un composé inorganique de formule Cu 3 N, cristaux vert foncé.
Se décompose en chauffant :
2 Cu 3 N - 300° C →6 Cu + N 2
Réagit violemment avec les acides :
2 Cu 3 N +6 HCl - 300° C →3 Cu↓ +3 CuCl 2 +2 NH 3
§3. Propriétés chimiques du cuivre bivalent (st.c. = +2)
L'état d'oxydation le plus stable du cuivre et le plus caractéristique de celui-ci.
a) Oxyde de cuivre (II) CuO
CuO est l'oxyde basique du cuivre divalent. Cristaux noirs, dans des conditions normales assez stables, pratiquement insolubles dans l'eau. Dans la nature, il se présente sous la forme de la ténorite minérale (mélaconite) de couleur noire. L'oxyde de cuivre(II) réagit avec les acides pour former les sels correspondants de cuivre(II) et d'eau :
CuO + 2 HNO 3 → Cu(NON 3 ) 2 + H 2 O
Lorsque CuO est fusionné avec des alcalis, des cuprates de cuivre (II) se forment :
CuO+2 KOH- t ° → K 2 CuO 2 + H 2 O
Chauffé à 1100 °C, il se décompose :
4CuO- t ° →2 Cu 2 O + O 2
b) Hydroxyde de cuivre (II)Cu(Oh) 2
L'hydroxyde de cuivre(II) est une substance bleue amorphe ou cristalline, pratiquement insoluble dans l'eau. Lorsqu'il est chauffé à 70-90 ° C, la poudre de Cu (OH) 2 ou ses suspensions aqueuses se décomposent en CuO et H 2 O:
Cu(Oh) 2 → CuO + H 2 O
C'est un hydroxyde amphotère. Réagit avec les acides pour former de l'eau et le sel de cuivre correspondant :
Il ne réagit pas avec les solutions alcalines diluées, mais se dissout dans des solutions concentrées, formant des tétrahydroxocuprates bleu vif (II) :
L'hydroxyde de cuivre (II) avec des acides faibles forme des sels basiques. Il se dissout très facilement dans l'excès d'ammoniac pour former de l'ammoniac de cuivre :
Cu(OH) 2 +4NH 4 OH→(OH) 2 +4H 2 O
L'ammoniac de cuivre a une couleur bleu-violet intense, il est donc utilisé en chimie analytique pour déterminer de petites quantités d'ions Cu 2+ en solution.
c) Sels de cuivre (II)
Les sels simples de cuivre (II) sont connus pour la plupart des anions, à l'exception du cyanure et de l'iodure qui, lorsqu'ils interagissent avec le cation Cu 2+ , forment des composés covalents de cuivre (I) insolubles dans l'eau.
Les sels de cuivre (+2) sont pour la plupart solubles dans l'eau. La couleur bleue de leurs solutions est associée à la formation de l'ion 2+. Ils cristallisent souvent sous forme d'hydrates. Ainsi, le tétrahydraté cristallise à partir d'une solution aqueuse de chlorure de cuivre (II) en dessous de 15 0 C, trihydraté à 15-26 0 C et dihydraté au-dessus de 26 0 C. Dans les solutions aqueuses, les sels de cuivre (II) sont légèrement hydrolysés et des sels basiques en précipitent souvent.
1. Sulfate de cuivre (II) pentahydraté (sulfate de cuivre)
CuSO 4 * 5H 2 O, appelé sulfate de cuivre, est de la plus grande importance pratique. Le sel sec a une couleur bleue, cependant, lorsqu'il est légèrement chauffé (200 0 C), il perd de l'eau de cristallisation. Sel blanc anhydre. Lors d'un chauffage supplémentaire à 700 0 C, il se transforme en oxyde de cuivre, perdant du trioxyde de soufre :
CuSO 4 -- t ° → CuO+ ALORS 3
Le sulfate de cuivre est préparé en dissolvant du cuivre dans de l'acide sulfurique concentré. Cette réaction est décrite dans la section "Propriétés chimiques d'une substance simple". Le sulfate de cuivre est utilisé dans la production électrolytique de cuivre, dans l'agriculture pour lutter contre les ravageurs et les maladies des plantes et pour obtenir d'autres composés de cuivre.
2. Chlorure de cuivre (II) dihydraté.
Ce sont des cristaux vert foncé, facilement solubles dans l'eau. Les solutions concentrées de chlorure de cuivre sont vertes et les solutions diluées sont bleues. Cela est dû à la formation d'un complexe de chlorure vert :
Cu 2+ +4 CL - →[ CuCl 4 ] 2-
Et sa destruction ultérieure et la formation d'un aquacomplexe bleu.
3. Nitrate de cuivre (II) trihydraté.
Solide cristallin bleu. Obtenu en dissolvant du cuivre dans de l'acide nitrique. Lorsqu'ils sont chauffés, les cristaux perdent d'abord de l'eau, puis se décomposent avec dégagement d'oxygène et de dioxyde d'azote, se transformant en oxyde de cuivre (II):
2Cu(NON 3 ) 2 -- t° →2CuO+4NO 2 +O 2
4. Carbonate d'hydroxomédi(II).
Les carbonates de cuivre sont instables et presque jamais utilisés en pratique. Seul le carbonate de cuivre basique Cu 2 (OH) 2 CO 3, présent dans la nature sous la forme de malachite minérale, est d'une certaine importance pour la production de cuivre. Lorsqu'il est chauffé, il se décompose facilement en dégageant de l'eau, du monoxyde de carbone (IV) et de l'oxyde de cuivre (II) :
Cu 2 (OH) 2 CO 3 -- t° →2CuO+H 2 O+CO 2
§4. Propriétés chimiques du cuivre trivalent (st.c. = +3)
Cet état d'oxydation est le moins stable pour le cuivre et, par conséquent, les composés du cuivre (III) sont l'exception plutôt que la «règle». Cependant, certains composés de cuivre trivalent existent.
a) Oxyde de cuivre (III) Cu 2 O 3
C'est une substance cristalline, de couleur grenat foncé. Ne se dissout pas dans l'eau.
Obtenu par oxydation de l'hydroxyde de cuivre (II) avec du peroxodisulfate de potassium en milieu alcalin à basse température :
2Cu(OH) 2 +K 2 S 2 O 8 +2KOH -- -20°C → Cu 2 O 3 ↓+2K 2 ALORS 4 +3H 2 O
Cette substance se décompose à une température de 400 0 C :
Cu 2 O 3 -- t ° →2 CuO+ O 2
L'oxyde de cuivre(III) est un oxydant puissant. Lors de l'interaction avec le chlorure d'hydrogène, le chlore est réduit en chlore libre :
Cu 2 O 3 +6 HCl-- t ° →2 CuCl 2 + CL 2 +3 H 2 O
b) Cuprates de cuivre (W)
Ce sont des substances noires ou bleues, elles ne sont pas stables dans l'eau, elles sont diamagnétiques, l'anion est un ruban de carrés (dsp 2). Formé par l'interaction de l'hydroxyde de cuivre (II) et de l'hypochlorite de métal alcalin en milieu alcalin :
2 Cu(Oh) 2 +MClO + 2 NaOH→2MCuO 3 + NaCl +3 H 2 O (M= N / A- Cs)
c) Hexafluorocuprate de potassium(III)
Substance verte, paramagnétique. Structure octaédrique sp 3 d 2 . Complexe de fluorure de cuivre CuF 3, qui se décompose à l'état libre à -60 0 C. Il se forme en chauffant un mélange de chlorures de potassium et de cuivre dans une atmosphère fluorée :
3KCl + CuCl + 3F 2 → K 3 + 2Cl 2
Décompose l'eau avec formation de fluor libre.
§cinq. Composés de cuivre à l'état d'oxydation (+4)
Jusqu'à présent, une seule substance est connue de la science, où le cuivre est à l'état d'oxydation +4, il s'agit de l'hexafluorocuprate de césium (IV) - Cs 2 Cu +4 F 6 - une substance cristalline orange, stable dans des ampoules en verre à 0 0 C Il réagit violemment avec l'eau. Obtenu par fluoration à haute pression et température d'un mélange de chlorures de césium et de cuivre :
CuCl 2 +2CsCl +3F 2 -- t ° p → Cs 2 CuF 6 +2Cl 2
Chlorure de cuivre 2
Propriétés chimiques
L'outil est une substance inorganique binaire, appartient à la classe sels Et halogénures . Il peut être considéré comme un sel formé acide hydrochlorique Et le cuivre .
Formule racémique du chlorure de cuivre : CuCl2.
Le poids moléculaire de ce composé est de 134,5 grammes par mole. La substance fond à 498 degrés Celsius. L'agent forme des hydrates cristallins de la forme CuCl2 nH2O .
Utilisé en médecine chlorure de cuivre dihydraté.
Le produit sous forme solide est des cristaux jaune-brun. Composition hydrates cristallins dépend de la température à laquelle se produit la cristallisation. La substance est très soluble dans l'alcool éthylique, l'eau, acétone Et méthanol .
Réactions du chlorure de cuivre
La substance interagit avec alcali , ainsi, en règle générale, une base insoluble et un sel soluble sont formés. Le chlorure de cuivre réagit avec les métaux situés à gauche du métal dans la série électrochimique Cu . En outre, le composé est caractérisé par des réactions échange d'ion avec d'autres sels, une substance insoluble se forme et un gaz est libéré.
A l'échelle industrielle, l'agent est obtenu par la réaction oxyde de cuivre 2 avec de l'acide chlorhydrique ou par réaction d'échange chlorure de baryum à partir de sulfate de cuivre .
Il y a aussi une connexion Chlorure de cuivre 1 , dans lequel le cuivre est monovalent. Monochlorure ce métal est un composé plutôt toxique.
effet pharmacologique
Métabolique.
Pharmacodynamique et pharmacocinétique
Le cuivre est essentiel pour le corps. Par exemple, il participe à un certain nombre de réactions chimiques se produisant dans les tissus du foie. Après avoir pénétré dans le corps, la substance est presque complètement métabolisée.
Indications pour l'utilisation
La solution de chlorure de cuivre fait partie des solutions utilisées dans nutrition parentérale et satisfait les besoins du corps en oligo-éléments .
Contre-indications
Les préparations contenant une solution ne peuvent pas être utilisées si le patient a des substances dans la composition, les enfants de moins de 10 ans. La prudence s'impose en cas d'insuffisance rénale ou hépatique.
Effets secondaires
Le médicament est généralement bien toléré par les patients. Rarement, des nausées et des douleurs au site d'injection surviennent pendant la perfusion.
Chlorure de cuivre, mode d'emploi (Méthode et posologie)
L'agent est administré par voie intraveineuse.
Si le médicament est initialement sous forme de poudre, il est dilué dans des solutions glucose ou .
La solution résultante doit être utilisée dans la journée.
Le schéma posologique et le schéma thérapeutique dépendent du médicament et de la maladie.
Surdosage
Une surdose du médicament se produit rarement. Le plus souvent, il est utilisé sous la supervision du miel. personnel et à l'hôpital.
Si le médicament est administré trop rapidement, il peut se développer : vomissements, transpiration, hyperémie couvertures de peau. Les réactions disparaissent après une diminution du taux d'administration du médicament.
Interaction
Il est possible de mélanger la substance dans une seringue ou un emballage uniquement avec r-mi glucose ou acides aminés , dont la concentration ne dépasse pas 50 %.
Pendant la grossesse et l'allaitement
Le médicament peut être prescrit aux femmes enceintes.
Il n'y a pas suffisamment de données sur l'utilisation de ce composant pendant l'allaitement.
Préparations contenant (Analogues)
Coïncidence dans le code ATX du 4ème niveau :Le chlorure de cuivre est inclus sous forme de dihydrate dans la composition du concentré pour la préparation de solutions pour perfusions Addamel N.