Was sind Enzyme? Die Rolle von Enzymen im menschlichen Körper. Enzyme und ihre Rolle im menschlichen Körper Aufbau und Wirkungsweise von Enzymen
Ohne Enzyme ist der Mensch nicht lebensfähig, da der Körper Eiweißmoleküle für alle wichtigen Stoffwechselvorgänge und eine gesunde Verdauung benötigt.
Enzyme im menschlichen Körper haben eine Proteinstruktur. Man kann sie sich als Katalysatoren des menschlichen Körpers vorstellen, die für das Funktionieren aller Stoffwechselvorgänge sorgen. Sie regen zahlreiche biochemische Reaktionen an und sorgen dafür, dass der Körper die Nährstoffe erhält, die er aus der Nahrung benötigt.
Wirkmechanismus
Enzyme bauen Nährstoffe ab, damit sie vom Körper verwendet werden können. Dadurch werden Nährstoffe aus der Nahrung in den Körper eingebracht.
Tatsächlich sind Enzyme sehr schlau! Jedes der angeblich 10.000 verschiedenen Enzymtypen im Körper hat eine bestimmte Funktion: Es wirkt auf ein bestimmtes Substrat. Proteinverdauende Enzyme verdauen also ausschließlich Proteine und lösen kein Fett auf.
Um seine Funktion zu ändern, kann sich ein Enzym kurzzeitig mit einem anderen Substrat verbinden, wodurch ein Enzym-Substrat-Komplex entsteht. Anschließend kehrt es zur ursprünglichen Struktur zurück.
Die Hauptgruppen von Enzymen im Körper
Enzyme fallen in drei Kategorien: Verdauungs-, Ernährungs- und Stoffwechselenzyme. Während Verdauungs- und Stoffwechselenzyme vom Körper selbst produziert werden, erhält der Körper Nahrungsenzyme durch den menschlichen Verzehr von Rohkost.
1. Verdauungs. Diese Proteine werden in der Bauchspeicheldrüse, im Magen, im Dünndarm und in den Speicheldrüsen im Mund produziert. Dort zerlegen sie die Nahrungsmoleküle in ihre Grundbausteine und sorgen so für deren Verfügbarkeit für den Stoffwechselprozess.
Ein besonders wichtiges Organ für die Produktion vieler Verdauungsenzyme ist die Bauchspeicheldrüse. Es produziert Amylase, die Kohlenhydrate in einfache Zucker umwandelt, Lipase, die aus Fetten Glycerin und einfache Fettsäuren bildet, und Protease, die aus Proteinen Aminosäuren bildet.
2. Essen. Diese Gruppe von Enzymen kommt in rohen frischen Lebensmitteln vor. Lebensmittelenzyme wirken als Verdauungsenzyme. Vorteil: Sie helfen direkt bei der Verdauung von Nahrung.
Beim Verzehr von frischem Obst und rohem Gemüse verdauen Nahrungsenzyme im Körper bis zu 70 % der Nahrung. Hitze zerstört sie, daher ist es wichtig, Lebensmittel roh zu essen. Es sollte möglichst vielfältig sein, um die Versorgung mit unterschiedlichen Enzymen sicherzustellen.
Bananen, Ananas, Feigen, Birnen, Papaya und Kiwi sind besonders reich an ihnen. Unter den Gemüsen stechen Brokkoli, Tomaten, Gurken und Zucchini hervor.
3. Stoffwechsel. Diese Gruppe von Enzymen wird in Zellen, Organen, Knochen und Blut produziert. Nur durch ihre Anwesenheit können Herz, Nieren und Lunge arbeiten. Stoffwechselenzyme sorgen dafür, dass Nährstoffe effektiv aus der Nahrung zugeführt werden.
So liefern sie dem Körper Vitamine, Mineralstoffe, sekundäre Pflanzenstoffe und Hormone.
Auswirkungen auf die Haut
Fleißige Enzym-Biokatalysatoren im Körper helfen nicht nur im Körper, sondern auch außerhalb. Menschen, die unter Akne leiden oder empfindliche Haut haben, können mit ihrer Hilfe ihr Aussehen verbessern. Um den Prozess zu beschleunigen, werden spezielle Enzympeelings verwendet. Sie bestehen normalerweise aus Fruchtenzymen.
Solche Verfahren entfernen abgestorbene Hautzellen und entfernen überschüssigen Talg. Enzymatische Peelings sind frei verkäuflich und sehr sanft zur Haut. Sie sollten jedoch nicht mehr als einmal pro Woche verwendet werden.
Enzyme (Enzyme) sind spezifische Proteine, biologisch aktive organische Substanzen, die chemische Reaktionen in der Zelle beschleunigen. Die große Rolle von Enzymen im Körper. Sie können die Reaktionsgeschwindigkeit um mehr als das Zehnfache steigern. Es ist einfach notwendig für das normale Funktionieren der Zelle. Und an jeder Reaktion sind Enzyme beteiligt.
Im Körper aller Lebewesen, einschließlich der primitivsten Mikroorganismen, wurden Enzyme gefunden. Enzyme sind aufgrund ihrer katalytischen Aktivität sehr wichtig für das normale Funktionieren unserer Körpersysteme.
Schlüsselenzyme im Körper
Das Leben des menschlichen Körpers basiert auf Tausenden von chemischen Reaktionen, die in Zellen ablaufen. Jeder von ihnen wird unter Beteiligung spezieller Beschleuniger - Biokatalysatoren oder Enzyme - durchgeführt.
Enzyme wirken als Katalysatoren in fast allen biochemischen Reaktionen, die in lebenden Organismen ablaufen. Bis 2013 wurden über 5.000 verschiedene Enzyme beschrieben.
Die moderne Wissenschaft kennt etwa zweitausend Biokatalysatoren. Konzentrieren wir uns auf die sog Schlüsselenzyme . Dazu gehören die für das Leben des Organismus wesentlichsten Biokatalysatoren, deren „Bruch“ in der Regel zum Auftreten von Krankheiten führt. Wir bemühen uns, die Frage zu beantworten: Wie wirkt dieses Enzym in einem gesunden Körper und was passiert damit im Krankheitsprozess des Menschen?
Es ist bekannt, dass die wichtigsten Biopolymere, die die Grundlage aller Lebewesen bilden (alle Bestandteile der Zellen unseres Körpers und alle Enzyme sind daraus aufgebaut), proteinartiger Natur sind. Proteine wiederum bestehen aus einfachen stickstoffhaltigen Verbindungen - Aminosäuren, die durch chemische Bindungen - Peptidbindungen - verbunden sind. Im Körper gibt es spezielle Enzyme, die diese Bindungen spalten, indem sie Wassermoleküle anlagern (Hydrolysereaktion). Solche Enzyme werden Peptidhydrolasen genannt. Unter ihrem Einfluss werden chemische Bindungen zwischen Aminosäuren in Proteinmolekülen aufgebrochen und Fragmente von Proteinmolekülen gebildet - Peptide, die aus einer unterschiedlichen Anzahl von Aminosäuren bestehen. Peptide, die eine hohe biologische Aktivität haben, können sogar eine Vergiftung des Körpers verursachen. Schließlich verlieren Peptide, wenn sie Peptidhydrolasen ausgesetzt werden, ihre biologische Aktivität entweder oder verringern sie signifikant.
Professor VN Orekhovich und seinen Studenten gelang es 1979, eine der bisher den Biochemikern unbekannten Peptidhydrolasen zu entdecken, in reiner Form zu isolieren und die physikalischen, chemischen und katalytischen Eigenschaften einer der Peptidhydrolasen im Detail zu untersuchen. Jetzt ist es unter dem Namen des Enzyms Carboxycatepsin in die internationale Liste aufgenommen. Die Forschung hat es ermöglicht, der Frage näher zu kommen: Warum braucht ein gesunder Körper Carboxycatepsin und was kann durch bestimmte Veränderungen in seiner Struktur passieren?
Es stellte sich heraus, dass Carboxycatepsin sowohl an der Bildung des Angiotensin-B-Peptids beteiligt ist, das den Blutdruck erhöht, als auch an der Zerstörung eines anderen Peptids, Bradykinin, das im Gegenteil die Eigenschaft hat, den Blutdruck zu senken.
Somit stellte sich heraus, dass Carboxycatepsin ein Schlüsselkatalysator ist, der an der Funktion eines der wichtigsten biochemischen Systeme des Körpers beteiligt ist – dem Blutdruckregulationssystem. Je größer die Aktivität von Carboxycatepsin, desto höher die Konzentration von Angiotensin II und desto niedriger die Konzentration von Bradykinin, was wiederum zu einem Anstieg des Blutdrucks führt. Es überrascht nicht, dass bei Menschen mit Bluthochdruck die Aktivität von Carboxy-Catepsin im Blut erhöht ist. Die Definition dieses Indikators hilft Ärzten, die Wirksamkeit therapeutischer Maßnahmen zu bewerten und den Krankheitsverlauf vorherzusagen.
Kann man die Wirkung von Carboxythepsin direkt im menschlichen Körper hemmen und dadurch eine Blutdrucksenkung erreichen? Untersuchungen an unserem Institut haben gezeigt, dass es in der Natur Peptide gibt, die in der Lage sind, ohne Hydrolyse an Carboxycatepsin zu binden und ihm dadurch die ihm innewohnende Funktion zu entziehen.
Derzeit wird an der Synthese von künstlichen Blockern (Inhibitoren) von Carboxycatepsin gearbeitet, die als neue Therapeutika gegen Bluthochdruck eingesetzt werden sollen.
Andere wichtige Schlüsselenzyme, die an der biochemischen Umwandlung stickstoffhaltiger Substanzen im menschlichen Körper beteiligt sind, sind Aminoxidasen. Ohne sie kommen die Oxidationsreaktionen der sogenannten biogenen Amine, zu denen viele chemische Überträger von Nervenimpulsen – Neurotransmitter – gehören, nicht aus. Abbau von Aminoxidasen führt zu Funktionsstörungen des zentralen und peripheren Nervensystems; Chemische Blocker von Aminoxidasen werden bereits in der klinischen Praxis als Therapeutika beispielsweise bei depressiven Zuständen eingesetzt.
Bei der Untersuchung der biologischen Funktionen von Aminoxidasen war es möglich, ihre bisher unbekannte Eigenschaft zu entdecken. Es stellte sich heraus, dass bestimmte chemische Veränderungen in den Molekülen dieser Enzyme mit qualitativen Veränderungen ihrer katalytischen Eigenschaften einhergehen. So verlieren Monoaminooxidasen, die biogene Monoamine oxidieren (z. B. die bekannten Neurotransmitter Noradrenalin, Serotonin und Dopamin), nach Behandlung mit Oxidationsmitteln teilweise ihre inhärenten Eigenschaften. Aber andererseits entdecken sie eine qualitativ neue Fähigkeit, Diamine, einige Aminosäuren und Aminozucker, Nukleotide und andere stickstoffhaltige Verbindungen zu zerstören, die für das Leben der Zelle notwendig sind. Darüber hinaus ist es möglich, Monoaminooxidasen nicht nur in einem Reagenzglas zu transformieren (dh in Fällen, in denen Forscher mit gereinigten Enzympräparaten experimentieren), sondern auch in einem tierischen Körper, in dem verschiedene pathologische Prozesse vorab modelliert werden.
In den Zellen des menschlichen Körpers sind Monoaminoxidasen in der Zusammensetzung biologischer Membranen enthalten - halbdurchlässige Trennwände, die als Zellmembranen dienen und jede von ihnen in separate Kompartimente unterteilen, in denen bestimmte Reaktionen stattfinden. Biomembranen sind besonders reich an leicht oxidierbaren Fetten, die in einem halbflüssigen Zustand vorliegen. Viele Krankheiten gehen mit einer übermäßigen Ansammlung von Fettoxidationsprodukten in Biomembranen einher. Übermäßig oxidiert (peroxidiert) stören sie sowohl die normale Permeabilität von Membranen als auch die normale Funktion der Enzyme, aus denen ihre Zusammensetzung besteht. Zu diesen Enzymen gehören Monoaminoxidasen.
Insbesondere während einer Strahlenverletzung werden Fette in den Biomembranen von Zellen des Knochenmarks, des Darms, der Leber und anderer Organe überoxidiert, und Monoaminoxidasen verlieren nicht nur teilweise ihre nützliche Aktivität, sondern erwerben auch eine qualitativ neue Eigenschaft, die für die schädlich ist Karosserie. Sie beginnen, stickstoffhaltige Substanzen zu zerstören, die für die Zelle lebenswichtig sind. Die Fähigkeit von Monoaminoxidasen, ihre biologische Aktivität umzuwandeln, zeigt sich sowohl in Experimenten mit gereinigten Enzympräparaten als auch in einem lebenden Organismus. Darüber hinaus stellte sich heraus, dass die im Kampf gegen Strahlenschäden eingesetzten Therapeutika auch die Entwicklung qualitativer Enzymveränderungen verhindern.
Diese sehr wichtige Eigenschaft - die Reversibilität der Umwandlung von Monoaminoxidasen - wurde in Experimenten festgestellt, in denen die Forscher lernten, nicht nur die Umwandlung von Enzymen zu verhindern, sondern auch Verletzungen zu beseitigen, die Funktionen von Katalysatoren wieder normal zu machen und ein bestimmtes Therapeutikum zu erreichen Wirkung.
Apropos Tierversuche. Heute gibt es jedoch allen Grund zu der Annahme, dass sich die Aktivität der Aminoxidasen auch im menschlichen Körper verändert, insbesondere bei Arteriosklerose. Daher wird die Erforschung der Eigenschaften von Aminoxidasen sowie von Chemikalien, mit denen ihre Aktivität im menschlichen Körper zu therapeutischen Zwecken beeinflusst werden kann, derzeit mit besonderer Beharrlichkeit fortgesetzt.
Und das letzte Beispiel. Es ist bekannt, welche wichtige Rolle Kohlenhydrate im Leben unseres Körpers spielen, und folglich auch die Schlüsselenzyme, die ihre biochemischen Umwandlungen beschleunigen. Zu diesen Katalysatoren gehört das an unserem Institut entdeckte Enzym Gamma-Amylase; er beteiligt sich an der Spaltung chemischer Bindungen zwischen Glukosemolekülen (aus ihnen werden komplexe Glykogenmoleküle aufgebaut). Das angeborene Fehlen oder die Insuffizienz von Gamma-Amylase führt zu einer Störung der normalen biochemischen Transformationen von Glykogen. Sein Inhalt in den Zellen der lebenswichtigen Organe des Kindes nimmt zu, sie verlieren die Fähigkeit, ihre inhärenten Funktionen auszuführen. All diese Veränderungen charakterisieren die schwerste Krankheit - Glykogenose.
An den biochemischen Umwandlungen von Glykogen sind auch andere Enzyme beteiligt.
Auch ihr angeborener Mangel führt zu Glykogenosen. Um rechtzeitig und genau zu erkennen, an welcher Art von Glykogenose ein Kind leidet (und dies ist wichtig für die Auswahl einer Behandlungsmethode und die Vorhersage des Krankheitsverlaufs), muss die Aktivität einer Reihe von Enzymen, einschließlich Gamma, untersucht werden -Amylase. Die in den 1970er Jahren am Institut für biologische und medizinische Chemie der Akademie der medizinischen Wissenschaften der UdSSR entwickelten Methoden der Differentiallabor- und chemischen Diagnose der Glykogenose werden immer noch in der klinischen Praxis eingesetzt.
Laut Professor V.Z. GORKINA
In sozialen Netzwerken speichern:In der Zelle jedes lebenden Organismus finden Millionen von chemischen Reaktionen statt. Jeder von ihnen ist von großer Bedeutung, daher ist es wichtig, die Geschwindigkeit biologischer Prozesse auf einem hohen Niveau zu halten. Fast jede Reaktion wird durch ein eigenes Enzym katalysiert. Was sind Enzyme? Welche Rolle spielen sie in der Zelle?
Enzyme. Definition
Der Begriff „Enzym“ kommt vom lateinischen fermentum – Sauerteig. Sie können auch Enzyme genannt werden, vom griechischen en zyme, „in Hefe“.
Enzyme sind biologisch aktive Substanzen, daher kann jede Reaktion, die in einer Zelle abläuft, nicht ohne ihre Beteiligung auskommen. Diese Substanzen wirken als Katalysatoren. Dementsprechend hat jedes Enzym zwei Haupteigenschaften:
1) Das Enzym beschleunigt die biochemische Reaktion, wird aber nicht verbraucht.
2) Der Wert der Gleichgewichtskonstante ändert sich nicht, sondern beschleunigt nur das Erreichen dieses Wertes.
Enzyme beschleunigen biochemische Reaktionen um das Tausend- und in einigen Fällen Millionenfache. Dies bedeutet, dass in Abwesenheit eines enzymatischen Apparats alle intrazellulären Prozesse praktisch zum Erliegen kommen und die Zelle selbst absterben wird. Daher ist die Rolle von Enzymen als biologisch aktive Substanzen groß.
Eine Vielzahl von Enzymen ermöglicht es Ihnen, die Regulation des Zellstoffwechsels zu diversifizieren. An jeder Reaktionskaskade sind viele Enzyme verschiedener Klassen beteiligt. Biologische Katalysatoren sind aufgrund der spezifischen Konformation des Moleküls hochselektiv. Da Enzyme in den meisten Fällen proteinartiger Natur sind, liegen sie in einer Tertiär- oder Quartärstruktur vor. Dies wird wiederum durch die Spezifität des Moleküls erklärt.
Funktionen von Enzymen in der Zelle
Die Hauptaufgabe des Enzyms besteht darin, die entsprechende Reaktion zu beschleunigen. Jede Kaskade von Prozessen, von der Zersetzung von Wasserstoffperoxid bis zur Glykolyse, erfordert das Vorhandensein eines biologischen Katalysators.
Das korrekte Funktionieren von Enzymen wird durch eine hohe Spezifität für ein bestimmtes Substrat erreicht. Das bedeutet, dass ein Katalysator nur eine bestimmte Reaktion beschleunigen kann und keine andere, auch keine sehr ähnliche. Je nach Spezifitätsgrad werden folgende Gruppen von Enzymen unterschieden:
1) Enzyme mit absoluter Spezifität, wenn nur eine einzige Reaktion katalysiert wird. Beispielsweise baut Kollagenase Kollagen ab und Maltase baut Maltose ab.
2) Enzyme mit relativer Spezifität. Dazu gehören Substanzen, die eine bestimmte Klasse von Reaktionen katalysieren können, wie beispielsweise die hydrolytische Spaltung.
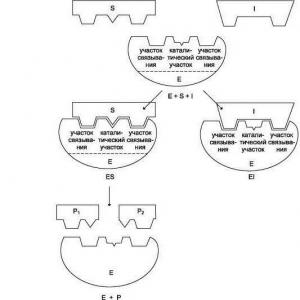
Die Arbeit eines Biokatalysators beginnt mit dem Moment der Anlagerung seines aktiven Zentrums an das Substrat. Man spricht in diesem Fall von einer komplementären Interaktion wie Schloss und Schlüssel. Hier meinen wir die vollständige Übereinstimmung der Form des aktiven Zentrums mit dem Substrat, wodurch die Reaktion beschleunigt werden kann.
Der nächste Schritt ist die Reaktion selbst. Seine Geschwindigkeit erhöht sich aufgrund der Wirkung des Enzymkomplexes. Am Ende erhalten wir ein Enzym, das mit den Reaktionsprodukten assoziiert ist.
Der letzte Schritt ist die Ablösung der Reaktionsprodukte vom Enzym, wonach das aktive Zentrum für die nächste Arbeit wieder frei wird.
Schematisch kann die Arbeit des Enzyms auf jeder Stufe wie folgt geschrieben werden:
1) S + E ——> SE
2) SE ——> SP
3) SP ——> S + P, wobei S das Substrat, E das Enzym und P das Produkt ist.

Enzymklassifizierung
Im menschlichen Körper gibt es eine Vielzahl von Enzymen. Das gesamte Wissen über ihre Funktionen und Arbeit wurde systematisiert, und als Ergebnis erschien eine einzige Klassifizierung, anhand derer leicht festgestellt werden kann, wofür dieser oder jener Katalysator bestimmt ist. Hier sind die 6 Hauptklassen von Enzymen sowie Beispiele einiger Untergruppen.
- Oxidoreduktasen.
Enzyme dieser Klasse katalysieren Redoxreaktionen. Insgesamt gibt es 17 Untergruppen. Oxidoreduktasen haben normalerweise einen Nicht-Protein-Teil, repräsentiert durch ein Vitamin oder Häm.
Unter den Oxidoreduktasen findet man häufig folgende Untergruppen:
a) Dehydrogenasen. Die Biochemie von Dehydrogenase-Enzymen besteht in der Eliminierung von Wasserstoffatomen und deren Übertragung auf ein anderes Substrat. Diese Untergruppe findet sich am häufigsten in den Reaktionen der Atmung, der Photosynthese. Die Zusammensetzung von Dehydrogenasen enthält notwendigerweise ein Coenzym in Form von NAD/NADP oder Flavoproteinen FAD/FMN. Oft gibt es Metallionen. Beispiele sind Enzyme wie Cytochromreduktase, Pyruvatdehydrogenase, Isocitratdehydrogenase und viele Leberenzyme (Lactatdehydrogenase, Glutamatdehydrogenase etc.).
b) Oxidasen. Eine Reihe von Enzymen katalysieren die Anlagerung von Sauerstoff an Wasserstoff, wodurch die Reaktionsprodukte Wasser oder Wasserstoffperoxid (H 2 0, H 2 0 2) sein können. Beispiele für Enzyme: Cytochromoxidase, Tyrosinase.
c) Peroxidasen und Katalasen sind Enzyme, die den Abbau von H 2 O 2 in Sauerstoff und Wasser katalysieren.
d) Oxygenasen. Diese Biokatalysatoren beschleunigen die Zufuhr von Sauerstoff zum Substrat. Dopaminhydroxylase ist ein Beispiel für solche Enzyme.
2. Transferasen.
Die Aufgabe der Enzyme dieser Gruppe besteht darin, Radikale von der Spendersubstanz auf die Empfängersubstanz zu übertragen.
a) Methyltransferase. DNA-Methyltransferasen, die Hauptenzyme, die den Prozess der Nukleotidreplikation kontrollieren, spielen eine wichtige Rolle bei der Regulierung der Nukleinsäure.
b) Acyltransferasen. Enzyme dieser Untergruppe transportieren die Acylgruppe von einem Molekül zum anderen. Beispiele für Acyltransferasen: Lecithin-Cholesterin-Acyltransferase (überträgt eine funktionelle Gruppe von einer Fettsäure auf Cholesterin), Lysophosphatidylcholin-Acyltransferase (eine Acylgruppe wird auf Lysophosphatidylcholin übertragen).
c) Aminotransferasen – Enzyme, die an der Umwandlung von Aminosäuren beteiligt sind. Beispiele für Enzyme: Alanin-Aminotransferase, die die Synthese von Alanin aus Pyruvat und Glutamat durch Aminogruppentransfer katalysiert.
d) Phosphotransferasen. Enzyme dieser Untergruppe katalysieren die Addition einer Phosphatgruppe. Ein anderer Name für Phosphotransferasen, Kinasen, ist viel gebräuchlicher. Beispiele sind Enzyme wie Hexokinasen und Aspartatkinasen, die Phosphorreste an Hexosen (meist Glucose) bzw. an Asparaginsäure anfügen.
3. Hydrolasen – eine Klasse von Enzymen, die die Spaltung von Bindungen in einem Molekül katalysieren, gefolgt von der Zugabe von Wasser. Substanzen, die zu dieser Gruppe gehören, sind die wichtigsten Verdauungsenzyme.
a) Esterasen - brechen Esterbindungen. Ein Beispiel sind Lipasen, die Fette abbauen.
b) Glykosidasen. Die Biochemie von Enzymen dieser Reihe besteht in der Zerstörung glykosidischer Bindungen von Polymeren (Polysacchariden und Oligosacchariden). Beispiele: Amylase, Sucrase, Maltase.
c) Peptidasen sind Enzyme, die den Abbau von Proteinen in Aminosäuren katalysieren. Peptidasen umfassen Enzyme wie Pepsine, Trypsin, Chymotrypsin, Carboxypeptidase.
d) Amidasen - spalten Amidbindungen. Beispiele: Arginase, Urease, Glutaminase usw. Viele Amidase-Enzyme sind in enthalten
4. Lyasen sind Enzyme, die eine ähnliche Funktion wie Hydrolasen haben, jedoch wird bei der Spaltung von Bindungen in Molekülen kein Wasser verbraucht. Enzyme dieser Klasse enthalten immer einen Nicht-Eiweiß-Anteil, beispielsweise in Form von Vitamin B1 oder B6.
a) Decarboxylasen. Diese Enzyme wirken auf die C-C-Bindung. Beispiele sind Glutamat-Decarboxylase oder Pyruvat-Decarboxylase.
b) Hydratasen und Dehydratasen – Enzyme, die die Reaktion der Spaltung von C-O-Bindungen katalysieren.
c) Amidin-Lyasen – zerstören C-N-Bindungen. Beispiel: Arginin-Succinat-Lyase.
d) P-O-Lyase. Solche Enzyme spalten in der Regel die Phosphatgruppe von der Substratsubstanz ab. Beispiel: Adenylatcyclase.

Die Biochemie von Enzymen basiert auf ihrer Struktur
Die Fähigkeiten jedes Enzyms werden durch seine individuelle, einzigartige Struktur bestimmt. Jedes Enzym ist zunächst einmal ein Protein, und seine Struktur und sein Faltungsgrad bestimmen maßgeblich seine Funktion.
Jeder Biokatalysator zeichnet sich durch das Vorhandensein eines aktiven Zentrums aus, das wiederum in mehrere unabhängige Funktionsbereiche unterteilt ist:
1) Das katalytische Zentrum ist eine spezielle Region des Proteins, entlang der das Enzym an das Substrat gebunden ist. Je nach Konformation des Proteinmoleküls kann das katalytische Zentrum unterschiedliche Formen annehmen, die wie das Schloss zum Schlüssel zum Substrat passen müssen. Eine solch komplexe Struktur erklärt, was sich im tertiären oder quaternären Zustand befindet.
2) Adsorptionszentrum - fungiert als "Halter". Hier besteht zunächst einmal eine Verbindung zwischen dem Enzymmolekül und dem Substratmolekül. Die vom Adsorptionszentrum gebildeten Bindungen sind jedoch sehr schwach, was bedeutet, dass die katalytische Reaktion in diesem Stadium reversibel ist.
3) Allosterische Zentren können sich sowohl im aktiven Zentrum als auch über die gesamte Oberfläche des Enzyms als Ganzes befinden. Ihre Funktion besteht darin, die Funktion des Enzyms zu regulieren. Die Regulation erfolgt mit Hilfe von Inhibitormolekülen und Aktivatormolekülen.

Aktivatorproteine, die an das Enzymmolekül binden, beschleunigen seine Arbeit. Im Gegensatz dazu hemmen Inhibitoren die katalytische Aktivität, und dies kann auf zwei Arten geschehen: Entweder bindet das Molekül an die allosterische Stelle im Bereich des aktiven Zentrums des Enzyms (kompetitive Hemmung) oder es bindet an eine andere Region des Proteins (nichtkompetitive Hemmung). als effizienter angesehen. Immerhin schließt dies den Platz für die Bindung des Substrats an das Enzym, und dieser Vorgang ist nur bei nahezu vollständiger Übereinstimmung der Form des Inhibitormoleküls und des aktiven Zentrums möglich.
Ein Enzym besteht oft nicht nur aus Aminosäuren, sondern auch aus anderen organischen und anorganischen Stoffen. Dementsprechend wird das Apoenzym isoliert - der Proteinteil, das Coenzym - der organische Teil und der Cofaktor - der anorganische Teil. Das Coenzym kann durch Kohlenhydrate, Fette, Nukleinsäuren, Vitamine dargestellt werden. Der Cofaktor wiederum besteht meistens aus Hilfsmetallionen. Die Aktivität von Enzymen wird durch ihre Struktur bestimmt: Zusätzliche Substanzen, aus denen die Zusammensetzung besteht, verändern die katalytischen Eigenschaften. Verschiedene Arten von Enzymen sind das Ergebnis einer Kombination aller aufgeführten Faktoren der Komplexbildung.

Enzymregulierung
Enzyme als biologisch aktive Substanzen sind für den Körper nicht immer notwendig. Die Biochemie von Enzymen ist so beschaffen, dass sie bei übermäßiger Katalyse eine lebende Zelle schädigen können. Um die schädlichen Auswirkungen von Enzymen auf den Körper zu verhindern, ist es notwendig, ihre Arbeit irgendwie zu regulieren.
Da Enzyme von Proteinnatur sind, werden sie bei hohen Temperaturen leicht zerstört. Der Prozess der Denaturierung ist reversibel, kann jedoch die Wirkung von Substanzen erheblich beeinträchtigen.
Der pH-Wert spielt auch eine große Rolle bei der Regulierung. Die größte Aktivität von Enzymen wird in der Regel bei neutralen pH-Werten (7,0-7,2) beobachtet. Es gibt auch Enzyme, die nur im sauren oder nur im basischen Milieu arbeiten. In zellulären Lysosomen wird also ein niedriger pH-Wert aufrechterhalten, bei dem die Aktivität hydrolytischer Enzyme maximal ist. Wenn sie versehentlich in das Zytoplasma gelangen, wo die Umgebung bereits näher an der Neutralität ist, nimmt ihre Aktivität ab. Ein solcher Schutz vor "Selbstverzehr" basiert auf den Merkmalen der Arbeit von Hydrolasen.
Erwähnenswert ist die Bedeutung von Coenzym und Cofaktor bei der Zusammensetzung von Enzymen. Das Vorhandensein von Vitaminen oder Metallionen beeinflusst die Funktion einiger spezifischer Enzyme erheblich.

Enzymnomenklatur
Alle Enzyme des Körpers werden normalerweise nach ihrer Zugehörigkeit zu einer der Klassen sowie nach dem Substrat, mit dem sie reagieren, benannt. Manchmal werden nicht ein, sondern zwei Substrate im Namen verwendet.
Beispiele für die Namen einiger Enzyme:
- Leberenzyme: Laktatdehydrogenase, Glutamatdehydrogenase.
- Vollständiger systematischer Name des Enzyms: Laktat-NAD+-Oxidoredukt-ase.
Es gibt auch Trivialnamen, die sich nicht an die Regeln der Nomenklatur halten. Beispiele sind Verdauungsenzyme: Trypsin, Chymotrypsin, Pepsin.
Enzymsyntheseverfahren
Die Funktionen von Enzymen werden auf genetischer Ebene bestimmt. Da ein Molekül im Großen und Ganzen ein Protein ist, wiederholt seine Synthese genau die Prozesse der Transkription und Translation.
Die Synthese von Enzymen erfolgt nach folgendem Schema. Zunächst werden Informationen über das gewünschte Enzym aus der DNA abgelesen, wodurch mRNA entsteht. Messenger-RNA kodiert für alle Aminosäuren, aus denen das Enzym besteht. Die Regulation von Enzymen kann auch auf DNA-Ebene erfolgen: Wenn das Produkt der katalysierten Reaktion ausreicht, stoppt die Gentranskription und umgekehrt, wenn ein Produkt benötigt wird, wird der Transkriptionsprozess aktiviert.
Nachdem die mRNA in das Zytoplasma der Zelle eingedrungen ist, beginnt der nächste Schritt – die Translation. An den Ribosomen des endoplasmatischen Retikulums wird eine Primärkette synthetisiert, die aus Aminosäuren besteht, die durch Peptidbindungen verbunden sind. Allerdings kann das Proteinmolekül in der Primärstruktur seine enzymatischen Funktionen noch nicht erfüllen.
Die Aktivität von Enzymen hängt von der Struktur des Proteins ab. Auf demselben ER kommt es zu einer Proteinverdrillung, wodurch zunächst Sekundär- und dann Tertiärstrukturen gebildet werden. Die Synthese einiger Enzyme stoppt bereits in diesem Stadium, aber um die katalytische Aktivität zu aktivieren, ist es oft notwendig, ein Coenzym und einen Cofaktor hinzuzufügen.
In bestimmten Bereichen des endoplasmatischen Retikulums lagern sich die organischen Bestandteile des Enzyms an: Monosaccharide, Nukleinsäuren, Fette, Vitamine. Einige Enzyme können ohne die Anwesenheit eines Coenzyms nicht arbeiten.
Der Cofaktor spielt eine entscheidende Rolle bei der Bildung Einige Funktionen von Enzymen stehen erst zur Verfügung, wenn das Protein die Domänenorganisation erreicht. Daher ist für sie das Vorhandensein einer Quartärstruktur sehr wichtig, bei der das Bindeglied zwischen mehreren Proteinkügelchen ein Metallion ist.

Mehrere Formen von Enzymen
Es gibt Situationen, in denen es notwendig ist, mehrere Enzyme zu haben, die dieselbe Reaktion katalysieren, sich aber in einigen Parametern voneinander unterscheiden. Beispielsweise kann ein Enzym bei 20 Grad arbeiten, aber bei 0 Grad kann es seine Funktionen nicht mehr erfüllen. Was sollte ein lebender Organismus in einer solchen Situation bei niedrigen Umgebungstemperaturen tun?
Dieses Problem lässt sich leicht lösen, indem mehrere Enzyme gleichzeitig vorhanden sind, die dieselbe Reaktion katalysieren, aber unter unterschiedlichen Bedingungen arbeiten. Es gibt zwei Arten von mehreren Formen von Enzymen:
- Isoenzyme. Solche Proteine werden von unterschiedlichen Genen kodiert, bestehen aus unterschiedlichen Aminosäuren, katalysieren aber dieselbe Reaktion.
- Wahre Pluralformen. Diese Proteine werden von demselben Gen transkribiert, aber Peptide werden auf den Ribosomen modifiziert. Als Ergebnis werden mehrere Formen desselben Enzyms erhalten.
Infolgedessen wird der erste Typ multipler Formen auf genetischer Ebene gebildet, während der zweite Typ auf posttranslationaler Ebene gebildet wird.
Bedeutung von Enzymen
In der Medizin kommt es auf die Freigabe neuer Medikamente an, in denen die Substanzen bereits in der richtigen Menge enthalten sind. Wissenschaftler haben noch keinen Weg gefunden, die Synthese fehlender Enzyme im Körper anzuregen, aber heute sind Medikamente weit verbreitet, die ihren Mangel vorübergehend ausgleichen können.
Verschiedene Enzyme in der Zelle katalysieren eine Vielzahl lebenserhaltender Reaktionen. Einer dieser Enismen sind Vertreter der Gruppe der Nukleasen: Endonukleasen und Exonukleasen. Ihre Aufgabe ist es, einen konstanten Nukleinsäurespiegel in der Zelle aufrechtzuerhalten und beschädigte DNA und RNA zu entfernen.
Vergessen Sie nicht ein Phänomen wie die Blutgerinnung. Als wirksame Schutzmaßnahme steht dieser Prozess unter der Kontrolle einer Reihe von Enzymen. Das wichtigste ist Thrombin, das das inaktive Protein Fibrinogen in aktives Fibrin umwandelt. Seine Fäden bilden eine Art Netzwerk, das die Schadensstelle des Gefäßes verstopft und so einen übermäßigen Blutverlust verhindert.
Enzyme werden bei der Weinherstellung, beim Brauen und zur Gewinnung vieler fermentierter Milchprodukte verwendet. Hefe kann verwendet werden, um Alkohol aus Glukose herzustellen, aber ein Extrakt davon ist ausreichend für den erfolgreichen Ablauf dieses Prozesses.

Interessante Fakten, die Sie noch nicht kannten
Alle Enzyme des Körpers haben eine riesige Masse - von 5.000 bis 1.000.000 Da. Dies ist auf das Vorhandensein von Protein im Molekül zurückzuführen. Zum Vergleich: Glucose hat ein Molekulargewicht von 180 Da und Kohlendioxid nur 44 Da.
Bis heute wurden mehr als 2.000 Enzyme entdeckt, die in den Zellen verschiedener Organismen gefunden wurden. Die meisten dieser Substanzen sind jedoch noch nicht vollständig verstanden.
Enzymaktivität wird genutzt, um wirksame Waschmittel herzustellen. Hier spielen Enzyme die gleiche Rolle wie im Körper: Sie bauen organische Stoffe ab, und diese Eigenschaft hilft im Kampf gegen Flecken. Es wird empfohlen, ein ähnliches Waschpulver bei einer Temperatur von nicht mehr als 50 Grad zu verwenden, da sonst der Denaturierungsprozess auftreten kann.
Laut Statistik leiden 20 % der Menschen auf der ganzen Welt an einem Mangel an einem der Enzyme.
Die Eigenschaften von Enzymen sind schon sehr lange bekannt, aber erst 1897 erkannten die Menschen, dass nicht die Hefe selbst, sondern ein Extrakt aus ihren Zellen verwendet werden konnte, um Zucker zu Alkohol zu vergären.
Biologische Chemie Lelevich Vladimir Valeryanovich
Der Wirkungsmechanismus von Enzymen
Der Wirkungsmechanismus von Enzymen
Bei jeder enzymatischen Reaktion werden die folgenden Stufen unterschieden:
E+S? ?E+P
wobei E das Enzym ist, S das Substrat ist, der Enzym-Substrat-Komplex ist, P das Produkt ist.
Der Wirkungsmechanismus von Enzymen kann von zwei Standpunkten aus betrachtet werden: vom Standpunkt der Energieänderungen chemischer Reaktionen und vom Standpunkt der Ereignisse im aktiven Zentrum.
Energieänderungen bei chemischen Reaktionen
Alle chemischen Reaktionen laufen ab und gehorchen zwei Grundgesetzen der Thermodynamik: dem Gesetz der Energieerhaltung und dem Gesetz der Entropie. Nach diesen Gesetzen bleibt die Gesamtenergie eines chemischen Systems und seiner Umgebung konstant, während das chemische System dazu neigt, die Ordnung zu verringern (Entropie zu erhöhen). Um die Energie einer chemischen Reaktion zu verstehen, reicht es nicht aus, die Energiebilanz der in die Reaktion ein- und austretenden Stoffe zu kennen. Es ist notwendig, die Energieänderungen im Prozess einer bestimmten chemischen Reaktion und die Rolle von Enzymen in der Dynamik dieses Prozesses zu berücksichtigen.
Je mehr Moleküle eine Energie haben, die das Niveau von Ea (Aktivierungsenergie) übersteigt, desto höher ist die Geschwindigkeit einer chemischen Reaktion. Die Geschwindigkeit einer chemischen Reaktion kann durch Erhitzen erhöht werden. Dadurch erhöht sich die Energie der reagierenden Moleküle. Hohe Temperaturen sind jedoch für lebende Organismen schädlich, daher werden Enzyme in der Zelle verwendet, um chemische Reaktionen zu beschleunigen. Enzyme sorgen für eine hohe Reaktionsgeschwindigkeit unter optimalen Bedingungen, die in der Zelle herrschen, indem sie den Ea-Spiegel senken. Enzyme verringern also die Höhe der Energiebarriere, wodurch die Anzahl der reaktiven Moleküle zunimmt und folglich die Reaktionsgeschwindigkeit zunimmt.
Die Rolle des aktiven Zentrums in der enzymatischen Katalyse
Als Ergebnis der Forschung wurde gezeigt, dass das Enzymmolekül in der Regel um ein Vielfaches größer ist als das Substratmolekül, das durch dieses Enzym einer chemischen Umwandlung unterzogen wird. Nur ein kleiner Teil des Enzymmoleküls kommt mit dem Substrat in Kontakt, normalerweise 5 bis 10 Aminosäurereste, die das aktive Zentrum des Enzyms bilden. Die Rolle der verbleibenden Aminosäurereste besteht darin, die richtige Konformation des Enzymmoleküls für den optimalen Ablauf der chemischen Reaktion sicherzustellen.
Das aktive Zentrum in allen Stadien der enzymatischen Katalyse kann nicht als passives Zentrum für die Substratbindung angesehen werden. Es ist eine komplexe molekulare "Maschine", die eine Vielzahl chemischer Mechanismen nutzt, die die Umwandlung eines Substrats in ein Produkt fördern.
Im aktiven Zentrum des Enzyms sind die Substrate so angeordnet, dass die funktionellen Gruppen der an der Reaktion beteiligten Substrate in unmittelbarer Nähe zueinander liegen. Diese Eigenschaft des aktiven Zentrums wird als Effekt der Annäherung und Orientierung der Reaktanden bezeichnet. Eine solche geordnete Anordnung von Substraten führt zu einer Abnahme der Entropie und als Folge davon zu einer Abnahme der Aktivierungsenergie (Ea), die die katalytische Effizienz von Enzymen bestimmt.
Das aktive Zentrum des Enzyms trägt auch zur Destabilisierung interatomarer Bindungen im Substratmolekül bei, was den Ablauf einer chemischen Reaktion und die Bildung von Produkten erleichtert. Diese Eigenschaft des aktiven Zentrums wird als Substratdeformationseffekt bezeichnet.
Aus dem Buch Die neue Wissenschaft des Lebens Autor Sheldrake Rupert2.2. Mechanismus Die moderne mechanistische Theorie der Morphogenese weist der DNA aus den folgenden vier Gründen eine wichtige Rolle zu. Erstens wurde festgestellt, dass viele Fälle erblicher Unterschiede zwischen Tieren oder Pflanzen einer bestimmten Art von Genen abhängen
Aus dem Buch Die Menschheit Autor Barnett AnthonyWirkungsmechanismus des Nervensystems Vielleicht sollten wir uns jetzt den Wirkungsmechanismus dieses komplexen Gebildes näher ansehen, beginnend mit einem einfachen Beispiel. Wenn ein helles Licht in die Augen gerichtet wird, verengt sich die Pupille einer Person. Diese Reaktion hängt von einer ganzen Reihe von Ereignissen ab, die in beginnen
Aus dem Buch Die Geschichte eines Unfalls [oder Die Abstammung des Menschen] Autor Vishnyatsky Leonid Borisovich Aus dem Buch Reise ins Land der Mikroben Autor Betina WladimirMikroben - Hersteller von Enzymen Wir wissen bereits, dass Enzyme biologische Katalysatoren sind, dh Substanzen, die zur Durchführung vieler chemischer Reaktionen beitragen, die in einer lebenden Zelle ablaufen und für die Gewinnung von Nährstoffen und deren Aufbau notwendig sind
Aus dem Buch Embryonen, Gene und Evolution der Autor Raff Rudolph AHeterochronie – der klassische Mechanismus evolutionärer Veränderungen Versuche, die Mechanismen der Evolution zu finden, die in der Ontogenese verwurzelt sind, konzentrieren sich hauptsächlich auf Heterochronie – Veränderungen im relativen Timing von Entwicklungsprozessen. Haeckel betonte die Abhängigkeit
Aus dem Buch Natural Technologies of Biological Systems Autor Ugolev Alexander Michailowitsch2.2. Allgemeine Eigenschaften von Verdauungsenzymen Es wird auf die grundlegende Ähnlichkeit und manchmal auffallende Koinzidenz der Enzymsysteme hingewiesen, die die Verdauung in verschiedenen Organismen durchführen. Daher sind die Eigenschaften, die im Folgenden dargestellt werden,
Aus dem Buch Das Geheimnis Gottes und die Wissenschaft des Gehirns [Neurobiologie des Glaubens und der religiösen Erfahrung] von Newberg Andrew2. Apparat des Gehirns. Mechanismus der Wahrnehmung
Aus dem Buch der Phenetik [Evolution, Bevölkerung, Zeichen] Autor Jablokow Alexej WladimirowitschKapitel I. Der Mechanismus der Evolution Die strategische Hauptaufgabe der Biologie als Wissenschaftsdisziplin ist die Kenntnis der Muster der Lebensentwicklung, um sie im Interesse des Menschen zu steuern. Bereits in den 1920er Jahren stellte N. I. Vavilov Wissenschaftlern das Problem des Übergangs zur kontrollierten Evolution -
Aus dem Buch Was, wenn Lamarck Recht hat? Immungenetik und Evolution Autor Steele EdwardDas Zusammenspiel evolutionärer Kräfte – der Mechanismus der Evolution Der Auslösemechanismus der Evolution funktioniert als Ergebnis des Zusammenwirkens evolutionärer Faktoren innerhalb der Population als evolutionäre Einheit. Jede Population in jeder Art ist der einen oder anderen Art von Druck ausgesetzt.
Aus dem Buch Secrets of Sex [Man and Woman in the Mirror of Evolution] Autor Butowskaja Marina Lwowna Aus dem Buch Biologische Chemie Autor Lelevich Wladimir ValeryanovichDosiskompensationsmechanismus Bei der überwiegenden Mehrheit der Säugetiere (aber nicht der Beuteltiere) ist eines der X-Chromosomen in den somatischen Zellen der Weibchen inaktiviert. Ein solcher Ausschluss ist eine der Optionen zur Lösung des Problems bei Arten, bei denen ein Geschlecht durch zwei repräsentiert wird
Aus dem Buch des AutorsKapitel 3. Enzyme. Der Wirkungsmechanismus von Enzymen Enzyme oder Enzyme werden spezifische Proteine genannt, die Bestandteil aller Zellen und Gewebe lebender Organismen sind und als biologische Katalysatoren wirken Allgemeine Eigenschaften von Enzymen und anorganischen Katalysatoren: 1. Nicht
Aus dem Buch des AutorsDie Struktur des Enzymmoleküls Der Struktur nach können Enzyme einfache und komplexe Proteine sein. Ein Enzym, das ein komplexes Protein ist, wird als Holoenzym bezeichnet. Der Proteinteil eines Enzyms wird als Apoenzym bezeichnet, der Nicht-Proteinteil als Cofaktor. Es gibt zwei Arten von Cofaktoren: 1.
Aus dem Buch des AutorsWirkungsspezifität von Enzymen Enzyme haben im Vergleich zu anorganischen Katalysatoren eine höhere Wirkungsspezifität. Es gibt Spezifität in Bezug auf die Art der chemischen Reaktion, die durch das Enzym katalysiert wird, und Spezifität in Bezug auf
Aus dem Buch des AutorsKapitel 4. Regulation der Enzymaktivität. Medizinische Enzymologie Methoden der Regulation der Enzymaktivität: 1. Änderung der Anzahl der Enzyme.2. Änderung der katalytischen Effizienz des Enzyms.3. Änderung der Reaktionsbedingungen Mengenregulierung
Aus dem Buch des AutorsDie Verwendung von Enzymen in der Medizin Enzympräparate sind in der Medizin weit verbreitet. Enzyme werden in der medizinischen Praxis als diagnostische (Enzymdiagnostika) und therapeutische (Enzymtherapie) Mittel eingesetzt. Darüber hinaus werden Enzyme als verwendet
KapitelIV.3.
Enzyme
Der Stoffwechsel im Körper kann als Gesamtheit aller chemischen Umwandlungen definiert werden, die von außen kommende Verbindungen durchlaufen. Diese Umwandlungen umfassen alle bekannten Arten chemischer Reaktionen: intermolekulare Übertragung funktioneller Gruppen, hydrolytische und nicht-hydrolytische Spaltung chemischer Bindungen, intramolekulare Umlagerung, Neubildung chemischer Bindungen und Redoxreaktionen. Solche Reaktionen laufen im Körper nur in Gegenwart von Katalysatoren mit extrem hoher Geschwindigkeit ab. Alle biologischen Katalysatoren sind Substanzen proteinartiger Natur und werden als Enzyme (im Folgenden F) oder Enzyme (E) bezeichnet.
Enzyme sind keine Komponenten von Reaktionen, sondern beschleunigen nur das Erreichen des Gleichgewichts, indem sie die Geschwindigkeit sowohl der direkten als auch der umgekehrten Umwandlungen erhöhen. Die Beschleunigung der Reaktion erfolgt aufgrund einer Abnahme der Aktivierungsenergie - der Energiebarriere, die einen Zustand des Systems (die anfängliche chemische Verbindung) von einem anderen (dem Reaktionsprodukt) trennt.
Enzyme beschleunigen eine Vielzahl von Reaktionen im Körper. Ganz einfach aus Sicht der traditionellen Chemie erfordert also die Reaktion der Abspaltung von Wasser aus Kohlensäure unter Bildung von CO 2 die Beteiligung eines Enzyms, denn ohne sie läuft es zu langsam ab, um den pH-Wert des Blutes zu regulieren. Dank der katalytischen Wirkung von Enzymen im Körper wird es möglich, solche Reaktionen durchzuführen, die ohne Katalysator hundert- und tausendmal langsamer ablaufen würden.
Enzymeigenschaften
1. Einfluss auf die Geschwindigkeit einer chemischen Reaktion: Enzyme erhöhen die Geschwindigkeit einer chemischen Reaktion, werden aber selbst nicht verbraucht.
Die Reaktionsgeschwindigkeit ist die Änderung der Konzentration der Reaktionskomponenten pro Zeiteinheit. Geht es in Vorwärtsrichtung, dann ist es proportional zur Konzentration der Reaktanten, geht es in die entgegengesetzte Richtung, dann ist es proportional zur Konzentration der Reaktionsprodukte. Das Verhältnis der Geschwindigkeiten von Hin- und Rückreaktion wird als Gleichgewichtskonstante bezeichnet. Enzyme können die Werte der Gleichgewichtskonstante nicht ändern, aber der Gleichgewichtszustand in Gegenwart von Enzymen stellt sich schneller ein.
2. Die Spezifität der Wirkung von Enzymen. In den Körperzellen finden 2-3 Tausend Reaktionen statt, von denen jede durch ein bestimmtes Enzym katalysiert wird. Die Spezifität der Wirkung eines Enzyms ist die Fähigkeit, den Verlauf einer bestimmten Reaktion zu beschleunigen, ohne die Geschwindigkeit anderer, sogar sehr ähnlicher, zu beeinflussen.
Unterscheiden:
Absolut– wenn F nur eine bestimmte Reaktion katalysiert ( Arginase- Abbau von Arginin)
Relativ(Gruppenspezial) - F katalysiert eine bestimmte Reaktionsklasse (z. B. hydrolytische Spaltung) oder Reaktionen mit einer bestimmten Stoffklasse.
Die Spezifität von Enzymen beruht auf ihrer einzigartigen Aminosäuresequenz, die die Konformation des aktiven Zentrums bestimmt, das mit den Reaktionskomponenten interagiert.
Man nennt eine Substanz, deren chemische Umwandlung durch ein Enzym katalysiert wird Substrat (
S ) .3. Die Aktivität von Enzymen ist die Fähigkeit, die Reaktionsgeschwindigkeit in unterschiedlichem Maße zu beschleunigen. Aktivität wird ausgedrückt in:
1) Internationale Aktivitätseinheiten – (IU) die Menge des Enzyms, die die Umwandlung von 1 μM des Substrats in 1 Minute katalysiert.
2) Katalach (Katze) - die Menge an Katalysator (Enzym), die in der Lage ist, 1 mol Substrat in 1 s umzuwandeln.
3) Spezifische Aktivität – die Anzahl der Aktivitätseinheiten (einer der oben genannten) in der Testprobe im Verhältnis zur Gesamtproteinmasse in dieser Probe.
4) Weniger häufig wird die molare Aktivität verwendet – die Anzahl der Substratmoleküle, die von einem Enzymmolekül pro Minute umgewandelt werden.
Aktivität hängt ab Temperatur . Dieses oder jenes Enzym zeigt bei optimaler Temperatur die größte Aktivität. Für F eines lebenden Organismus liegt dieser Wert zwischen +37,0 und +39,0
° C, je nach Tierart. Mit sinkender Temperatur verlangsamt sich die Brown'sche Molekularbewegung, die Diffusionsgeschwindigkeit nimmt ab und folglich verlangsamt sich der Prozess der Komplexbildung zwischen dem Enzym und den Reaktionskomponenten (Substraten). Bei Temperaturanstieg über +40 - +50° Mit dem Enzymmolekül, das ein Protein ist, durchläuft es einen Denaturierungsprozess. Gleichzeitig sinkt die Geschwindigkeit der chemischen Reaktion merklich (Abb. 4.3.1.).Die Enzymaktivität hängt auch davon ab mittlerer pH-Wert . Für die meisten von ihnen gibt es einen bestimmten optimalen pH-Wert, bei dem ihre Aktivität maximal ist. Da die Zelle Hunderte von Enzymen enthält und jedes von ihnen seine eigenen optimalen pH-Grenzwerte hat, ist die Änderung des pH-Werts einer der wichtigen Faktoren bei der Regulierung der Enzymaktivität. Als Ergebnis einer chemischen Reaktion unter Beteiligung eines bestimmten Enzyms, dessen pH-Wert im Bereich von 7,0 bis 7,2 liegt, wird ein Produkt gebildet, das eine Säure ist. Dabei verschiebt sich der pH-Wert in den Bereich von 5,5 - 6,0. Die Aktivität des Enzyms nimmt stark ab, die Geschwindigkeit der Produktbildung verlangsamt sich, aber ein anderes Enzym wird aktiviert, für das diese pH-Werte optimal sind, und das Produkt der ersten Reaktion wird einer weiteren chemischen Umwandlung unterzogen. (Ein weiteres Beispiel über Pepsin und Trypsin).
Die chemische Natur von Enzymen. Die Struktur des Enzyms. Aktive und allosterische Zentren
Alle Enzyme sind Proteine mit einem Molekulargewicht von 15.000 bis mehreren Millionen Da. Entsprechend der chemischen Struktur sind sie es einfach Enzyme (bestehen nur aus AA) und Komplex Enzyme (haben einen Nicht-Protein-Teil oder eine prosthetische Gruppe). Der Proteinanteil wird genannt Apoenzym, und Nicht-Protein, wenn es kovalent an ein Apoenzym gebunden ist, dann wird es genannt Coenzym, und wenn die Bindung nicht kovalent ist (ionisch, Wasserstoff) - Cofaktor . Die Funktionen der prosthetischen Gruppe sind wie folgt: Beteiligung am Katalyseakt, Kontakt zwischen dem Enzym und dem Substrat, Stabilisierung des Enzymmoleküls im Raum.
Anorganische Substanzen wirken normalerweise als Cofaktor - Ionen von Zink, Kupfer, Kalium, Magnesium, Calcium, Eisen, Molybdän.
Coenzyme können als integraler Bestandteil des Enzymmoleküls betrachtet werden. Dies sind organische Substanzen, darunter: Nukleotide ( ATP, UMF, etc.), Vitamine oder deren Derivate ( TDF- von Thiamin ( IN 1), FMN- von Riboflavin ( IN 2), Coenzym A- aus Pantothensäure ( UM 3), NAD usw.) und Tetrapyrrol-Coenzyme - Häme.
Bei der Katalyse der Reaktion kommt nicht das gesamte Enzymmolekül mit dem Substrat in Kontakt, sondern ein bestimmter Teil davon, der als bezeichnet wird aktives Zentrum. Diese Zone des Moleküls besteht nicht aus einer Abfolge von Aminosäuren, sondern entsteht, wenn das Eiweißmolekül zu einer Tertiärstruktur verdrillt wird. Getrennte Abschnitte von Aminosäuren nähern sich einander und bilden eine bestimmte Konfiguration des aktiven Zentrums. Ein wichtiges strukturelles Merkmal des aktiven Zentrums besteht darin, dass seine Oberfläche komplementär zur Oberfläche des Substrats ist; AA-Reste dieser Zone des Enzyms können mit bestimmten Gruppen des Substrats in chemische Wechselwirkung treten. Das kann man sich vorstellen Das aktive Zentrum des Enzyms passt wie Schlüssel und Schloss zur Struktur des Substrats.
V aktives Zentrum Es werden zwei Zonen unterschieden: Bindungszentrum, verantwortlich für die Befestigung des Substrats, und katalytisches Zentrum verantwortlich für die chemische Umwandlung des Substrats. Die Zusammensetzung des katalytischen Zentrums der meisten Enzyme umfasst solche AAs wie Ser, Cys, His, Tyr, Lys. Komplexe Enzyme im katalytischen Zentrum haben einen Cofaktor oder Coenzym.
Neben dem aktiven Zentrum sind eine Reihe von Enzymen mit einem regulatorischen (allosterischen) Zentrum ausgestattet. Substanzen, die seine katalytische Aktivität beeinflussen, interagieren mit dieser Zone des Enzyms.
Der Wirkungsmechanismus von Enzymen
Der Akt der Katalyse besteht aus drei aufeinanderfolgenden Stufen.
1. Bildung eines Enzym-Substrat-Komplexes während der Wechselwirkung durch das aktive Zentrum.
2. Die Bindung des Substrats erfolgt an mehreren Stellen des aktiven Zentrums, was zu einer Änderung der Struktur des Substrats führt, dessen Verformung aufgrund einer Änderung der Bindungsenergie im Molekül. Dies ist die zweite Stufe und wird als Substrataktivierung bezeichnet. Wenn dies auftritt, eine bestimmte chemische Modifikation des Substrats und seine Umwandlung in ein neues Produkt oder neue Produkte.
3. Als Folge einer solchen Umwandlung verliert die neue Substanz (das Produkt) ihre Fähigkeit, im aktiven Zentrum des Enzyms gehalten zu werden, und das Enzym-Substrat bzw. der Enzym-Produkt-Komplex dissoziiert (zerfällt).
Arten von katalytischen Reaktionen:
A + E \u003d AE \u003d BE \u003d E + B
A + B + E \u003d AE + B \u003d ABE \u003d AB + E
AB + E \u003d ABE \u003d A + B + E, wobei E ein Enzym ist, A und B Substrate oder Reaktionsprodukte sind.
Enzymatische Effektoren - Substanzen, die die Geschwindigkeit der enzymatischen Katalyse verändern und dadurch den Stoffwechsel regulieren. Darunter werden unterschieden Inhibitoren - Verlangsamung der Reaktionsgeschwindigkeit und Aktivatoren - Beschleunigung der enzymatischen Reaktion.
Je nach Mechanismus der Hemmung der Reaktion werden kompetitive und nicht-kompetitive Inhibitoren unterschieden. Die Struktur des kompetitiven Inhibitormoleküls ähnelt der Struktur des Substrats und fällt mit der Oberfläche des aktiven Zentrums zusammen wie ein Schlüssel mit einem Schloss (oder fällt fast zusammen). Der Grad dieser Ähnlichkeit kann sogar höher sein als beim Substrat.
Wenn A + E \u003d AE \u003d BE \u003d E + B, dann I + E \u003d IE
¹Die Konzentration des zur Katalyse befähigten Enzyms nimmt ab und die Bildungsgeschwindigkeit der Reaktionsprodukte nimmt stark ab (Abb. 4.3.2.).

Als kompetitive Inhibitoren wirken eine Vielzahl von Chemikalien endogenen und exogenen Ursprungs (d.h. körpereigene bzw. von außen kommende Fremdstoffe). Körpereigene Stoffe sind Regulatoren des Stoffwechsels und werden als Antimetaboliten bezeichnet. Viele von ihnen werden vielleicht bei der Behandlung von onkologischen und mikrobiellen Erkrankungen eingesetzt. sie hemmen wichtige Stoffwechselreaktionen von Mikroorganismen (Sulfonamide) und Tumorzellen. Aber mit einem Überschuss des Substrats und einer niedrigen Konzentration eines kompetitiven Inhibitors wird seine Wirkung aufgehoben.
Die zweite Art von Inhibitoren ist nicht kompetitiv. Sie interagieren mit dem Enzym außerhalb des aktiven Zentrums, und ein Überschuss an Substrat beeinflusst ihre Inhibitorfähigkeit nicht, wie dies bei kompetitiven Inhibitoren der Fall ist. Diese Inhibitoren interagieren entweder mit bestimmten Gruppen des Enzyms (Schwermetalle binden an die Thiolgruppen von Cys) oder meistens mit dem regulatorischen Zentrum, was die Bindungsfähigkeit des aktiven Zentrums verringert. Der eigentliche Vorgang der Hemmung ist die vollständige oder teilweise Unterdrückung der Enzymaktivität unter Beibehaltung ihrer primären und räumlichen Struktur.
Es gibt auch reversible und irreversible Hemmungen. Irreversible Inhibitoren inaktivieren das Enzym, indem sie eine chemische Bindung mit seinem AA oder anderen Strukturkomponenten eingehen. Üblicherweise ist dies eine kovalente Bindung mit einer der Stellen des aktiven Zentrums. Ein solcher Komplex dissoziiert unter physiologischen Bedingungen praktisch nicht. In einem anderen Fall stört der Inhibitor die Konformationsstruktur des Enzymmoleküls – wodurch dessen Denaturierung verursacht wird.
Die Wirkung reversibler Inhibitoren kann durch einen Überschuss des Substrats oder durch die Wirkung von Substanzen, die die chemische Struktur des Inhibitors verändern, aufgehoben werden. Kompetitive und nicht-kompetitive Inhibitoren sind in den meisten Fällen reversibel.
Neben Inhibitoren sind auch Aktivatoren der enzymatischen Katalyse bekannt. Sie:
1) schützen das Enzymmolekül vor inaktivierenden Wirkungen,
2) mit dem Substrat einen Komplex bilden, der aktiver an das aktive Zentrum von F bindet,
3) in Wechselwirkung mit einem Enzym mit quartärer Struktur trennen sie dessen Untereinheiten und öffnen dadurch den Zugang für das Substrat zum aktiven Zentrum.
Verteilung von Enzymen im Körper
Enzyme, die an der Synthese von Proteinen, Nukleinsäuren und Enzymen des Energiestoffwechsels beteiligt sind, sind in allen Körperzellen vorhanden. Aber Zellen, die spezielle Funktionen erfüllen, enthalten auch spezielle Enzyme. So enthalten die Zellen der Langerhansschen Inseln in der Bauchspeicheldrüse Enzyme, die die Synthese der Hormone Insulin und Glukagon katalysieren. Enzyme, die nur den Zellen bestimmter Organe eigen sind, werden als organspezifisch bezeichnet: Arginase und Urokinase- Leber, saure Phosphatase- Prostata. Durch Veränderung der Konzentration solcher Enzyme im Blut wird das Vorhandensein von Pathologien in diesen Organen beurteilt.
In der Zelle sind einzelne Enzyme im Zytoplasma verteilt, andere sind in die Membranen der Mitochondrien und des endoplasmatischen Retikulums eingebettet und bilden solche Enzyme Fächer, in denen bestimmte, eng verwandte Stoffwechselstadien ablaufen.
Viele Enzyme werden in Zellen gebildet und in inaktivem Zustand in die anatomischen Hohlräume ausgeschieden – das sind Proenzyme. Oft werden in Form von Proenzymen proteolytische Enzyme (Proteine abbauen) gebildet. Dann erfolgt unter dem Einfluss von pH oder anderen Enzymen und Substraten ihre chemische Modifikation und das aktive Zentrum wird für die Substrate verfügbar.
Es gibt auch Isoenzyme - Enzyme, die sich in der molekularen Struktur unterscheiden, aber die gleiche Funktion erfüllen.
Nomenklatur und Klassifikation von Enzymen
Der Name des Enzyms setzt sich aus folgenden Teilen zusammen:
1. der Name des Substrats, mit dem es interagiert
2. die Natur der katalysierten Reaktion
3. der Name der Enzymklasse (ist aber optional)
4. Suffix -aza-
Pyruvat - Decarboxyl - Aza, Succinat - Dehydrogen - Aza
Da bereits etwa 3000 Enzyme bekannt sind, müssen sie klassifiziert werden. Derzeit wurde eine internationale Klassifizierung von Enzymen angenommen, die auf der Art der katalysierten Reaktion basiert. Es gibt 6 Klassen, die wiederum in mehrere Unterklassen unterteilt sind (in diesem Buch werden sie nur punktuell vorgestellt):
1. Oxidoreduktasen. Redoxreaktionen katalysieren. Sie sind in 17 Unterklassen unterteilt. Alle Enzyme enthalten einen Nichtproteinteil in Form von Häm oder Derivaten der Vitamine B 2, B 5. Das zu oxidierende Substrat wirkt als Wasserstoffdonor.
1.1. Dehydrogenasen entfernen Wasserstoff von einem Substrat und übertragen ihn auf andere Substrate. Coenzyme NAD, NADP, FAD, FMN. Sie nehmen den vom Enzym abgespaltenen Wasserstoff in die reduzierte Form (NADH, NADPH, FADH) auf und übertragen ihn auf einen anderen Enzym-Substrat-Komplex, wo er abgegeben wird.
1.2. Oxidase - katalysiert die Übertragung von Wasserstoff zu Sauerstoff unter Bildung von Wasser oder H 2 O 2. F. Cytochromoxysdase Atmungskette.
RH + NAD H + O 2 = ROH + NAD + H 2 O
1.3. Monooxidasen - Cytochrom P450. Entsprechend seiner Struktur sowohl Hämo- als auch Flavoprotein. Es hydroxyliert lipophile Xenobiotika (durch den oben beschriebenen Mechanismus).
1.4. Peroxidasenund Katalase- katalysieren die Zersetzung von Wasserstoffperoxid, das bei Stoffwechselreaktionen entsteht.
1.5. Oxygenasen - katalysieren die Reaktionen der Sauerstoffaddition an das Substrat.
2. Transferasen - die Übertragung verschiedener Radikale vom Donormolekül auf das Akzeptormolekül katalysieren.
EIN ein+ E + B = E ein+ A + B = E + B ein+A
2.1. Methyltransferase (CH 3 -).
2.2 Carboxyl- und Carbamoyltransferasen.
2.2. Acyltransferasen - Coenzym A (Acylgruppentransfer - RC=O).
Beispiel: Synthese des Neurotransmitters Acetylcholin (siehe Kapitel „Eiweißstoffwechsel“).
2.3. Hexosyltransferasen katalysieren die Übertragung von Glykosylresten.
Beispiel: die Spaltung eines Glukosemoleküls von Glykogen unter Einwirkung von Phosphorylase.
2.4. Aminotransferasen - Übertragung von Aminogruppen
R1-CO-R2+R1-CH- NH 3 - R. 2 \u003d R. 1 - CH - NH 3 - R 2 + R 1 - CO - R 2
Sie spielen eine wichtige Rolle bei der Transformation von AK. Das gemeinsame Coenzym ist Pyridoxalphosphat.
Beispiel: Alanin-Aminotransferase(AlAT): Pyruvat + Glutamat = Alanin + Alpha-Ketoglutarat (siehe Kapitel „Eiweißstoffwechsel“).
2.5. Phosphotransferese (Kinase) - katalysieren die Übertragung eines Phosphorsäurerests. In den meisten Fällen ist ATP der Phosphatspender. Enzyme dieser Klasse sind hauptsächlich am Prozess des Glukoseabbaus beteiligt.
Beispiel: Hexo (Gluco)-Kinase.
3. Hydrolasen - Hydrolysereaktionen katalysieren, d.h. Spaltung von Stoffen mit Zugabe an der Stelle der Wasserbindung. Diese Klasse umfasst hauptsächlich Verdauungsenzyme, sie sind einkomponentig (enthalten keinen Nicht-Protein-Teil)
R1-R2 + H 2 O \u003d R1H + R2OH
3.1.
Esterasen – bauen essentielle Bindungen ab. Dies ist eine große Unterklasse von Enzymen, die die Hydrolyse von Thiolestern, Phosphoestern katalysieren.
Beispiel: NH 2 ).
Beispiel: Arginase(Harnstoffzyklus).
4. Liebschaften - die Spaltungsreaktionen von Molekülen ohne Zugabe von Wasser katalysieren. Diese Enzyme haben einen Nicht-Protein-Teil in Form von Thiaminpyrophosphat (B 1) und Pyridoxalphosphat (B 6).
4.1. C-C-Bindungslyasen. Sie werden allgemein als Decarboxylasen bezeichnet.
Beispiel: Pyruvatdecarboxylase.
5.Isomerasen - Isomerisierungsreaktionen katalysieren.
Beispiel: Phosphopentose-Isomerase, Pentosephosphatisomerase(Enzyme des nichtoxidativen Zweigs des Pentosephosphatwegs).
6. Ligasen katalysieren die Synthese komplexerer Substanzen aus einfachen. Solche Reaktionen verlaufen unter Aufwendung von ATP-Energie. Synthetase wird dem Namen solcher Enzyme hinzugefügt.
LITERATUR ZUM KAPITEL
IV.3.1. Byshevsky A. Sh., Tersenov O. A. Biochemie für einen Arzt // Ekaterinburg: Ural worker, 1994, 384 S.;
2. Knorre D. G., Myzina S. D. Biologische Chemie. - M.: Höher. Schule 1998, 479 S.;
3. Filippovich Yu. B., Egorova T. A., Sevastyanova G. A. Workshop über allgemeine Biochemie // M.: Prosveschenie, 1982, 311 S.;
4. Lehninger A. Biochemie. Molekulare Grundlagen des Aufbaus und der Funktionen der Zelle // M.: Mir, 1974, 956 S.;
5. Pustovalova L.M. Workshop zur Biochemie // Rostov-on-Don: Phoenix, 1999, 540 p.