Kaliumpermanganat-Alkan in saurem Medium. Oxidation verschiedener Klassen organischer Verbindungen
Staatliches Technologisches Institut St. Petersburg
(Technische Universität)
Stuhl organische Chemie Fakultät 4
Gruppe 476
Kursarbeit
Alkenoxidation
Studentin……………………………………… Rytina A.I.
Dozent………………………………... Piterskaya Yu.L.
Sankt Petersburg
Einführung
1. Epoxidierung (Reaktion von N.A. Prilezhaev, 1909)
2. Hydroxylierung
2.1Anti-Hydroxylierung
2.2syn-Hydroxylierung
3. Oxidative Spaltung von Alkenen
4.Ozonolyse
5. Oxidation von Alkenen in Gegenwart von Palladiumsalzen
Abschluss
Liste der verwendeten Quellen
Einführung
Die Oxidation ist eine der wichtigsten und am weitesten verbreiteten Umwandlungen organischer Verbindungen.
Unter Oxidation werden in der organischen Chemie Prozesse verstanden, die zur Abreicherung einer Verbindung an Wasserstoff oder zu ihrer Anreicherung an Sauerstoff führen. Dabei werden dem Molekül Elektronen entzogen. Unter Reduktion versteht man dementsprechend die Ablösung von einem organischen Sauerstoffmolekül bzw. die Anlagerung von Wasserstoff an dieses.
Bei Redoxreaktionen sind Oxidationsmittel Verbindungen mit hoher Elektronenaffinität (Elektrophile) und Reduktionsmittel Verbindungen, die dazu neigen, Elektronen abzugeben (Nukleophile). Die Leichtigkeit der Oxidation einer Verbindung nimmt mit zunehmender Nukleophilie zu.
Bei der Oxidation organischer Verbindungen kommt es in der Regel nicht zu einer vollständigen Elektronenübertragung und damit zu einer Änderung der Wertigkeit von Kohlenstoffatomen. Daher ist das Konzept des Oxidationsgrades – der bedingten Ladung eines Atoms in einem Molekül, berechnet auf der Grundlage der Annahme, dass das Molekül nur aus Ionen besteht – nur bedingt, formal.
Bei der Aufstellung der Gleichungen von Redoxreaktionen ist es notwendig, das Reduktionsmittel, das Oxidationsmittel und die Anzahl der abgegebenen und empfangenen Elektronen zu bestimmen. Die Auswahl der Koeffizienten erfolgt in der Regel nach der Elektronen-Ionen-Balance-Methode (Halbreaktionsmethode).
Diese Methode berücksichtigt den Übergang von Elektronen von einem Atom oder Ion zu einem anderen und berücksichtigt dabei die Art des Mediums (sauer, alkalisch oder neutral), in dem die Reaktion stattfindet. Um die Anzahl der Sauerstoff- und Wasserstoffatome auszugleichen, werden entweder Wassermoleküle und Protonen (bei saurem Medium) oder Wassermoleküle und Hydroxidionen (bei alkalischem Medium) eingebracht.
Daher muss man beim Schreiben der Reduktions- und Oxidationshalbreaktionen von der Zusammensetzung der tatsächlich in der Lösung vorhandenen Ionen ausgehen. Stoffe, die schlecht dissoziiert oder schlecht löslich sind oder sich als Gas entwickeln, sollten in molekularer Form angegeben werden.
Betrachten Sie als Beispiel den Prozess der Ethylenoxidation mit einer verdünnten wässrigen Lösung von Kaliumpermanganat (Wagner-Reaktion). Bei dieser Reaktion wird Ethylen zu Ethylenglykol oxidiert und Kaliumpermanganat zu Mangandioxid reduziert. An die Stelle der Doppelbindung werden zwei Hydroxylgruppen 1 angehängt:
3C 2 H 4 + 2KMnO 4 + 4H 2 O → 3C 2 H 6 O 2 + 2MnO 2 + 2KOH
Reduktionshalbreaktion: MnO 4 ¯ + 2H 2 O + 3 e → MnO 2 + 4OH ¯ 2
Oxidationshalbreaktion: C 2 H 4 + 2OH − − 2 e → C 2 H 6 O 2 3
Schließlich haben wir in ionischer Form:
2MnO 4 ¯ + 4H 2 O + 3C 2 H 4 + 6OH ¯ → 2MnO 2 + 8OH ¯ + 3C 2 H 6 O 2
Nachdem wir die notwendigen Reduktionen ähnlicher Terme durchgeführt haben, schreiben wir die Gleichung in molekularer Form:
3C 2 H 4 + 2KMnO 4 + 4 H 2 O \u003d 3C 2 H 6 O 2 + 2MnO 2 + 2KOH.
Eigenschaften einiger Oxidationsmittel
Sauerstoff
Luftsauerstoff wird in technologischen Prozessen häufig verwendet, da er das billigste Oxidationsmittel ist. Die Oxidation mit Luftsauerstoff ist jedoch mit Schwierigkeiten bei der Steuerung des Prozesses verbunden, der in verschiedene Richtungen abläuft. Die Oxidation erfolgt üblicherweise bei hohe Temperatur in Gegenwart von Katalysatoren.
Ozon
Ozon O 3 wird zur Gewinnung von Aldehyden und Ketonen verwendet, wenn diese auf andere Weise nur schwer zu gewinnen sind. Am häufigsten wird Ozon zur Strukturaufklärung ungesättigter Verbindungen verwendet. Ozon entsteht durch die Einwirkung einer ruhigen elektrischen Entladung auf Sauerstoff. Einer der wesentlichen Vorteile der Ozonierung im Vergleich zur Chlorierung ist die Abwesenheit von Giftstoffen nach der Behandlung 2 .
Kaliumpermanganat
Kaliumpermanganat ist das am häufigsten verwendete Oxidationsmittel. Das Reagenz ist in Wasser (6,0 % bei 20 °C) sowie in Methanol, Aceton und Essigsäure löslich. Zur Oxidation werden wässrige (manchmal acetonische) Lösungen von KMnO 4 in neutralem, saurem oder alkalischem Medium verwendet. Bei der Durchführung des Verfahrens in neutraler Umgebung werden der Reaktionsmasse Salze von Magnesium, Aluminium zugesetzt oder Kohlendioxid durchgeleitet, um das bei der Reaktion freigesetzte Kaliumhydroxid zu neutralisieren. Die Oxidationsreaktion von KMnO 4 in einer sauren Umgebung wird am häufigsten in Gegenwart von Schwefelsäure durchgeführt. Das alkalische Milieu bei der Oxidation wird durch das bei der Reaktion gebildete KOH erzeugt oder es wird zunächst der Reaktionsmasse zugesetzt. In leicht alkalischen und neutralen Medien oxidiert KMnO 4 nach der Gleichung:
KMnO4+ 3 e+ 2H 2 O \u003d K + + MnO 2 + 4OH ¯
in saurer Umgebung:
KMnO4+ 5 e+ 8H + = K + + Mn 2+ + 4H 2 O 3
Kaliumpermanganat wird zur Gewinnung von 1,2-Diolen aus Alkenen, bei der Oxidation primärer Alkohole, Aldehyde und Alkylarene zu Carbonsäuren sowie zur oxidativen Spaltung des Kohlenstoffgerüsts an Mehrfachbindungen eingesetzt.
In der Praxis wird üblicherweise ein relativ großer Überschuss (mehr als 100 %) an KMnO 4 verwendet. Dies liegt daran, dass KMnO 4 unter normalen Bedingungen unter Freisetzung von O 2 teilweise in Mangandioxid zerfällt. Zersetzt sich explosionsartig mit konzentrierter H 2 SO 4, wenn es in Gegenwart von Reduktionsmitteln erhitzt wird; Gemische von Kaliumpermanganat mit organischen Stoffen sind ebenfalls explosionsgefährlich 4 .
Persäuren
Peressig- und Perameisensäure werden durch Umsetzung von 25–90 % Wasserstoffperoxid mit der entsprechenden Carbonsäure nach folgender Reaktion erhalten:
RCOOH + H 2 O 2 = RCOOOH + H 2 O
Bei Essigsäure stellt sich dieses Gleichgewicht relativ langsam ein, üblicherweise wird Schwefelsäure als Katalysator zugesetzt, um die Persäurebildung zu beschleunigen. Ameisensäure allein ist stark genug, um für ein schnelles Gleichgewicht zu sorgen.
Pertrifluoressigsäure, die im Gemisch mit Trifluoressigsäure durch die Reaktion von Trifluoressigsäureanhydrid mit 90 % Wasserstoffperoxid gewonnen wird, ist ein noch stärkeres Oxidationsmittel. Ebenso kann Peressigsäure aus Essigsäureanhydrid und Wasserstoffperoxid gewonnen werden.
Solide M-Chlorperbenzoesäure, da sie relativ sicher in der Handhabung, recht stabil und lange lagerfähig ist.
Die Oxidation erfolgt durch das freigesetzte Sauerstoffatom:
RCOOOH = RCOOH + [O]
Persäuren werden verwendet, um Epoxide aus Alkenen sowie Lactone aus alicyclischen Ketonen zu gewinnen.
Wasserstoffperoxid
Wasserstoffperoxid ist eine farblose Flüssigkeit, die mit Wasser, Ethanol und Diethylether mischbar ist. Eine 30 %ige Lösung von H 2 O 2 wird Perhydrol genannt. Ein hochkonzentriertes Präparat kann mit organischen Stoffen explosionsartig reagieren. Bei der Lagerung zerfällt es in Sauerstoff und Wasser. Die Persistenz von Wasserstoffperoxid nimmt mit der Verdünnung zu. Zur Oxidation werden wässrige Lösungen unterschiedlicher Konzentration (von 3 bis 90 %) in neutralen, sauren oder alkalischen Medien eingesetzt.
H 2 O 2 \u003d H 2 O + [O]
Durch die Einwirkung dieses Reagens auf α,β-ungesättigte Carbonylverbindungen in alkalischem Medium werden die entsprechenden Epoxyaldehyde und Ketone erhalten, Persäuren werden durch Oxidation von Carbonsäuren in saurem Medium synthetisiert. Eine 30 %ige Lösung von H 2 O 2 in Essigsäure oxidiert Alkene zu 1,2-Diolen. Wasserstoffperoxid wird verwendet: zur Gewinnung organischer und anorganischer Peroxide, Na-Perborat und -Percarbonat; als Oxidationsmittel in Raketentreibstoffen; nach Erhalt von Epoxiden, Hydrochinon, Brenzcatechin, Ethylenglykol, Glycerin, Vulkanisationsbeschleunigern der Thiuramgruppe usw.; zum Bleichen von Ölen, Fetten, Pelzen, Leder, Textilmaterialien, Papier; zur Reinigung von Halbleitermaterialien aus Germanium und Silizium; als Desinfektionsmittel zur Neutralisierung von häuslichem und industriellem Abwasser; In Behandlung; als O 2 -Quelle in U-Booten; H 2 O 2 ist Teil des Fenton-Reagens (Fe 2 + + H 2 O 2), das als Quelle für freie OH-Radikale in der organischen Synthese verwendet wird 5 .
Ruthenium- und Osmiumtetroxide
Osmiumtetroxid OsO 4 ist ein weißes bis hellgelbes Pulver mit Schmp. 40,6 °C; t. kip. 131,2 °C. Sublimiert bereits bei Raumtemperatur, löslich in Wasser (7,47 g in 100 ml bei 25 °C), СCl 4 (250 g in 100 g Lösungsmittel bei 20 °C). In Gegenwart organischer Verbindungen verfärbt es sich durch Reduktion zu OsO 2 6 schwarz.
RuO 4 ist ein goldgelbes Prisma mit so pl. 25,4 °C, sublimiert deutlich bei Raumtemperatur. Schwer löslich in Wasser (2,03 g in 100 ml bei 20 °C), sehr gut löslich in CCl 4 . Ein stärkeres Oxidationsmittel als OsO 4 . Über 100 °C explodiert es. Wie Osmiumtetroxid weist es eine hohe Toxizität und hohe Kosten auf.
Diese Oxidationsmittel werden für die Oxidation von Alkenen zu α-Glykolen unter milden Bedingungen eingesetzt.
Dioxirane
Am häufigsten werden Dimethyldioxiran und Methyl(trifluormethyl)dioxiran verwendet.

Am häufigsten werden Dioxirane gewonnen In situ aus den entsprechenden Ketonen und KHSO 5 (oder K 2 SO 4 KHSO 4 · 2KHSO 5 (Oxon)) in leicht alkalischem Medium 7:
Dioxirane zeichnen sich durch eine hohe Reaktivität bei gleichzeitig guter Selektivität aus und werden zur Oxidation nicht aktivierter C-H-Bindungen in Alkanen, bei der Herstellung von Epoxiden aus Alkenen, zur Oxidation von Aminen, Oximen, Sulfiden, Sulfoxiden usw. eingesetzt.
Die Oxidation von Alkenen kann in mehrere Richtungen erfolgen:
1) unter Erhalt des Kohlenstoffgerüsts des Moleküls; Auf diese Weise laufen Epoxidierung und Hydroxylierung der Doppelbindung ab, was zur Bildung vicinaler trans- oder cis-Glykole führt.
2) mit einem Bruch der Doppelbindung; Auf diese Weise laufen die Ozonolyse und die erschöpfende Oxidation von Alkenen ab, was zur Bildung verschiedener Arten von Carbonylverbindungen und Carbonsäuren führt.
Je nach Art der Oxidation kommen unterschiedliche Oxidationsmittel zum Einsatz.
1. Epoxidierung(Reaktion von N.A. Prilezhaev, 1909)
Azyklische und zyklische Alkene bilden bei Wechselwirkung mit Persäuren (Persäuren) RCOOOH in einem unpolaren, indifferenten Medium Epoxide (Oxirane), daher wird die Reaktion selbst als Epoxidierungsreaktion bezeichnet.

Nach moderner Nomenklatur IUPAC- Ein Dreiring mit einem Sauerstoffatom heißt Oxiran.
Die Epoxidierung von Alkenen sollte als synchroner, koordinierter Prozess betrachtet werden, an dem keine ionischen Zwischenprodukte wie das OH+-Hydroxylkation beteiligt sind. Mit anderen Worten: Die Epoxidierung von Alkenen ist ein Prozess syn- Addition eines Sauerstoffatoms an die Doppelbindung unter vollständiger Erhaltung der Konfiguration der Substituenten an der Doppelbindung. 8

Für die Epoxidierung wurde ein Mechanismus vorgeschlagen, der für konzertierte Prozesse charakteristisch ist.

Da der Angriff der Doppelbindung durch das Sauerstoffatom der Persäure auf beiden Seiten der Ebene der Doppelbindung gleich wahrscheinlich ist, sind die resultierenden Oxirane beides Meso-Formen oder Mischungen von Enantiomeren. Als Epoxidierungsmittel werden folgende Persäuren verwendet: Perbenzoesäure, M-Chlorperbenzoesäure, Monoperphthalsäure, Peressigsäure, Trifluorperessigsäure und Perameisensäure. Aromatische Persäuren werden als einzelne Reagenzien verwendet, während aliphatische Persäuren – CH 3 CO 3 H, CF 3 CO 3 H und HCO 3 H – nicht isoliert werden individuelle Form, und werden nach ihrer Entstehung im Zusammenspiel von 30 % oder 90 % Wasserstoffperoxid und der entsprechenden Carbonsäure eingesetzt. Perbenzoesäure und M-Chlorperbenzoesäure wird durch Oxidation von Benzoesäure und erhalten M-Chlorbenzoesäure mit 70 % Wasserstoffperoxid in einer Lösung aus Methansulfonsäure oder aus Säurechloriden dieser Säuren und Wasserstoffperoxid.


Monoperphthalsäure wird auf ähnliche Weise aus Phthalsäureanhydrid und 30 % Wasserstoffperoxid gewonnen.

Derzeit findet Monoperoxyphthalsäure in Form ihres Mg-Salzes erhebliche Anwendung. Dieses Reagenz kann in Mischungen organischer Lösungsmittel mit Wasser verwendet werden 9 .
Zur Gewinnung von Oxiranen (Epoxiden) 10 wurden zunächst Perbenzoesäure oder Monoperphthalsäure verwendet:

Derzeit wird am häufigsten die Epoxidierung eingesetzt M-Chlorperbenzoesäure. Im Gegensatz zu anderen Persäuren ist es über lange Zeit (bis zu 1 Jahr) lagerstabil und absolut sicher in der Handhabung. Ausbeuten an Oxiranen, die durch Oxidation acyclischer und cyclischer Alkene erhalten werden M-Chlorperbenzoesäure in einer Lösung aus Methylenchlorid, Chloroform oder Dioxan sind normalerweise recht hoch 11 .



Persäuren werden oft direkt aus einer Reaktionsmischung aus 90 % Wasserstoffperoxid und Carbonsäure in Methylenchlorid erzeugt.

Alkene mit einer Doppelbindung, die mit einer Carbonylgruppe oder einem anderen Akzeptorsubstituenten konjugiert ist, sind inaktiv und es ist besser, für ihre Oxidation stärkere Oxidationsmittel zu verwenden, beispielsweise Trifluorperessigsäure, erhalten aus Trifluoressigsäureanhydrid und 90 % Wasserstoffperoxid in Methylenchlorid. Peroxycarbonsäuren RC(NH)OOH sind instabile Zwischenprodukte, die bei der Reaktion von Nitrilen mit alkalischen Lösungen von Wasserstoffperoxid 12 entstehen:
Das einfachste Oxiran, Ethylenoxid, wird industriell durch Oxidation von Ethylen mit Sauerstoff in Gegenwart von Silber als Katalysator hergestellt 13 .

2. Hydroxylierung
Es sind eine Reihe von Oxidationsreagenzien bekannt, mit deren Hilfe unter milden Bedingungen die Anlagerung von zwei Hydroxylgruppen an Alkene möglich ist.
Die Reaktion der Hydroxylierung von Alkenen, die unter Einwirkung einer kalten Lösung von Kaliumpermanganat abläuft und von deren Verfärbung begleitet wird, ist als Wagner-Reaktion (1888) bekannt. Derzeit hat es kaum synthetischen Nutzen, da es mit der Bildung einer erheblichen Anzahl von Nebenprodukten einhergeht. Diese Reaktion kann jedoch bei der Untersuchung der Struktur einer organischen Verbindung als qualitativer Test für eine Doppelbindung verwendet werden. Die Hydroxylierung von Cyclohexen durch Einwirkung einer wässrigen Kaliumpermanganatlösung in der Kälte wurde erstmals von V.V. durchgeführt. Markownikow. Derzeit wird Osmium(VIII)-oxid am häufigsten für die Hydroxylierung von Alkenen verwendet (Kriege-Reaktion, 1936) 14 .
Osmiumtetroxid OsO 4 ist eine farblose kristalline Substanz, die bei 40 °C schmilzt und in Ether leicht löslich ist. Bei der Oxidation von Cyclohexen mit einer Etherlösung dieses Reagens entsteht ein schwarzer Niederschlag, bei dem es sich um einen zyklischen Ester der Osmiumsäure I 15 handelt:
Der Ether entsteht durch die gleichzeitige Öffnung der Kohlenstoff-Kohlenstoff-Doppelbindung des Alkens und der beiden Doppelbindungen des Metalloxids. Dieser Ester wird dann unter Verwendung von Natriumsulfit als Katalysator hydrolysiert. Das Hydrolyseprodukt ist cis-Cyclohexandiol-1,2(II), bei dem sich die Hydroxylgruppen im β-Bereich befinden, also vorne und Wasserstoffe im α-Bereich, d.h. hinter.
2.1 Anti-Hydroxylierung
Der dreigliedrige Ring von Oxiranen lässt sich unter Einwirkung verschiedenster nukleophiler Reagenzien leicht öffnen. Die Hydrolyse von Oxiranen wird sowohl durch Säuren als auch durch Basen katalysiert. In beiden Fällen entstehen vicinale Diole, also Glykole. Bei der Säurekatalyse erfolgt in der ersten Stufe die Protonierung des Sauerstoffatoms von Oxiran unter Bildung eines zyklischen Oxoniumkations, das sich durch den nukleophilen Angriff eines Wassermoleküls 16 öffnet:

Der Schlüsselschritt bei der Ringöffnung, der die Geschwindigkeit des gesamten Prozesses bestimmt, ist der nukleophile Angriff von Wasser auf die protonierte Form von Oxiran. Aus mechanistischer Sicht ähnelt dieser Vorgang der Öffnung des Bromoniumions während des nukleophilen Angriffs des Bromidions oder eines anderen nukleophilen Mittels. Aus diesen Positionen sollte das stereochemische Ergebnis die Bildung sein Trance-Glykole bei der Spaltung cyclischer Epoxide. Und zwar ausschließlich bei der säurekatalysierten Hydrolyse von Cyclohexenoxid oder Cyclopentenoxid Trance-1,2-Diole.
Somit entspricht der zweistufige Prozess der Alkenepoxidierung gefolgt von der sauren Hydrolyse des Epoxids insgesamt der Reaktion Anti-Hydroxylierung von Alkenen.
Beide Etappen Anti-Hydroxylierung von Alkenen kann kombiniert werden, wenn das Alken mit wässrigem 30–70 %igem Wasserstoffperoxid in Ameisensäure oder Trifluoressigsäure behandelt wird. Beide Säuren sind stark genug, um den Oxiranring zu öffnen.

Die durch die Base katalysierte Öffnung des Oxiranrings führt ebenfalls zur Bildung zyklischer Trance-Glykole.
Daher ist auch der zweistufige Prozess der Epoxidierung von Alkenen und der anschließenden alkalischen Hydrolyse von Epoxiden eine Reaktion Anti-Hydroxylierung von Alkenen.
2.2 syn-Hydroxylierung
Einige Salze und Oxide von Übergangsmetallen in höheren Oxidationsstufen sind wirksame Reagenzien. syn-Hydroxylierung der Doppelbindung eines Alkens, wenn beide Hydroxylgruppen an derselben Seite der Doppelbindung gebunden sind. Die Oxidation von Alkenen mit Kaliumpermanganat ist eine der ältesten Methoden syn-Doppelbindungshydroxylierung - wird trotz seiner inhärenten Einschränkungen weiterhin häufig verwendet. cis-1,2-Cyclohexandiol wurde erstmals von V.V. erhalten. Markovnikov im Jahr 1878 durch Hydroxylierung von Cyclohexen mit einer wässrigen Lösung von Kaliumpermanganat bei 0 0 C.

Diese Methode wurde in den Arbeiten des russischen Wissenschaftlers E.E. weiterentwickelt. Wagner also syn-Hydroxylierung von Alkenen unter Einwirkung einer wässrigen Lösung von Kaliumpermanganat wird Wagner-Reaktion genannt. Kaliumpermanganat ist ein starkes Oxidationsmittel, das nicht nur die Doppelbindung hydroxylieren, sondern auch das entstehende vicinale Diol spalten kann. Um einen weiteren Abbau der Glykole möglichst zu vermeiden, müssen die Reaktionsbedingungen sorgfältig kontrolliert werden. Die Glykolausbeuten sind normalerweise niedrig (30–60 %). Beste Ergebnisse werden durch Hydroxylierung von Alkenen in einem leicht alkalischen Medium (ðН~8 9) bei 0-5 0 С mit einer verdünnten 1%igen wässrigen Lösung von KMnO 4 17 erreicht.


Bei der Oxidation von Alkenen mit Kaliumpermanganat entsteht zunächst ein cyclischer Permangansäureester, der sofort zu einem vicinalen Diol hydrolysiert wird.

Der cyclische Ester der Permangansäure wurde nicht als Zwischenprodukt isoliert, seine Bildung geht jedoch aus Experimenten mit markiertem 18 O-Kaliumpermanganat hervor: Bei der Oxidation des Alkens KMn 18 O 4 stellte sich heraus, dass beide Sauerstoffatome im Glykol markiert waren. Dies bedeutet, dass beide Sauerstoffatome vom Oxidationsmittel und nicht vom Lösungsmittel Wasser übertragen werden, was gut mit dem vorgeschlagenen Mechanismus übereinstimmt.
Eine andere Methode syn-Hydroxylierung von Alkenen unter Einwirkung von Osmium(VIII)-oxid OsO 4 wurde 1936 von R. Krige vorgeschlagen. Osmiumtetroxid ist eine farblose, flüchtige, kristalline Substanz, die in Ether, Dioxan, Pyridin und anderen organischen Lösungsmitteln leicht löslich ist. Wenn Osmiumtetroxid mit Alkenen in Ether oder Dioxan reagiert, entsteht ein schwarzer Niederschlag des zyklischen Esters der Osmiumsäure – Osmat, der einzeln leicht isoliert werden kann. Die Addition von OsO 4 an die Doppelbindung wird in Pyridinlösung deutlich beschleunigt. Die Zersetzung von Osmaten zu vicinalen Glykolen wird durch die Einwirkung einer wässrigen Lösung von Natriumhydrosulfit oder Schwefelwasserstoff erreicht.

Produktausgänge syn-Hydroxylierung von Alkenen ist bei dieser Methode viel höher als bei Verwendung von Permanganat als Oxidationsmittel. Ein wichtiger Vorteil der Krige-Methode ist das Fehlen von Produkten der oxidativen Spaltung von Alkenen, was charakteristisch für die Permanganatoxidation ist 18 .
 19
19

Osmiumtetroxid ist ein sehr teures und schwer zu bekommendes Reagenz, außerdem ist es giftig. Daher wird Osmium(VIII)-oxid bei der Synthese kleiner Mengen schwer zugänglicher Substanzen eingesetzt, um die höchste Diolausbeute zu erzielen. Zur Vereinfachung syn-Hydroxylierung von Alkenen unter Einwirkung von OsO 4 wurde eine Technik entwickelt, die es ermöglicht, nur katalytische Mengen dieses Reagens zu verwenden. Die Hydroxylierung von Alkenen erfolgt mit Wasserstoffperoxid in Gegenwart von OsO 4, zum Beispiel:

Zusammenfassend können wir die stereochemische Beziehung zwischen dem Alken angeben cis- oder Trance-Konfiguration und Konfiguration des resultierenden vicinalen Diols, das sein kann cis- oder Trance-Isomer, erythro- oder Treo-form, Meso- oder D,L-Form abhängig von den Substituenten im Alken 20:

Ähnliche stereochemische Beziehungen werden bei anderen Reaktionen beobachtet syn- oder Anti- Mehrfachbindungsadditionen von Wasserstoff, Halogenwasserstoffen, Wasser, Halogenen, Borhydriden und anderen Reagenzien.
3. Oxidative Spaltung Alkene
Bei der Oxidation von Alkenen mit einer alkalischen wässrigen Lösung von Kaliumpermanganat beim Erhitzen oder mit einer Lösung von KMnO 4 in wässriger Schwefelsäure sowie bei der Oxidation von Alkenen mit einer Lösung von Chrom(VI)-oxid CrO 3 in Essigsäure oder Kaliumdichromat und Schwefelsäure wird das zunächst gebildete Glykol oxidativ abgebaut. Das Endergebnis ist die Spaltung des Kohlenstoffgerüsts an der Stelle der Doppelbindung und die Bildung von Ketonen und/oder Carbonsäuren als Endprodukte, abhängig von den Substituenten an der Doppelbindung. Wenn beide Kohlenstoffatome an der Doppelbindung nur eine Alkylgruppe enthalten, ist das Endprodukt der erschöpfenden Oxidation ein Gemisch aus Carbonsäuren, das tetrasubstituierte Alken an der Doppelbindung wird zu zwei Ketonen oxidiert. Monosubstituierte Alkene mit endständiger Doppelbindung werden zu Carbonsäure und Kohlendioxid gespalten 21 .

 22
22
Aufgrund der geringen Ausbeuten an Carbonsäuren und Ketonen haben die Reaktionen der erschöpfenden Oxidation von Alkenen in der klassischen Version keine breite Anwendung gefunden und wurden bisher hauptsächlich zur Bestimmung der Struktur des ursprünglichen Alkens aus den Produkten der destruktiven Oxidation verwendet. Derzeit wird die Oxidation von Alkenen (R-CH=CH-R und R-CH=CH 2) zu Carbonsäuren (RCOOH) mit Kaliumpermanganat oder -dichromat unter Bedingungen der Phasentransferkatalyse durchgeführt. Die Ausbeuten an Carbonsäuren liegen in diesem Fall bei über 90 %.

4. Ozonolyse von Alkenen
Die Reaktion von Alkenen mit Ozon ist die wichtigste Methode zur oxidativen Spaltung von Alkenen an der Doppelbindung. Diese Reaktion diente viele Jahrzehnte als Hauptmethode zur Bestimmung der Struktur des Ausgangskohlenwasserstoffs und fand auch Anwendung bei der Synthese verschiedener Carbonylverbindungen. Die Reaktion von Alken mit Ozon erfolgt durch Einleiten eines Stroms aus einem etwa 5 %igen Gemisch aus Ozon und Sauerstoff in eine Lösung von Alken in Methylenchlorid oder Ethylacetat bei -80 °C bis 100 °C. Das Ende der Reaktion wird durch gesteuert ein Test auf freies Ozon mit Kaliumjodid. Der Mechanismus dieser besonderen und komplexen Reaktion wurde hauptsächlich dank der Arbeit von Krige aufgeklärt. Das erste Produkt der 1,3-dipolaren Cycloaddition an die Doppelbindung ist das sogenannte Molozonid (1,2,3-Trioxolan). Dieses Produkt ist instabil und zersetzt sich spontan unter Ringöffnung und Bildung von normalem Ozonid (1,2,4-Trioxolan) 23 als Endprodukt.
 24
24
Es ist mittlerweile allgemein anerkannt, dass die Umwandlung von Molozonid in gewöhnliches Ozonid durch den Spaltungs-Rekombinations-Mechanismus erfolgt. Mollozonid durchläuft eine spontane Öffnung des instabilen 1,2,3-Trioxolanrings unter Bildung einer Carbonylverbindung und eines bipolaren Ions, die dann ebenfalls nach dem 1,3-dipolaren Cycloadditionsschema miteinander reagieren.

Das gegebene Schema der Umlagerung von Molozonid in normales Ozonid wird dadurch bestätigt, dass, wenn vor der vollständigen Bildung des Ozonids eine andere Carbonylverbindung als „Abfangjäger“ des bipolaren Ions im Reaktionsgemisch vorhanden ist, die sogenannte „ Es entsteht „Mischozonid“. Zum Beispiel bei der Ozonisierung cis-Stilben in Gegenwart von Benzaldehyd, markiert mit dem 18 O-Isotop, die Markierung ist Teil des Ethers und nicht die Peroxidbrücke des Ozonids:
Dieses Ergebnis stimmt gut mit der Bildung eines gemischten Ozonids bei der Rekombination eines bipolaren Ions mit markiertem Benzaldehyd überein:

Ozonide sind äußerst instabile Verbindungen, die explosionsartig zerfallen. Sie werden nicht einzeln isoliert, sondern unter der Einwirkung verschiedenster Regenten gespalten. Es ist zwischen reduktiver und oxidativer Spaltung zu unterscheiden. Bei der Hydrolyse werden Ozonide langsam in Carbonylverbindungen und Wasserstoffperoxid gespalten. Wasserstoffperoxid oxidiert Aldehyde zu Carbonsäuren. Dabei handelt es sich um den sogenannten oxidativen Abbau von Ozoniden:

So kommt es beim oxidativen Abbau von Ozoniden zu Carbonsäuren und (oder) Ketone, abhängig von der Struktur des Ausgangsalkens. Als Oxidationsmittel können Luftsauerstoff, Wasserstoffperoxid, Persäuren oder Silberhydroxid verwendet werden. In der Synthesepraxis wird zu diesem Zweck am häufigsten Wasserstoffperoxid in Essig- oder Ameisensäure sowie Wasserstoffperoxid in alkalischem Medium verwendet.


In der Praxis wird zur Gewinnung von Carbonsäuren hauptsächlich die Methode der oxidativen Zersetzung von Ozoniden eingesetzt.
Wichtiger ist die reduktive Spaltung von Ozoniden. Die am häufigsten verwendeten Reduktionsmittel sind Zink und Essigsäure, Triphenylphosphin oder Dimethylsulfid. In diesem Fall sind die Endprodukte der Ozonolyse je nach Struktur des Ausgangsalkens Aldehyde oder Ketone.


 25
25
Aus den obigen Beispielen ist ersichtlich, dass ein tetrasubstituiertes Alken an einer Doppelbindung bei der Ozonolyse und anschließender reduktiver Zersetzung des Ozonids zwei Ketone bildet, während ein trisubstituiertes Alken ein Keton und einen Aldehyd ergibt. Ein disubstituiertes symmetrisches Alken bildet bei der Ozonolyse zwei Aldehyde, und Alkene mit einer endständigen Bindung bilden einen Aldehyd und Formaldehyd.
Eine interessante Modifikation der Ozonolyse ist die Methode, bei der Natriumborhydrid als Ozonid-Reduktionsmittel verwendet wird. In diesem Fall sind die Endreaktionsprodukte primäre oder sekundäre Alkohole, die bei der Reduktion von Aldehyden bzw. Xtonen entstehen 26 .


Die Ozonolyse von Alkenen ist ein komplexer, zeitaufwändiger und explosiver Prozess, der den Einsatz spezieller Geräte erfordert. Aus diesem Grund wurden andere Methoden zur oxidativen Spaltung von Alkenen zu Carbonylverbindungen und Carbonsäuren entwickelt, die die Ozonolysereaktion in der Synthesepraxis erfolgreich ersetzen.
Eine der modernen präparativen Methoden zur oxidativen Zerstörung von Alkenen wurde 1955 von R. Lemieux vorgeschlagen. Diese Methode basiert auf der Hydroxylierung von Alkenen mit Kaliumpermanganat, gefolgt von der Spaltung von vicinalem Glykol mit Natriumperiodat NaIO 4 bei pH ~ 7 8. Periodat selbst interagiert nicht mit Alken. Die Produkte dieser zweistufigen oxidativen Spaltung sind Ketone bzw. Carbonsäuren, da unter diesen Bedingungen auch Aldehyde zu Carbonsäuren oxidiert werden. Bei der Lemieux-Methode entfällt das aufwändige Problem der Abtrennung eines der Reaktionsprodukte, Mangandioxid, da sowohl Dioxid als auch Manganat erneut mit Periodat zu einem Permanganation oxidiert werden. Dadurch können nur katalytische Mengen Kaliumpermanganat verwendet werden. Nachfolgend finden Sie einige typische Beispiele für die oxidative Spaltung von Alkenen nach der Lemieux-Methode.

Citronellol, ein Alkohol, der Bestandteil von Rosenöl, Geranien- und Zitronenöl ist, wird mit einer Mischung aus Kaliumpermanganat und Natriumperiodat in wässrigem Aceton bei 5 10 0 C in quantitativer Ausbeute zu 6-Hydroxy-4-methylhexancarbonsäure oxidiert.

Eine andere Variante dieser Methode verwendet katalytische Mengen Osmiumtetroxid anstelle von Kaliumpermanganat (Lemieux & Johnson 1956). Ein besonderer Vorteil der Kombination von OsO 4 und NaIO 4 besteht darin, dass die Oxidation bereits auf der Aldehydstufe gestoppt werden kann. Osmiumtetroxid addiert sich an die Doppelbindung des Alkens und bildet Osmat, das durch Natriumperiodat unter Regenerierung von Osmiumtetroxid zu Carbonylverbindungen oxidiert wird.

Anstelle von Osmiumtetroxid kann auch Rutheniumtetroxid RuO 4 verwendet werden. Der oxidative Abbau von Alkenen nach Lemieux-Johnson führt zu den gleichen Produkten wie die Ozonolyse mit reduktiver Spaltung von Ozoniden.

In Bezug auf die moderne organische Chemie bedeutet dies, dass die Kombination von OsO 4 -NaIO 4 ist synthetisches Äquivalent Ozonolyse von Alkenen mit anschließender reduktiver Spaltung. Ebenso ist die Oxidation von Alkenen mit einer Mischung aus Permanganat und Periodat das synthetische Äquivalent der Ozonolyse mit oxidativem Abbau von Ozoniden.
Somit ist die Oxidation von Alkenen nicht nur eine Reihe präparativer Methoden zur Gewinnung von Alkoholen, Epoxiden, Diolen, Aldehyden, Ketonen und Carbonsäuren, sondern auch eine der möglichen Möglichkeiten, die Struktur des Ausgangsalkens festzulegen. So kann man anhand des Ergebnisses des oxidativen Abbaus des Alkens die Position der Doppelbindung im Molekül und gleichzeitig das stereochemische Ergebnis bestimmen syn- oder Anti- Die Hydroxylierung eines Alkens ermöglicht Rückschlüsse auf seine Geometrie.
5. Oxidation von Alkenen in Gegenwart von Palladiumsalzen
Die Oxidation von Alkenen zu Carbonylverbindungen unter Verwendung von Palladiumchlorid war Gegenstand umfangreicher Forschungsarbeiten, vor allem aufgrund der Bedeutung der Reaktion zur Herstellung von Acetaldehyd aus Ethylen (Wacker-Verfahren) für die Industrie. Während der Oxidation wird Palladiumchlorid zu Palladium reduziert, und ein solches Verfahren wäre von begrenztem Interesse, wenn nicht teures Palladiumchlorid in katalytischen Mengen in Gegenwart eines zweiten Oxidationsmittels, am häufigsten Kupfer(II)-chlorid, verwendet werden könnte , das Palladium zu Palladium oxidiert. (II) und dabei selbst zu Kupfer(I) reduziert wird. Die Reoxidation von Kupfer(I) zu Kupfer(II) kann mit Luftsauerstoff durchgeführt werden, so dass der Gesamtprozess als sehr attraktiv ist industrielle Oxidationsmethode 27 .
Ethylen wird leicht zu Acetaldehyd 28 oxidiert:
Vorgeschlagener Mechanismus 29:
Die Reaktion findet in einem sauren Medium statt, geht nicht mit einer Änderung der Anzahl der Kohlenstoffatome in einem Ethylenmolekül einher und ist derzeit die Hauptquelle für Acetaldehyd in der Industrie.
Die Oxidation von Ethylenhomologen erfolgt unter den gleichen Bedingungen am am wenigsten hydrierten Kohlenstoffatom der Doppelbindung unter Bildung von Ketonen. Insbesondere wird bei der Oxidation von Propen Aceton und bei der Oxidation von Cyclohexen Cyclohexanon erhalten.
Abschluss
Die Oxidationsreaktion ist eine wichtige Gruppe von Doppelbindungsreaktionen. Generell nehmen Oxidationsreaktionen in der organischen Chemie eine Sonderstellung ein. Bei der Betrachtung dieser Reaktionen muss nicht nur die Art der zu oxidierenden organischen Verbindung berücksichtigt werden, sondern auch die Art des Oxidationsmittels, die Anwesenheit oder Abwesenheit eines Katalysators, das Medium, in dem die Reaktion abläuft usw.
Daher ist es oft notwendig, sich Oxidationsmittel und die Bedingungen für ihre Verwendung zu merken, um das gewünschte Oxidationsprodukt zu erhalten. Beispielsweise führt die Oxidationsreaktion von Alkenen mit einer verdünnten Lösung von Kaliumpermanganat zur Bildung von Diolen (Glykolen), während eine konzentrierte Lösung von Kaliumpermanganat das Alkenmolekül an der Doppelbindung unter Bildung sauerstoffhaltiger Produkte zerstört. Somit führt das gleiche Oxidationsmittel in unterschiedlichen Umgebungen zu unterschiedlichen Oxidationsprodukten.
Unter den Oxidationsreaktionen gilt die von uns betrachtete Ozonierungsreaktion als die wichtigste, die es ermöglicht, aus den Endprodukten die Struktur des Ausgangsalkens zu ermitteln. In dieser Arbeit wurden die Hauptreaktionen der Alkenoxidation und die Katalysatoren betrachtet, die im Verlauf oxidativer Prozesse verwendet werden.
Liste der verwendeten Quellen:
1) Reutov O. A. Organische Chemie. In 4 Teilen. Kap. 1.-M.: BINOM. Wissenslabor, 2004.-567p.
2) Remy G. Kurs der anorganischen Chemie. T. 1. M.: Verlag für ausländische Literatur, 1963. - 920 S.
3) D. V. Kazakov, A. I. Voloshin, V. P. Kazakov, V. V. Shereschovets, N. N. Kabalnova. Chemie und Chemilumineszenz von Dioxiranen. Moskau: Nauka, 1999
4) Traven V.F . Organische Chemie: Lehrbuch für Gymnasien: In 2 Bänden / VF Traven. - M.: ICC "Akademkniga", 2004. - T. 1
5) Haynes A. Methoden der Oxidation organischer Verbindungen. Alkane, Alkene, Alkine und Arene. M.: Mir, 1988.
6) Morrison R., Boyd R. „Organic Chemistry“ M.: Mir, 1974
7) Shabarov Yu.S. „Organische Chemie“ Teil 1 M.: Chemie 1994
8) Petrov A.A., Balyan H.V., Troshchenko A.T. Organische Chemie: Ein Lehrbuch für Universitäten. – 5. Auflage, überarbeitet. Und zusätzlich - St. Petersburg: „Ivan Fedorov“, 2002.-624 S.
9) L. Feder, M. Fizer Organic Chemistry. Advanced Course. Band 1-M., „Chemistry“, 1969, 688 S.
10) Plotnikov V.F., St. Petersburg Yu.L. Alkene. Tutorial.-SPb: SPbGTI(TU)-2003.-20 p.
11) Neiland O. Ya. Kapitel II. Alkene // Organische Chemie: Proc. für Chem. Universitäten. - M.: „Higher School“, 1990.
12) März D. Organische Chemie: In 4 Bänden / Pro. aus dem Englischen. - M.: Mir, 1987. - T. 4. 470 S.
13) Terney A. Moderne organische Chemie: In 2 Bänden – M.: Mir, 1981.
14) Hauptman Z., Grefe Yu., Remane H. „Organic Chemistry“ M.: Khimiya, 1979
15) Dryuk V.G., Malinovsky M.S. „Kurs der organischen Chemie“ Kiew: Vishcha-Schule 1987
16) http://www.chemistry.ssu.samara.ru/chem2/u442.htm
17) http://www.xumuk.ru/
1 Petrov A.A., Balyan H.V., Troshchenko A.T. Organische Chemie: Lehrbuch für Universitäten, S.85
26 26 Traven Zusammenfassung >> Chemie
CH2 + 3O2 2CO2 + 2H2O b) At Oxidation Alkene verdünnte Lösung von Kaliumpermanganat entsteht ... an einer Doppelbindung. c) Wenn hart Oxidation Alkene kochende Lösung von Kaliumpermanganat in saurem ...
Theorie der allgemeinen Chemie mit Elementen der Lehrmethodik
Spickzettel >> ChemieDie Methode zur Gewinnung von Carbonylverbindungen - Oxidation Alkohole. Als Oxidationsmittel können Sie ... Ausbeute ~ 90 % 5. Oxidation Alkene. Aldehyde und Ketone sind Oxidation Kohlenwasserstoffe der Ethylenreihe ... werden nicht hydratisiert. 7. Reaktionen Oxidation. Aldehyde und Ketone...
Oxirane (Epoxide)
Zusammenfassung >> Chemie...) 3,4-Epoxy-1-buten Methoden zur Herstellung von Oxiranen Oxidation Alkene Persäuren Die am weitesten verbreitete Methode... 1,2-Epoxycyclo-m-chlorbenzoesäure Hexansäure Oxidation Alkene organische Persäuren geht mit der Zugabe von Sauerstoff einher ...
Allgemeine Informationen zu Alkoholen. Polyole
Zusammenfassung >> Chemie...) erhältlich Oxidation Alkene Kaliumpermanganat oder Tetrokisdom .... Beschreiben Sie den Reaktionsmechanismus Oxidation Polyole Oxidation Ethylenglykol verläuft unterschiedlich, ... Mechanismen: (m 21) Periodisch Oxidation Glycerin führt zur Bildung von Formaldehyd ...
Aufgrund der großen Informationsmenge, der vielen Nuancen und aller Arten von ABER und WENN kann es schwierig sein, dieses Material im Selbststudium zu beherrschen. Gründlich durchlesen!
Was genau wird besprochen?
Neben der vollständigen Oxidation (Verbrennung) zeichnen sich einige Klassen organischer Verbindungen durch teilweise Oxidationsreaktionen aus, während sie in andere Klassen umgewandelt werden.
Für jede Klasse gibt es spezifische Oxidationsmittel: CuO (für Alkohole), Cu (OH) 2 und OH (für Aldehyde) und andere.
Es gibt aber zwei klassische Oxidationsmittel, die sozusagen universell für viele Klassen sind.
Das ist Kaliumpermanganat – KMnO 4. Und Kaliumdichromat (Dichromat) - K 2 Cr 2 O 7. Bei diesen Stoffen handelt es sich um starke Oxidationsmittel, da Mangan in der Oxidationsstufe +7 bzw. Chrom in der Oxidationsstufe +6 vorliegt.
Reaktionen mit diesen Oxidationsmitteln kommen recht häufig vor, es gibt jedoch nirgendwo einen ganzheitlichen Leitfaden zur Auswahl der Produkte solcher Reaktionen.
In der Praxis gibt es viele Faktoren, die den Reaktionsverlauf beeinflussen (Temperatur, Medium, Konzentration der Reagenzien usw.). Oft entsteht eine Produktmischung. Daher ist es nahezu unmöglich, vorherzusagen, welches Produkt entsteht.
Aber das ist nicht gut für das Einheitliche Staatsexamen: Dort kann man nicht schreiben „vielleicht entweder dies oder dies oder sonst oder eine Mischung von Produkten“. Es muss Einzelheiten geben.
Die Ersteller der Aufgaben haben eine bestimmte Logik, ein bestimmtes Prinzip, nach dem ein bestimmtes Produkt geschrieben werden sollte, angelegt. Leider haben sie es mit niemandem geteilt.
Diese Frage wird in den meisten Handbüchern eher schlüpfrig umgangen: Als Beispiel werden zwei oder drei Reaktionen angegeben.
In diesem Artikel präsentiere ich die Ergebnisse einer Studienanalyse von USE-Aufgaben. Die Logik und Prinzipien der Zusammenstellung der Oxidationsreaktionen mit Permanganat und Dichromat wurden mit ziemlich hoher Genauigkeit (gemäß den USE-Standards) entschlüsselt. Über alles in Ordnung.
Bestimmung des Oxidationsgrades.
Erstens gibt es bei Redoxreaktionen immer ein Oxidationsmittel und ein Reduktionsmittel.
Das Oxidationsmittel ist Mangan in Permanganat oder Chrom in Dichromat, das Reduktionsmittel sind organische Atome (nämlich Kohlenstoffatome).
Es reicht nicht aus, die Produkte zu definieren, die Reaktion muss egalisiert werden. Zum Ausgleich wird traditionell die Methode der elektronischen Waage verwendet. Zur Anwendung dieser Methode ist es notwendig, die Oxidationsstufen von Reduktionsmitteln und Oxidationsmitteln vor und nach der Reaktion zu bestimmen.
Bei anorganische Stoffe Den Oxidationsgrad kennen wir ab der 9. Klasse:
Aber in Bio wurden sie wahrscheinlich in der 9. Klasse nicht bestimmt. Bevor Sie lernen, OVR in der organischen Chemie zu schreiben, müssen Sie daher lernen, den Oxidationsgrad von Kohlenstoff in organischen Substanzen zu bestimmen. Dies geschieht etwas anders als in der anorganischen Chemie.
Kohlenstoff hat eine maximale Oxidationsstufe von +4, eine minimale von -4. Und es kann jeden Oxidationsgrad dieses Intervalls anzeigen: -4, -3, -2, -1, 0, +1, +2, +3, +4.
Zuerst müssen Sie sich merken, was eine Oxidationsstufe ist.
Der Oxidationszustand ist die bedingte Ladung, die an einem Atom auftritt, vorausgesetzt, dass die Elektronenpaare vollständig in Richtung des elektronegativeren Atoms verschoben werden.
Daher wird der Oxidationszustand durch die Anzahl der verschobenen Elektronenpaare bestimmt: Wenn es zu einem bestimmten Atom verschoben wird, erhält es eine überschüssige Minusladung (-), wenn es von einem Atom stammt, erhält es eine überschüssige Plusladung (+). . Im Prinzip ist dies die gesamte Theorie, die Sie kennen müssen, um den Oxidationszustand eines Kohlenstoffatoms zu bestimmen.
Um den Oxidationsgrad eines bestimmten Kohlenstoffatoms in einer Verbindung zu bestimmen, müssen wir JEDE seiner Bindungen berücksichtigen und sehen, in welche Richtung sich das Elektronenpaar verschiebt und welche überschüssige Ladung (+ oder -) dadurch am Kohlenstoffatom entsteht .
Schauen wir uns konkrete Beispiele an:
Bei Kohlenstoff drei Wasserstoffbrückenbindungen. Kohlenstoff und Wasserstoff – was ist elektronegativer? Kohlenstoff wird sich dann entlang dieser drei Bindungen das Elektronenpaar in Richtung Kohlenstoff verschieben. Kohlenstoff nimmt von jedem Wasserstoff eine negative Ladung ab: Es ergibt sich -3
Die vierte Bindung besteht mit Chlor. Kohlenstoff und Chlor – was ist elektronegativer? Chlor, was bedeutet, dass sich über dieser Bindung das Elektronenpaar in Richtung Chlor verschiebt. Kohlenstoff hat eine positive Ladung von +1.
Dann müssen Sie nur noch hinzufügen: -3 + 1 = -2. Die Oxidationsstufe dieses Kohlenstoffatoms ist -2.

Lassen Sie uns den Oxidationszustand jedes Kohlenstoffatoms bestimmen:

Kohlenstoff hat drei Bindungen zu Wasserstoff. Kohlenstoff und Wasserstoff – was ist elektronegativer? Kohlenstoff wird sich dann entlang dieser drei Bindungen das Elektronenpaar in Richtung Kohlenstoff verschieben. Kohlenstoff nimmt von jedem Wasserstoff eine negative Ladung ab: Es ergibt sich -3
Und noch eine Bindung mit einem anderen Kohlenstoff. Kohlenstoff und anderer Kohlenstoff – ihre Elektronegativität ist gleich, es kommt also zu keiner Verschiebung des Elektronenpaares (die Bindung ist nicht polar). 

Dieses Atom hat zwei Bindungen mit einem Sauerstoffatom und eine weitere Bindung mit einem anderen Sauerstoffatom (als Teil der OH-Gruppe). Elektronegativere Sauerstoffatome in drei Bindungen ziehen ein Elektronenpaar aus dem Kohlenstoff, und Kohlenstoff hat eine Ladung von +3.
Durch die vierte Bindung ist Kohlenstoff mit einem anderen Kohlenstoff verbunden, wie bereits gesagt, das Elektronenpaar verschiebt sich nicht entlang dieser Bindung.


Kohlenstoff ist über zwei Bindungen an Wasserstoffatome gebunden. Da Kohlenstoff elektronegativer ist, zieht er für jede Bindung mit Wasserstoff ein Elektronenpaar und erhält eine Ladung von -2.
Eine Kohlenstoffdoppelbindung ist an ein Sauerstoffatom gebunden. Der elektronegativere Sauerstoff zieht für jede Bindung ein Elektronenpaar an. Gemeinsam werden zwei Elektronenpaare aus Kohlenstoff gezogen. Kohlenstoff erhält eine Ladung von +2.
Zusammen ergibt es +2 -2 = 0.

Lassen Sie uns den Oxidationszustand dieses Kohlenstoffatoms bestimmen:
Eine Dreifachbindung mit einem elektronegativeren Stickstoff verleiht Kohlenstoff eine Ladung von +3; es kommt zu keiner Verschiebung des Elektronenpaares aufgrund der Bindung mit Kohlenstoff.

Oxidation mit Permanganat.
Was passiert mit Permanganat?
Die Redoxreaktion mit Permanganat kann in verschiedenen Umgebungen (neutral, alkalisch, sauer) ablaufen. Und es hängt vom Medium ab, wie genau die Reaktion abläuft und welche Produkte dabei entstehen.
Daher kann es in drei Richtungen gehen:

Permanganat wird als Oxidationsmittel reduziert. Hier sind die Produkte seiner Genesung:
- saure Umgebung.
Das Medium wird mit Schwefelsäure (H 2 SO 4) angesäuert. Mangan wird auf die Oxidationsstufe +2 reduziert. Und die Wiederherstellungsprodukte werden sein:
KMnO 4 + H 2 SO 4 → MnSO 4 + K 2 SO 4 + H 2 O
- Alkalische Umgebung.
Um eine alkalische Umgebung zu schaffen, wird ein ziemlich konzentriertes Alkali (KOH) hinzugefügt. Mangan wird auf die Oxidationsstufe +6 reduziert. Wiederherstellungsprodukte
KMnO 4 + KOH → K 2 MnO 4 + H 2 O
- Neutrale Umgebung(und leicht alkalisch).
In einem neutralen Medium nimmt neben Permanganat auch Wasser an der Reaktion teil (die wir auf der linken Seite der Gleichung schreiben), Mangan wird auf +4 (MnO 2) reduziert, die Reduktionsprodukte sind:
KMnO 4 + H 2 O → MnO 2 + KOH
Und in einer leicht alkalischen Umgebung (in Gegenwart einer KOH-Lösung geringer Konzentration):
KMnO 4 + KOH → MnO 2 + H 2 O

Was passiert mit Bio?
Das erste, was man lernen muss, ist, dass alles mit Alkohol beginnt! Dies ist die Anfangsphase der Oxidation. Der Kohlenstoff, an den die Hydroxylgruppe gebunden ist, wird oxidiert.
Bei der Oxidation „geht“ das Kohlenstoffatom eine Bindung mit Sauerstoff ein. Daher schreiben sie beim Aufschreiben des Schemas der Oxidationsreaktion [O] über den Pfeil:
primärer Alkohol oxidiert zuerst zu einem Aldehyd, dann zu einer Carbonsäure:

Oxidation sekundärer Alkohol Pausen in der zweiten Phase. Da sich der Kohlenstoff in der Mitte befindet, entsteht ein Keton und kein Aldehyd (das Kohlenstoffatom in der Ketongruppe kann physikalisch keine Bindung mehr mit der Hydroxylgruppe eingehen):

Ketone, tertiäre Alkohole Und Carbonsäuren nicht mehr oxidiert

Der Oxidationsprozess erfolgt schrittweise – solange es einen Oxidationsort gibt und alle Bedingungen dafür vorliegen, läuft die Reaktion weiter. Am Ende entsteht ein Produkt, das unter bestimmten Bedingungen nicht oxidiert: ein tertiärer Alkohol, ein Keton oder eine Säure.
Erwähnenswert sind die Stufen der Methanoloxidation. Zunächst wird es zum entsprechenden Aldehyd und dann zur entsprechenden Säure oxidiert:

Ein Merkmal dieses Produkts (Ameisensäure) ist, dass der Kohlenstoff in der Carboxylgruppe an Wasserstoff gebunden ist, und wenn man genau hinschaut, erkennt man, dass es sich hierbei um nichts anderes als eine Aldehydgruppe handelt:

Und die Aldehydgruppe wird, wie wir bereits herausgefunden haben, weiter zur Carboxylgruppe oxidiert:

Haben Sie die resultierende Substanz erkannt? Seine Bruttoformel ist H 2 CO 3 . Das Kohlensäure, das in Kohlendioxid und Wasser zerfällt:
H 2 CO 3 → H 2 O + CO 2
Daher sind Methanol, Ameisenaldehyd und Ameisensäure(aufgrund der Aldehydgruppe) werden zu Kohlendioxid oxidiert.
milde Oxidation.
Leichte Oxidation ist Oxidation ohne starkes Erhitzen in neutralem oder leicht alkalischem Medium (über der Reaktion steht 0). ° oder 20 °) .
Es ist wichtig zu bedenken, dass Alkohole unter milden Bedingungen nicht oxidieren. Wenn sie also gebildet werden, stoppt die Oxidation auf ihnen. Welche Stoffe gehen eine milde Oxidationsreaktion ein?
- Enthält eine C=C-Doppelbindung (Wagner-Reaktion).
In diesem Fall bricht die π-Bindung und „sitzt“ auf den gelösten Bindungen entlang der Hydroxylgruppe. Es stellt sich zweiwertiger Alkohol heraus:

Schreiben wir die Reaktion der milden Oxidation von Ethylen (Ethen). Lassen Sie uns die Ausgangsstoffe aufschreiben und die Produkte vorhersagen. Gleichzeitig schreiben wir H 2 O und KOH noch nicht: Sie können sowohl auf der rechten als auch auf der linken Seite der Gleichung erscheinen. Und wir bestimmen sofort die Oxidationsstufen der am OVR beteiligten Stoffe:

Machen wir eine elektronische Bilanz (wir meinen, dass es zwei oder zwei Kohlenstoffatome des Reduktionsmittels gibt, sie werden separat oxidiert):

Legen wir die Koeffizienten fest:

Zum Schluss fügen Sie die fehlenden Produkte (H 2 O und KOH) hinzu. Auf der rechten Seite ist nicht genügend Kalium vorhanden - das bedeutet, dass auf der rechten Seite Alkali vorhanden ist. Wir setzen einen Koeffizienten davor. Da links nicht genügend Wasserstoff vorhanden ist, befindet sich links Wasser. Wir setzen einen Koeffizienten davor:

Machen wir dasselbe mit Propylen (Propen):


Cycloalken wird oft verrutscht. Lass dich von ihm nicht verwirren. Dies ist ein regulärer Kohlenwasserstoff mit einer Doppelbindung:

Wo immer sich diese Doppelbindung befindet, verläuft die Oxidation auf die gleiche Weise:

- enthält eine Aldehydgruppe.
Die Aldehydgruppe ist reaktiver (reagiert leichter) als die Alkoholgruppe. Daher wird der Aldehyd oxidieren. Vor Säure:

Betrachten Sie das Beispiel von Acetaldehyd (Ethanal). Schreiben wir die Reaktanten und Produkte auf und ordnen die Oxidationsstufen. Machen wir eine Bilanz und setzen wir die Koeffizienten vor das Reduktionsmittel und das Oxidationsmittel:

In einem neutralen und leicht alkalischen Medium wird der Reaktionsverlauf etwas anders sein.
Wie wir uns erinnern, schreiben wir in einer neutralen Umgebung Wasser auf die linke Seite der Gleichung und Alkali auf die rechte Seite der Gleichung (das während der Reaktion entsteht):

In diesem Fall liegen in derselben Mischung Säure und Lauge nebeneinander vor. Es findet eine Neutralisierung statt.

Sie können nicht nebeneinander existieren und reagieren, es entsteht Salz:
Wenn wir uns außerdem die Koeffizienten in der Gleichung ansehen, werden wir verstehen, dass Säuren 3 Mol und Alkalien 2 Mol sind. 2 Mol Alkali können nur 2 Mol Säure neutralisieren (es entstehen 2 Mol Salz). Und ein Mol Säure bleibt übrig. Die endgültige Gleichung lautet also:

In einer leicht alkalischen Umgebung ist Alkali im Überschuss vorhanden – es wird vor der Reaktion hinzugefügt, sodass die gesamte Säure neutralisiert wird:

Eine ähnliche Situation ergibt sich bei der Oxidation von Methanal. Wie wir uns erinnern, wird es zu Kohlendioxid oxidiert:

Es ist zu beachten, dass Kohlenmonoxid (IV) CO 2 sauer ist. Und wird mit Alkali reagieren. Und da Kohlensäure zweibasig ist, kann sowohl ein saures Salz als auch ein mittleres Salz gebildet werden. Es kommt auf das Verhältnis zwischen Alkali und Kohlendioxid an:
Wenn das Verhältnis von Alkali zu Kohlendioxid 2:1 beträgt, dann wird es ein durchschnittliches Salz geben:
Oder Alkali kann deutlich mehr sein (mehr als das Doppelte). Wenn es mehr als das Doppelte ist, bleibt der Rest des Alkalis übrig:
3KOH + CO 2 → K 2 CO 3 + H 2 O + KOH
Dies geschieht in einer alkalischen Umgebung (wo ein Überschuss an Alkali vorhanden ist, da es der Reaktionsmischung vor der Reaktion zugesetzt wurde) oder in einer neutralen Umgebung, wenn viel Alkali gebildet wird.
Aber wenn Alkali im Verhältnis 1:1 zu Kohlendioxid steht, dann entsteht ein saures Salz:
KOH + CO 2 → KHCO 3
Wenn mehr Kohlendioxid vorhanden ist als benötigt, bleibt es im Überschuss:
KOH + 2CO 2 → KHCO 3 + CO 2
Dies geschieht in einer neutralen Umgebung, wenn wenig Alkali gebildet wird.
Wir notieren die Ausgangsstoffe, Produkte, erstellen eine Bilanz, notieren die Oxidationsstufen vor dem Oxidationsmittel, dem Reduktionsmittel und den daraus entstehenden Produkten:

In einer neutralen Umgebung bildet sich rechts ein Alkali (4KOH):

Jetzt müssen wir verstehen, was entsteht, wenn drei Mol CO 2 und vier Mol Alkali interagieren.
3CO 2 + 4KOH → 3KHCO 3 + KOH
KHCO 3 + KOH → K 2 CO 3 + H 2 O
Es stellt sich also so heraus:
3CO 2 + 4KOH → 2KHCO 3 + K 2 CO 3 + H 2 O
Daher schreiben wir auf der rechten Seite der Gleichung zwei Mol Hydrokarbonat und ein Mol Carbonat:

Und in einer leicht alkalischen Umgebung gibt es solche Probleme nicht: Aufgrund des Alkaliüberschusses bildet sich ein durchschnittliches Salz:

Dasselbe geschieht bei der Oxidation von Oxalsäurealdehyd:

Wie im vorherigen Beispiel entsteht eine zweibasige Säure, und nach der Gleichung sollten 4 Mol Alkali erhalten werden (da 4 Mol Permanganat).
Auch in einer neutralen Umgebung reicht das gesamte Alkali nicht aus, um die gesamte Säure vollständig zu neutralisieren.
Drei Mol Alkali bilden ein saures Salz, ein Mol Alkali bleibt übrig:
3HOOC–COOH + 4KOH → 3KOOC–COOH + KOH
Und dieses eine Mol Alkali geht mit einem Mol saurem Salz in Wechselwirkung:
KOOC–COOH + KOH → KOOC–COOK + H2O
Es stellt sich so heraus:
3HOOC–COOH + 4KOH → 2KOOC–COOH + KOOC–COOK + H2O
Endgültige Gleichung:

In einem schwach alkalischen Medium entsteht aufgrund eines Alkaliüberschusses ein durchschnittliches Salz:

- enthält eine DreifachbindungC≡ C.
Erinnern Sie sich, was bei der milden Oxidation von Doppelbindungsverbindungen geschah? Wenn Sie sich nicht erinnern, scrollen Sie zurück – erinnern Sie sich.
Die π-Bindung bricht auf und verbindet sich mit den Kohlenstoffatomen an der Hydroxylgruppe. Hier das gleiche Prinzip. Denken Sie daran, dass es in einer Dreifachbindung zwei Pi-Bindungen gibt. Dies geschieht zunächst an der ersten π-Bindung:
Dann auf einer anderen π-Bindung:

Eine Struktur, in der ein Kohlenstoffatom zwei Hydroxylgruppen aufweist, ist äußerst instabil. Wenn etwas in der Chemie instabil ist, neigt es dazu, von etwas abzufallen. Wasser fällt ab, so:

Dadurch entsteht eine Carbonylgruppe.
Betrachten Sie Beispiele:
Ethin (Acetylen). Betrachten Sie die Oxidationsstufen dieser Substanz:

Wasserspaltung:




Wie im vorherigen Beispiel enthält eine Reaktionsmischung Säure und Alkali. Es kommt zur Neutralisation – es entsteht Salz. Wie aus dem Koeffizienten vor dem Alkalipermanganat hervorgeht, sind es 8 Mol, das heißt, es reicht völlig aus, um die Säure zu neutralisieren. Endgültige Gleichung:

Betrachten Sie die Oxidation von Butin-2:

Wasserspaltung:

Hier entsteht keine Säure, man muss sich also nicht mit der Neutralisation herumschlagen.
Reaktionsgleichung:

Diese Unterschiede (zwischen der Oxidation von Kohlenstoff am Rand und in der Mitte der Kette) werden am Beispiel von Pentyn deutlich:

Wasserspaltung:

Es stellt sich eine Substanz mit einer interessanten Struktur heraus:

Die Aldehydgruppe oxidiert weiter:
Schreiben wir die Ausgangsstoffe, Produkte auf, bestimmen den Oxidationsgrad, erstellen eine Bilanz, tragen die Koeffizienten vor Oxidationsmittel und Reduktionsmittel ein:

Alkali sollte 2 Mol bilden (da der Koeffizient vor Permanganat 2 beträgt), daher wird die gesamte Säure neutralisiert:

Harte Oxidation.
Harte Oxidation ist die Oxidation sauer, stark alkalisch Umfeld. Und auch, in neutral (oder leicht alkalisch), aber beim Erhitzen.
In einer sauren Umgebung werden sie manchmal auch erhitzt. Damit die harte Oxidation jedoch nicht in einer sauren Umgebung abläuft, ist Erhitzen eine Voraussetzung.
Welche Stoffe unterliegen einer starken Oxidation? (Zunächst analysieren wir nur im sauren Milieu – und fügen dann die Nuancen hinzu, die bei der Oxidation im stark alkalischen und neutralen bzw. leicht alkalischen (bei Erhitzen) Milieu entstehen).
Bei harter Oxidation erreicht der Prozess sein Maximum. Solange es etwas zu oxidieren gibt, geht die Oxidation weiter.
- Alkohole. Aldehyde.
Betrachten Sie die Oxidation von Ethanol. Allmählich oxidiert es zu einer Säure:

Wir schreiben die Gleichung auf. Wir notieren die Ausgangsstoffe, OVR-Produkte, notieren die Oxidationsstufen, erstellen eine Bilanz. Ausgleichen Sie die Reaktion:

Wenn die Reaktion beim Siedepunkt des Aldehyds durchgeführt wird, verdampft dieser bei seiner Bildung aus dem Reaktionsgemisch (fliegt weg), ohne Zeit für eine weitere Oxidation zu haben. Der gleiche Effekt kann unter sehr schonenden Bedingungen (geringe Hitze) erzielt werden. In diesem Fall schreiben wir Aldehyd als Produkt:

Betrachten Sie die Oxidation von sekundärem Alkohol am Beispiel von Propanol-2. Wie bereits erwähnt, endet die Oxidation in der zweiten Stufe (Bildung einer Carbonylverbindung). Es entsteht ein Keton, das nicht oxidiert wird. Reaktionsgleichung:

Betrachten Sie die Oxidation von Aldehyden im Hinblick auf Ethanal. Es oxidiert auch zu Säure:

Reaktionsgleichung:

Methanal und Methanol werden, wie bereits erwähnt, zu Kohlendioxid oxidiert:

Metanal:

- Enthält mehrere Bindungen.
In diesem Fall bricht die Kette entlang der Mehrfachbindung. Und die Atome, die es gebildet haben, unterliegen einer Oxidation (gehen eine Bindung mit Sauerstoff ein). So viel wie möglich oxidieren.
Beim Aufbrechen einer Doppelbindung entstehen aus Fragmenten Carbonylverbindungen (im Schema unten: aus einem Fragment - Aldehyd, aus dem anderen - Keton)

![]()
Lassen Sie uns die Oxidation von Penten-2 analysieren:

Oxidation von „Abfällen“:

Es stellt sich heraus, dass zwei Säuren gebildet werden. Notieren Sie die Ausgangsstoffe und Produkte. Bestimmen wir die Oxidationsstufen der Atome, die sie verändern, erstellen wir eine Bilanz, gleichen wir die Reaktion aus: 
Bei der Erstellung der elektronischen Bilanz meinen wir, dass zwei oder zwei Kohlenstoffatome des Reduktionsmittels vorhanden sind, diese werden separat oxidiert:

Es bildet sich nicht immer Säure. Betrachten Sie zum Beispiel die Oxidation von 2-Methylbuten:

Reaktionsgleichung:

Absolut das gleiche Prinzip bei der Oxidation von Verbindungen mit Dreifachbindung (nur die Oxidation erfolgt sofort unter Bildung einer Säure, ohne Zwischenbildung eines Aldehyds):

Reaktionsgleichung:

Liegt eine Mehrfachbindung genau in der Mitte, so entstehen nicht zwei Produkte, sondern eines. Da die „Abfälle“ gleich sind und zu den gleichen Produkten oxidiert werden:

Reaktionsgleichung:

- Doppelte Koronasäure.
Es gibt eine Säure, bei der Carboxylgruppen (Kronen) miteinander verbunden sind:
Das ist Oxalsäure. Zwei Kronen nebeneinander sind schwer zu vereinbaren. Unter normalen Bedingungen ist es sicherlich stabil. Aufgrund der Tatsache, dass sie über zwei miteinander verbundene Carboxylgruppen verfügt, ist sie jedoch weniger stabil als andere Carbonsäuren.
Daher kann es unter besonders rauen Bedingungen oxidieren. Es gibt einen Bruch in der Verbindung zwischen den „zwei Kronen“:

Reaktionsgleichung:

- Benzolhomologe (und ihre Derivate).
Benzol selbst oxidiert nicht, da diese Struktur aufgrund der Aromatizität sehr stabil ist. 
Aber seine Homologen werden oxidiert. In diesem Fall bricht auch der Stromkreis ab, Hauptsache man weiß genau wo. Es gelten einige Grundsätze:
- Der Benzolring selbst wird nicht zerstört und bleibt bis zum Schluss intakt, bis die Bindung im Radikal aufgebrochen wird.
- Das direkt an den Benzolring gebundene Atom wird oxidiert. Wenn sich danach die Kohlenstoffkette im Radikal fortsetzt, entsteht danach eine Lücke.


Lassen Sie uns die Oxidation von Methylbenzol analysieren. Dort wird ein Kohlenstoffatom im Radikal oxidiert: 
Reaktionsgleichung:

Lassen Sie uns die Oxidation von Isobutylbenzol analysieren:

Reaktionsgleichung:

Lassen Sie uns die Oxidation von sec-Butylbenzol analysieren:

Reaktionsgleichung:

Bei der Oxidation von Benzolhomologen (und Derivaten von Homologen) mit mehreren Radikalen entstehen zwei-, drei- und mehrbasische aromatische Säuren. Zum Beispiel die Oxidation von 1,2-Dimethylbenzol:

Derivate von Benzolhomologen (bei denen der Benzolring Nicht-Kohlenwasserstoffreste aufweist) werden auf die gleiche Weise oxidiert. Eine weitere funktionelle Gruppe am Benzolring stört nicht:


Zwischensumme. Algorithmus „Wie man die Reaktion der harten Oxidation mit Permanganat in einer sauren Umgebung aufschreibt“:
- Notieren Sie die Ausgangsmaterialien (organische Stoffe + KMnO 4 + H 2 SO 4).
- Notieren Sie die Produkte der organischen Oxidation (Verbindungen mit Alkohol, Aldehydgruppen, Mehrfachbindungen sowie Benzolhomologe werden oxidiert).
- Notieren Sie das Permanganat-Reduktionsprodukt (MnSO 4 + K 2 SO 4 + H 2 O).
- Bestimmen Sie den Oxidationsgrad bei OVR-Teilnehmern. Erstellen Sie eine Bilanz. Geben Sie die Koeffizienten für das Oxidationsmittel und das Reduktionsmittel sowie für die daraus gebildeten Stoffe an.
- Dann empfiehlt es sich zu berechnen, wie viele Sulfatanionen sich auf der rechten Seite der Gleichung befinden, dementsprechend den Koeffizienten vor Schwefelsäure auf der linken Seite zu setzen.
- Stellen Sie am Ende den Koeffizienten vor das Wasser.
Starke Oxidation in einem stark alkalischen Medium und einem neutralen oder leicht alkalischen (bei Erhitzen) Medium.
Diese Reaktionen kommen deutlich seltener vor. Wir können sagen, dass solche Reaktionen exotisch sind. Und wie es sich für exotische Reaktionen gehört, waren diese die umstrittensten.
Auch in Afrika ist harte Oxidation schwierig, daher werden organische Stoffe auf die gleiche Weise oxidiert wie in einer sauren Umgebung.
Wir werden die Reaktionen für jede Klasse nicht separat analysieren, da das allgemeine Prinzip bereits zuvor dargelegt wurde. Wir werden nur die Nuancen analysieren.
Stark alkalische Umgebung :
In einer stark alkalischen Umgebung wird Permanganat auf die Oxidationsstufe +6 (Kaliummanganat) reduziert:
KMnO 4 + KOH → K 2 MnO 4 .
In einer stark alkalischen Umgebung liegt immer ein Überschuss an Alkali vor, daher findet eine vollständige Neutralisation statt: Bei der Bildung von Kohlendioxid entsteht ein Carbonat, bei der Bildung einer Säure entsteht ein Salz (bei Säure). mehrbasig - ein durchschnittliches Salz).
Zum Beispiel die Oxidation von Propen:

Ethylbenzoloxidation:

Beim Erhitzen leicht alkalisch oder neutral :
Auch hier ist stets die Möglichkeit einer Neutralisierung zu berücksichtigen.
Wenn die Oxidation in einer neutralen Umgebung stattfindet und eine saure Verbindung (Säure oder Kohlendioxid) entsteht, neutralisiert das entstehende Alkali diese saure Verbindung. Aber nicht immer reicht Alkali aus, um die Säure vollständig zu neutralisieren.
Wenn beispielsweise Aldehyde oxidiert werden, reicht dies nicht aus (die Oxidation verläuft auf die gleiche Weise wie unter milden Bedingungen – die Temperatur beschleunigt lediglich die Reaktion). Daher werden sowohl Salz als auch Säure gebildet (grob gesagt bleiben sie im Überschuss).
Wir haben dies besprochen, als wir über die milde Oxidation von Aldehyden gesprochen haben.
Wenn Sie also Säure in einer neutralen Umgebung haben, müssen Sie sorgfältig prüfen, ob diese ausreicht, um die gesamte Säure zu neutralisieren. Besonderes Augenmerk sollte auf die Neutralisierung mehrbasiger Säuren gelegt werden.
In einer schwach alkalischen Umgebung werden aufgrund einer ausreichenden Menge an Alkali nur mittlere Salze gebildet, da ein Überschuss an Alkali vorliegt.
In der Regel reicht Alkali bei der Oxidation in neutraler Umgebung völlig aus. Und die Reaktionsgleichung ist in einem neutralen und in einem leicht alkalischen Medium dieselbe.
Betrachten Sie zum Beispiel die Oxidation von Ethylbenzol:


Alkali reicht aus, um die entstehenden Säureverbindungen vollständig zu neutralisieren, selbst ein Überschuss bleibt zurück:

Es werden 3 Mol Alkali verbraucht – 1 bleibt übrig.
Endgültige Gleichung:

Diese Reaktion in einem neutralen und leicht alkalischen Medium verläuft auf die gleiche Weise (in einem leicht alkalischen Medium bleibt kein Alkali übrig, aber das bedeutet nicht, dass es nicht existiert, es geht einfach keine Reaktion ein).
Redoxreaktionen mit Kaliumdichromat (Bichromat).
Bichromat weist in der Prüfung keine so große Vielfalt an organischen Oxidationsreaktionen auf.
Die Oxidation mit Dichromat erfolgt üblicherweise nur im sauren Milieu. Gleichzeitig wird Chrom auf +3 wiederhergestellt. Wiederherstellungsprodukte:
Die Oxidation wird hart sein. Die Reaktion wird der Permanganatoxidation sehr ähnlich sein. Es werden die gleichen Stoffe oxidiert wie durch Permanganat in saurer Umgebung, es entstehen die gleichen Produkte.
Werfen wir einen Blick auf einige der Reaktionen.
Betrachten Sie die Oxidation von Alkohol. Wenn die Oxidation beim Siedepunkt des Aldehyds durchgeführt wird, verlässt dieser das Reaktionsgemisch ohne Oxidation:

Andernfalls kann der Alkohol direkt zu einer Säure oxidiert werden.
Der in der vorherigen Reaktion erzeugte Aldehyd kann „abgefangen“ und zu einer Säure oxidiert werden:

Oxidation von Cyclohexanol. Cyclohexanol ist ein sekundärer Alkohol, daher entsteht ein Keton:

Wenn es schwierig ist, die Oxidationsstufen von Kohlenstoffatomen mit dieser Formel zu bestimmen, können Sie auf den Entwurf schreiben:

Reaktionsgleichung:

Betrachten Sie die Oxidation von Cyclopenten.
Die Doppelbindung bricht auf (der Zyklus öffnet sich), die Atome, die sie gebildet haben, werden maximal oxidiert (in diesem Fall zur Carboxylgruppe):


Einige Merkmale der Oxidation im USE, mit denen wir nicht ganz einverstanden sind.
Die „Regeln“, Prinzipien und Reaktionen, die in diesem Abschnitt besprochen werden, halten wir für nicht ganz richtig. Sie widersprechen nicht nur dem wahren Sachverhalt (Chemie als Wissenschaft), sondern auch der inneren Logik Lehrplan und insbesondere die NUTZUNG.
Dennoch sind wir gezwungen, dieses Material in der Form bereitzustellen, die die USE erfordert.
Wir sprechen von HARTER Oxidation.
Erinnern Sie sich, wie Benzolhomologe und ihre Derivate unter harten Bedingungen oxidiert werden? Alle Radikale werden terminiert – es entstehen Carboxylgruppen. Abfälle werden bereits „selbstständig“ oxidiert:

Wenn also plötzlich eine Hydroxylgruppe oder eine Mehrfachbindung am Radikal auftaucht, müssen Sie vergessen, dass sich dort ein Benzolring befindet. Die Reaktion läuft NUR entlang dieser funktionellen Gruppe (oder Mehrfachbindung) ab.
Die funktionelle Gruppe und Mehrfachbindung ist wichtiger als der Benzolring.

Lassen Sie uns die Oxidation jeder Substanz analysieren:
Erster Stoff:

Es darf nicht darauf geachtet werden, dass ein Benzolring vorhanden ist. Aus Sicht der Prüfung handelt es sich lediglich um sekundären Alkohol. Sekundäre Alkohole werden zu Ketonen oxidiert und Ketone werden nicht weiter oxidiert:

Lassen Sie diesen Stoff mit Dichromat oxidieren:

Zweiter Stoff:

Dieser Stoff wird oxidiert, genau wie eine Verbindung mit einer Doppelbindung (wir achten nicht auf den Benzolring):

Lassen Sie es beim Erhitzen in neutralem Permanganat oxidieren:

Das entstehende Alkali reicht aus, um Kohlendioxid vollständig zu neutralisieren:
2KOH + CO 2 → K 2 CO 3 + H 2 O
Endgültige Gleichung:

Oxidation der dritten Substanz:

Lassen Sie die Oxidation mit Kaliumpermanganat in einem sauren Medium ablaufen:

Oxidation der vierten Substanz:

Lassen Sie es in einer stark alkalischen Umgebung oxidieren. Die Reaktionsgleichung lautet:

Und schließlich wird Vinylbenzol so oxidiert:

Und es oxidiert zu Benzoesäure. Es muss berücksichtigt werden, dass es nach der Logik des Einheitlichen Staatsexamens auf diese Weise oxidiert, nicht weil es ein Benzolderivat ist. Weil es eine Doppelbindung enthält.
Abschluss.
Das ist alles, was Sie über Redoxreaktionen mit Permanganat und Dichromat in organischen Stoffen wissen müssen.
Seien Sie nicht überrascht, wenn Sie einige der in diesem Artikel dargelegten Punkte zum ersten Mal hören. Wie bereits erwähnt ist dieses Thema sehr umfangreich und kontrovers. Und trotzdem wird ihm aus irgendeinem Grund kaum Beachtung geschenkt.
Wie Sie vielleicht gesehen haben, erklären zwei oder drei Reaktionen nicht alle Muster dieser Reaktionen. Hier benötigen Sie einen ganzheitlichen Ansatz und eine ausführliche Erläuterung aller Punkte. Leider wird das Thema in Lehrbüchern und auf Internetquellen nicht vollständig oder gar nicht offengelegt.
Ich habe versucht, diese Mängel und Mängel zu beseitigen und dieses Thema in seiner Gesamtheit und nicht nur teilweise zu betrachten. Ich hoffe, es ist mir gelungen.
Vielen Dank für Ihre Aufmerksamkeit, alles Gute für Sie! Erfolg in der Entwicklung chemische Wissenschaft und bestandene Prüfungen!
Wie bereits erwähnt, ist die Oxidation organischer Stoffe die Einführung von Sauerstoff in ihre Zusammensetzung und (oder) die Abspaltung von Wasserstoff. Bei der Rückgewinnung handelt es sich um den umgekehrten Prozess (Zuführung von Wasserstoff und Abspaltung von Sauerstoff). Angesichts der Zusammensetzung der Alkane (СnH2n+2) können wir den Schluss ziehen, dass sie nicht an Reduktionsreaktionen teilnehmen können, wohl aber an Oxidationsreaktionen.
Alkane sind Verbindungen mit geringem Kohlenstoffoxidationsgrad und können je nach Reaktionsbedingungen zu verschiedenen Verbindungen oxidiert werden.
Bei normalen Temperaturen reagieren Alkane nicht einmal mit starken Oxidationsmitteln (H2Cr2O7, KMnO4 usw.). Beim Einbringen in eine offene Flamme brennen Alkane. Gleichzeitig werden sie bei einem Überschuss an Sauerstoff vollständig zu CO2 oxidiert, wo Kohlenstoff vorhanden ist der höchste Grad Oxidation +4 und Wasser. Die Verbrennung von Kohlenwasserstoffen führt zum Bruch aller C-C-Verbindungen und C-H und geht mit der Freisetzung großer Wärmemengen einher (exotherme Reaktion).
Es ist allgemein anerkannt, dass der Mechanismus der Alkanoxidation einen radikalischen Kettenprozess umfasst, da Sauerstoff selbst nicht sehr reaktiv ist. Um ein Wasserstoffatom von einem Alkan zu abstrahieren, ist ein Partikel erforderlich, das die Bildung eines Alkylradikals initiiert reagieren mit Sauerstoff unter Bildung eines Peroxyradikals. Das Peroxyradikal kann dann ein Wasserstoffatom von einem anderen Alkanmolekül abstrahieren, um ein Alkylhydroperoxid und ein Radikal zu bilden.

Es ist möglich, Alkane mit Luftsauerstoff bei 100–150 °C in Gegenwart eines Katalysators – Manganacetat – zu oxidieren, diese Reaktion wird in der Industrie verwendet. Oxidation tritt auf, wenn ein Luftstrom durch geschmolzenes Paraffin geblasen wird, das ein Mangansalz enthält.
Weil Durch die Reaktion entsteht ein Säuregemisch, das dann durch Auflösen in wässrigem Alkali vom nicht umgesetzten Paraffin getrennt und anschließend mit Mineralsäure neutralisiert wird.
Direkt in der Industrie wird diese Methode zur Gewinnung von Essigsäure aus n-Butan eingesetzt:
Alkenoxidation
Alkenoxidationsreaktionen werden in zwei Gruppen unterteilt: 1) Reaktionen, bei denen das Kohlenstoffgerüst erhalten bleibt, 2) Reaktionen der oxidativen Zerstörung des Kohlenstoffgerüsts des Moleküls entlang der Doppelbindung.
Oxidationsreaktionen von Alkenen unter Erhalt des Kohlenstoffgerüsts
1. Epoxidierung (Prilezhaev-Reaktion)
Azyklische und zyklische Alkene bilden bei Wechselwirkung mit Persäuren in einem unpolaren Medium Epoxide (Oxirane).
Oxirane können auch durch Oxidation von Alkenen mit Hydroperoxiden in Gegenwart von Molybdän-, Wolfram- und Vanadium-haltigen Katalysatoren erhalten werden:

Das einfachste Oxiran, Ethylenoxid, wird industriell durch Oxidation von Ethylen mit Sauerstoff in Gegenwart von Silber oder Silberoxid als Katalysator hergestellt.

2. Antihydroxylierung (Hydrolyse von Epoxiden)
Die saure (oder alkalische) Hydrolyse von Epoxiden führt zur Öffnung des Oxidzyklus unter Bildung von Transdiolen.

Im ersten Schritt erfolgt die Protonierung des Sauerstoffatoms des Epoxids unter Bildung eines zyklischen Oxoniumkations, das sich durch den nukleophilen Angriff des Wassermoleküls öffnet.
Auch die basenkatalysierte Epoxidringöffnung führt zur Bildung von trans-Glykolen.

3. syn-Hydroxylierung
Eine der ältesten Methoden zur Oxidation von Alkenen ist die Wagner-Reaktion (Oxidation mit Kaliumpermanganat). Bei der Oxidation entsteht zunächst ein zyklischer Permanganatester, der zu einem vicinalen Diol hydrolysiert wird:

Neben der Wagner-Reaktion gibt es eine weitere Methode zur syn-Hydroxylierung von Alkenen unter Einwirkung von Osmium(VIII)-oxid, die von Krige vorgeschlagen wurde. Unter Einwirkung von Osmiumtetroxid auf ein Alken in Ether oder Dioxan entsteht ein schwarzer Niederschlag des zyklischen Esters der Osmiumsäure – Osmat. Allerdings ist die Addition von OsO4 an die Mehrfachbindung bei Pyridin deutlich beschleunigt. Der resultierende schwarze Niederschlag von Osmat lässt sich leicht durch die Einwirkung einer wässrigen Lösung von Natriumhydrosulfit zersetzen:

Kaliumpermanganat oder Osmium(VIII)oxid oxidieren das Alken zu cis-1,2-Diol.
Oxidative Spaltung von Alkenen
Die oxidative Spaltung von Alkenen umfasst Reaktionen ihrer Wechselwirkung mit Kaliumpermanganat in alkalischer oder Schwefelsäure sowie die Oxidation mit einer Lösung von Chromtrioxid in Essigsäure oder Kaliumdichromat und Schwefelsäure. Das Endergebnis solcher Umwandlungen ist die Spaltung des Kohlenstoffgerüsts an der Stelle der Doppelbindung und die Bildung von Carbonsäuren oder Ketonen.
Monosubstituierte Alkene mit endständiger Doppelbindung werden zu einer Carbonsäure und Kohlendioxid gespalten:

Wenn beide Kohlenstoffatome der Doppelbindung nur eine Alkylgruppe enthalten, entsteht ein Carbonsäuregemisch:

Wenn aber ein mit einer Doppelbindung tetrasubstituiertes Alken ein Keton ist:

Die Reaktion der Ozonolyse von Alkenen hat eine weitaus größere präparative Bedeutung erlangt. Diese Reaktion diente viele Jahrzehnte als Hauptmethode zur Bestimmung der Struktur des Ausgangsalkens. Diese Reaktion wird durchgeführt, indem ein Strom einer Ozonlösung in Sauerstoff, einer Alkenlösung in Methylenchlorid oder Ethylacetat bei -80 ... -100 ° C geleitet wird. Der Mechanismus dieser Reaktion wurde von Krige aufgeklärt:


Ozonide sind instabile Verbindungen, die sich bei einer Explosion zersetzen. Es gibt zwei Arten der Zersetzung von Ozoniden – oxidativ und reduktiv.
Bei der Hydrolyse werden Ozonide in Carbonylverbindungen und Wasserstoffperoxid gespalten. Wasserstoffperoxid oxidiert Aldehyde zu Carbonsäuren – das ist oxidative Zersetzung:

Viel wichtiger ist die reduktive Spaltung von Ozoniden. Ozonolyseprodukte sind je nach Struktur des Ausgangsalkens Aldehyde oder Ketone:
Zusätzlich zu den oben genannten Methoden gibt es eine weitere Methode, die 1955 von Lemieux vorgeschlagen wurde:
Bei der Lemieux-Methode gibt es keine aufwändigen Verfahren zur Abtrennung von Mangandioxid, da Dioxid und Manganat werden wiederum mit Periodat zum Permanganation oxidiert. Dadurch können nur katalytische Mengen Kaliumpermanganat verwendet werden.
4.5. Alkenoxidation
Es empfiehlt sich, die Reaktionen der Alkenoxidation in zwei große Gruppen zu unterteilen: Reaktionen, bei denen das Kohlenstoffgerüst erhalten bleibt, und Reaktionen der oxidativen Zerstörung des Kohlenstoffgerüsts des Moleküls entlang der Doppelbindung. Die erste Gruppe von Reaktionen umfasst die Epoxidierung sowie die Hydroxylierung, die zur Bildung vicinaler Diole (Glykole) führen. Bei zyklischen Alkenen erfolgt die Hydroxylierung vicinal Trance- oder cis-Diole. Eine weitere Gruppe umfasst Ozonolyse und Reaktionen der erschöpfenden Oxidation von Alkenen, die zur Bildung verschiedener Arten von Carbonylverbindungen und Carbonsäuren führen.
4.5.a. Oxidationsreaktionen von Alkenen unter Erhalt des Kohlenstoffgerüsts
1. Epoxidierung (Reaktion von N.A. Prilezhaev, 1909)
Azyklische und zyklische Alkene bilden bei Wechselwirkung mit Persäuren (Persäuren) RCOOOH in einem unpolaren, indifferenten Medium Epoxide (Oxirane), daher wird die Reaktion selbst als Epoxidierungsreaktion bezeichnet.
Nach moderner Nomenklatur IUPAC- Ein Dreiring mit einem Sauerstoffatom heißt Oxiran.
Die Epoxidierung von Alkenen sollte als synchroner, koordinierter Prozess betrachtet werden, an dem keine ionischen Zwischenprodukte wie das OH+-Hydroxylkation beteiligt sind. Mit anderen Worten: Die Epoxidierung von Alkenen ist ein Prozess syn- Addition eines Sauerstoffatoms an die Doppelbindung unter vollständiger Erhaltung der Konfiguration der Substituenten an der Doppelbindung.
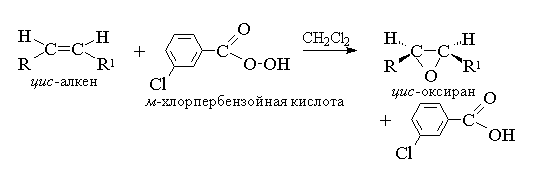

Für die Epoxidierung wurde ein Mechanismus vorgeschlagen, der für konzertierte Prozesse charakteristisch ist.

Da der Angriff der Doppelbindung durch das Sauerstoffatom der Persäure auf beiden Seiten der Ebene der Doppelbindung gleich wahrscheinlich ist, sind die resultierenden Oxirane beides Meso-Formen oder Mischungen von Enantiomeren. Als Epoxidierungsmittel werden folgende Persäuren verwendet: Perbenzoesäure, M-Chlorperbenzoesäure, Monoperphthalsäure, Peressigsäure, Trifluorperessigsäure und Perameisensäure. Aromatische Persäuren werden als Einzelreagenzien verwendet, während aliphatische Persäuren – CH 3 CO 3 H, CF 3 CO 3 H und HCO 3 H – nicht einzeln isoliert werden, sondern nach ihrer Bildung im Zusammenspiel von 30 % oder 90 % Wasserstoffperoxid und eingesetzt werden die entsprechende Carbonsäure. Perbenzoesäure und M-Chlorperbenzoesäure wird durch Oxidation von Benzoesäure und erhalten M-Chlorbenzoesäure mit 70 % Wasserstoffperoxid in einer Lösung aus Methansulfonsäure oder aus Säurechloriden dieser Säuren und Wasserstoffperoxid.


Monoperphthalsäure wird auf ähnliche Weise aus Phthalsäureanhydrid und 30 % Wasserstoffperoxid gewonnen.

Zur Gewinnung von Oxiranen (Epoxiden) wurden zunächst Perbenzoe- oder Monoperphthalsäuren verwendet:

Derzeit wird am häufigsten die Epoxidierung eingesetzt M-Chlorperbenzoesäure. Im Gegensatz zu anderen Persäuren ist es über lange Zeit (bis zu 1 Jahr) lagerstabil und absolut sicher in der Handhabung. Ausbeuten an Oxiranen, die durch Oxidation acyclischer und cyclischer Alkene erhalten werden M-Chlorperbenzoesäure in einer Lösung aus Methylenchlorid, Chloroform oder Dioxan sind normalerweise recht hoch.



Persäuren werden oft direkt aus einer Reaktionsmischung aus 90 % Wasserstoffperoxid und Carbonsäure in Methylenchlorid erzeugt.


Alkene mit einer Doppelbindung, die mit einer Carbonylgruppe oder einem anderen Akzeptorsubstituenten konjugiert ist, sind inaktiv und es ist besser, für ihre Oxidation stärkere Oxidationsmittel zu verwenden, beispielsweise Trifluorperessigsäure, erhalten aus Trifluoressigsäureanhydrid und 90 % Wasserstoffperoxid in Methylenchlorid. Das einfachste Oxiran, Ethylenoxid, wird industriell durch Oxidation von Ethylen mit Sauerstoff in Gegenwart von Silber als Katalysator hergestellt.

2. Anti-Hydroxylierung
Der dreigliedrige Ring von Oxiranen lässt sich unter Einwirkung verschiedenster nukleophiler Reagenzien leicht öffnen. Diese Reaktionen werden im Abschnitt über azyklische und zyklische Ether ausführlich besprochen. Hier wird nur die Hydrolyse von Oxiranen betrachtet. Die Hydrolyse von Oxiranen wird sowohl durch Säuren als auch durch Basen katalysiert. In beiden Fällen entstehen vicinale Diole, also Glykole. Bei der Säurekatalyse erfolgt in der ersten Stufe die Protonierung des Sauerstoffatoms von Oxiran unter Bildung eines zyklischen Oxoniumkations, das sich durch den nukleophilen Angriff eines Wassermoleküls öffnet:

Der Schlüsselschritt bei der Ringöffnung, der die Geschwindigkeit des gesamten Prozesses bestimmt, ist der nukleophile Angriff von Wasser auf die protonierte Form von Oxiran. Aus mechanistischer Sicht ähnelt dieser Vorgang der Öffnung des Bromoniumions während des nukleophilen Angriffs des Bromidions oder eines anderen nukleophilen Mittels. Aus diesen Positionen sollte das stereochemische Ergebnis die Bildung sein Trance-Glykole bei der Spaltung cyclischer Epoxide. Und zwar ausschließlich bei der säurekatalysierten Hydrolyse von Cyclohexenoxid oder Cyclopentenoxid Trance-1,2-Diole.

Somit entspricht der zweistufige Prozess der Alkenepoxidierung gefolgt von der sauren Hydrolyse des Epoxids insgesamt der Reaktion Anti-Hydroxylierung von Alkenen.
Beide Etappen Anti-Hydroxylierung von Alkenen kann kombiniert werden, wenn das Alken mit wässrigem 30–70 %igem Wasserstoffperoxid in Ameisensäure oder Trifluoressigsäure behandelt wird. Beide Säuren sind stark genug, um den Oxiranring zu öffnen.

Die durch die Base katalysierte Öffnung des Oxiranrings führt ebenfalls zur Bildung zyklischer Trance-Glykole.

Daher ist auch der zweistufige Prozess der Epoxidierung von Alkenen und der anschließenden alkalischen Hydrolyse von Epoxiden eine Reaktion Anti-Hydroxylierung von Alkenen.
3. syn-Hydroxylierung
Einige Salze und Oxide von Übergangsmetallen in höheren Oxidationsstufen sind wirksame Reagenzien. syn-Hydroxylierung der Doppelbindung eines Alkens, wenn beide Hydroxylgruppen an derselben Seite der Doppelbindung gebunden sind. Die Oxidation von Alkenen mit Kaliumpermanganat ist eine der ältesten Methoden syn-Doppelbindungshydroxylierung - wird trotz seiner inhärenten Einschränkungen weiterhin häufig verwendet. cis-1,2-Cyclohexandiol wurde erstmals von V.V. erhalten. Markovnikov im Jahr 1878 durch Hydroxylierung von Cyclohexen mit einer wässrigen Lösung von Kaliumpermanganat bei 0 0 C.

Diese Methode wurde in den Arbeiten des russischen Wissenschaftlers E.E. weiterentwickelt. Wagner also syn-Hydroxylierung von Alkenen unter Einwirkung einer wässrigen Lösung von Kaliumpermanganat wird Wagner-Reaktion genannt. Kaliumpermanganat ist ein starkes Oxidationsmittel, das nicht nur die Doppelbindung hydroxylieren, sondern auch das entstehende vicinale Diol spalten kann. Um einen weiteren Abbau der Glykole möglichst zu vermeiden, müssen die Reaktionsbedingungen sorgfältig kontrolliert werden. Die Glykolausbeuten sind normalerweise niedrig (30–60 %). Die besten Ergebnisse werden durch Hydroxylierung von Alkenen in einem leicht alkalischen Medium (pH~8,9) bei 0–5 °C mit einer verdünnten 1 %igen wässrigen Lösung von KMnO 4 erzielt.


Bei der Oxidation von Alkenen mit Kaliumpermanganat entsteht zunächst ein cyclischer Permangansäureester, der sofort zu einem vicinalen Diol hydrolysiert wird.

Der cyclische Ester der Permangansäure wurde nicht als Zwischenprodukt isoliert, seine Bildung geht jedoch aus Experimenten mit markiertem 18 O-Kaliumpermanganat hervor: Bei der Oxidation des Alkens KMn 18 O 4 stellte sich heraus, dass beide Sauerstoffatome im Glykol markiert waren. Dies bedeutet, dass beide Sauerstoffatome vom Oxidationsmittel und nicht vom Lösungsmittel Wasser übertragen werden, was gut mit dem vorgeschlagenen Mechanismus übereinstimmt.
Eine andere Methode syn-Hydroxylierung von Alkenen unter Einwirkung von Osmium(VIII)-oxid OsO 4 wurde 1936 von R. Krige vorgeschlagen. Osmiumtetroxid ist eine farblose, flüchtige, kristalline Substanz, die in Ether, Dioxan, Pyridin und anderen organischen Lösungsmitteln leicht löslich ist. Wenn Osmiumtetroxid mit Alkenen in Ether oder Dioxan reagiert, entsteht ein schwarzer Niederschlag des zyklischen Esters der Osmiumsäure – Osmat, der einzeln leicht isoliert werden kann. Die Addition von OsO 4 an die Doppelbindung wird in Pyridinlösung deutlich beschleunigt. Die Zersetzung von Osmaten zu vicinalen Glykolen wird durch die Einwirkung einer wässrigen Lösung von Natriumhydrosulfit oder Schwefelwasserstoff erreicht.

Produktausgänge syn-Hydroxylierung von Alkenen ist bei dieser Methode viel höher als bei Verwendung von Permanganat als Oxidationsmittel. Ein wichtiger Vorteil der Krige-Methode ist das Fehlen von Produkten der oxidativen Spaltung von Alkenen, die für die Permanganatoxidation charakteristisch sind.


Osmiumtetroxid ist ein sehr teures und schwer zu bekommendes Reagenz, außerdem ist es giftig. Daher wird Osmium(VIII)-oxid bei der Synthese kleiner Mengen schwer zugänglicher Substanzen eingesetzt, um die höchste Diolausbeute zu erzielen. Zur Vereinfachung syn-Hydroxylierung von Alkenen unter Einwirkung von OsO 4 wurde eine Technik entwickelt, die es ermöglicht, nur katalytische Mengen dieses Reagens zu verwenden. Die Hydroxylierung von Alkenen erfolgt mit Wasserstoffperoxid in Gegenwart von OsO 4, zum Beispiel:

Zum Abschluss dieses Abschnitts stellen wir die stereochemischen Beziehungen zwischen den Alkenen vor cis- oder Trance-Konfiguration und Konfiguration des resultierenden vicinalen Diols, das sein kann cis- oder Trance-Isomer, erythro- oder Treo-form, Meso- oder D,L-Form abhängig von den Substituenten im Alken:

Ähnliche stereochemische Beziehungen werden bei anderen Reaktionen beobachtet syn- oder Anti- Mehrfachbindungsadditionen von Wasserstoff, Halogenwasserstoffen, Wasser, Halogenen, Borhydriden und anderen Reagenzien.
Aufstellung von Gleichungen für Redoxreaktionen organischer Stoffe
IN Zusammenhang mit der Einleitung als einziger Form Abschlusszertifizierung Absolventen weiterführende Schule einheitlich Staatsexamen(USE) und Übergang weiterführende Schule Für die Fachausbildung wird die Vorbereitung von Gymnasiasten auf die Bewältigung der punktuell „teuersten“ Aufgaben des Teils „C“ immer wichtiger. USE-Test in Chemie. Obwohl die fünf Aufgaben des Teils „C“ als unterschiedlich gelten: die chemischen Eigenschaften anorganischer Substanzen, die Transformationsketten organischer Verbindungen, Rechenaufgaben, hängen sie alle in gewissem Maße mit Redoxreaktionen (ORRs) zusammen. Wenn die Grundkenntnisse der OVR-Theorie beherrscht werden, ist es möglich, die erste und zweite Aufgabe vollständig und die dritte teilweise korrekt zu lösen. Gerade darin liegt unserer Meinung nach ein wesentlicher Teil des Erfolgs bei der Umsetzung von Teil „C“. Die Erfahrung zeigt, dass, wenn Studierende im Studium der anorganischen Chemie die Aufgaben zum Schreiben von OVR-Gleichungen gut genug bewältigen, ihnen ähnliche Aufgaben in der organischen Chemie große Schwierigkeiten bereiten. Daher versuchen wir während des gesamten Studiums der organischen Chemie in Fachklassen, bei Gymnasiasten die Fähigkeiten zum Erstellen von OVR-Gleichungen zu entwickeln.
Beim Lernen Vergleichsmerkmale Von anorganischen und organischen Verbindungen führen wir Studierende in die Verwendung der Oxidationsstufe (s.o.) (in der organischen Chemie hauptsächlich Kohlenstoff) und deren Bestimmung ein:
1) Berechnung der durchschnittlichen Standardabweichung Kohlenstoff in einem Molekül organischer Substanz;
2) Definition von s.d. jedes Kohlenstoffatom.
Wir klären, in welchen Fällen es besser ist, die eine oder andere Methode anzuwenden.
Der Artikel wurde mit Unterstützung der Firma „GEO-Engineering“ veröffentlicht, die Produkte unter dem Markennamen „ProfKresla“ auf dem Markt präsentiert. Der Tätigkeitsbereich des Unternehmens ist die Herstellung, der Verkauf und die Montage von Sesseln und Stühlen für verschiedene Säle. Die hohe Professionalität unserer Mitarbeiter und unsere eigenen Produktionsanlagen ermöglichen es uns, Projekte jeder Komplexität schnell und effizient umzusetzen. Alle Produkte der Marke „ProfKresla“, egal ob Theaterstühle, Sitzgelegenheiten für Wartezimmer oder Stühle für Bildungsinstitutionen zeichnen sich durch ein modernes und ergonomisches Design sowie hohe Verschleißfestigkeit, Festigkeit und Komfort aus. Aus der riesigen Produktpalette, die im Katalog auf der Website profkresla.ru präsentiert wird, können Sie immer Modelle auswählen, die am besten zum Unternehmensstil Ihres Unternehmens passen. Sollten Sie dennoch Schwierigkeiten bei der Auswahl haben, stehen Ihnen die Spezialisten des Unternehmens jederzeit mit Rat und Tat zur Seite, helfen bei der Modellfindung und bereiten dann ein Projekt vor, führen alle notwendigen Messungen durch und installieren vor Ort.
P Beim Studium des Themas „Alkane“ zeigen wir, dass es sich bei den Prozessen Oxidation, Verbrennung, Halogenierung, Nitrierung, Dehydrierung und Zersetzung um Redoxprozesse handelt. Beim Schreiben der Gleichungen für die Verbrennungs- und Zersetzungsreaktionen organischer Substanzen ist es besser, den Durchschnittswert von s.d. zu verwenden. Kohlenstoff. Zum Beispiel:
Wir achten auf die erste Hälfte des elektronischen Gleichgewichts: am Kohlenstoffatom im Bruchwert von s.d. Der Nenner ist 4, daher berechnen wir den Elektronentransfer anhand dieses Koeffizienten.
In anderen Fällen bestimmen wir beim Studium des Themas „Alkane“ die Werte von s.d. jedes Kohlenstoffatom in der Verbindung, während die Aufmerksamkeit der Schüler auf die Reihenfolge der Substitution von Wasserstoffatomen an primären, sekundären und tertiären Kohlenstoffatomen gelenkt wird:


Damit kommen wir zu dem Schluss, dass der Substitutionsprozess zunächst an den tertiären, dann an den sekundären und zuletzt an den primären Kohlenstoffatomen stattfindet.
P Beim Studium des Themas „Alkene“ betrachten wir Oxidationsprozesse in Abhängigkeit von der Struktur des Alkens und dem Reaktionsmedium.
Wenn Alkene mit einer konzentrierten Lösung von Kaliumpermanganat KMnO 4 in einem sauren Medium oxidiert werden (harte Oxidation), brechen - und - Bindungen unter Bildung von Carbonsäuren, Ketonen und Kohlenmonoxid (IV). Diese Reaktion dient zur Bestimmung der Position der Doppelbindung.
Befindet sich die Doppelbindung am Ende des Moleküls (z. B. bei Buten-1), dann ist eines der Oxidationsprodukte Ameisensäure, die leicht zu Kohlendioxid und Wasser oxidiert wird:

Wir betonen, dass, wenn im Alkenmolekül das Kohlenstoffatom an der Doppelbindung zwei Kohlenstoffsubstituenten enthält (zum Beispiel im Molekül von 2-Methylbuten-2), bei seiner Oxidation ein Keton entsteht, da die Umwandlung eines solchen Atoms erfolgt in ein Atom der Carboxylgruppe ist unmöglich, ohne die C-C-Bindung zu brechen, relativ stabil unter diesen Bedingungen:

Wir stellen klar, dass, wenn das Alkenmolekül symmetrisch ist und die Doppelbindung in der Mitte des Moleküls enthalten ist, bei der Oxidation nur eine Säure entsteht:

Wir berichten, dass ein Merkmal der Oxidation von Alkenen, bei der die Kohlenstoffatome in der Doppelbindung zwei Kohlenstoffradikale enthalten, die Bildung von zwei Ketonen ist:


Betrachtet man die Oxidation von Alkenen in neutralen oder leicht alkalischen Medien, lenken wir die Aufmerksamkeit von Gymnasiasten auf die Tatsache, dass unter solchen Bedingungen die Oxidation mit der Bildung von Diolen (zweiwertigen Alkoholen) einhergeht und an diese Kohlenstoffatome Hydroxylgruppen gebunden werden zwischen denen es eine Doppelbindung gab:

IN In ähnlicher Weise betrachten wir die Oxidation von Acetylen und seinen Homologen, abhängig vom Medium, in dem der Prozess stattfindet. Wir stellen also klar, dass in einer sauren Umgebung der Oxidationsprozess mit der Bildung von Carbonsäuren einhergeht:

Die Reaktion wird verwendet, um die Struktur von Alkinen durch Oxidationsprodukte zu bestimmen:

In neutralen und leicht alkalischen Medien geht die Oxidation von Acetylen mit der Bildung der entsprechenden Oxalate (Salze der Oxalsäure) einher, und die Oxidation von Homologen geht mit dem Aufbrechen der Dreifachbindung und der Bildung von Salzen von Carbonsäuren einher:

IN Alle Regeln werden mit den Studierenden an konkreten Beispielen erarbeitet, was zu einer besseren Aneignung des theoretischen Stoffes führt. Daher können Studierende bei der Untersuchung der Oxidation von Arenen in verschiedenen Medien selbstständig davon ausgehen, dass in einem sauren Medium mit der Bildung von Säuren und in einem alkalischen Medium mit der Bildung von Salzen zu rechnen ist. Der Lehrer muss lediglich klären, welche Reaktionsprodukte je nach Struktur der entsprechenden Arena entstehen.
Wir zeigen anhand von Beispielen, dass Benzolhomologe mit einer Seitenkette (unabhängig von deren Länge) durch ein starkes Oxidationsmittel am -Kohlenstoffatom zu Benzoesäure oxidiert werden. Benzolhomologe werden beim Erhitzen durch Kaliumpermanganat in einem neutralen Medium oxidiert, um Kaliumsalze aromatischer Säuren zu bilden.
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 = 5C 6 H 5 COOH + 6MnSO 4 + 3K 2 SO 4 + 14H 2 O,
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 = 5C 6 H 5 COOH + 5CO 2 + 12MnSO 4 + 6K 2 SO 4 + 28H 2 O,
C 6 H 5 -CH 3 + 2KMnO 4 \u003d C 6 H 5 COOK + 2MnO 2 + KOH + H 2 O.
Wir betonen, dass, wenn in einem Arenmolekül mehrere Seitenketten vorhanden sind, in einem sauren Medium jede von ihnen an einem a-Kohlenstoffatom zu einer Carboxylgruppe oxidiert wird, was zur Bildung mehrbasiger aromatischer Säuren führt:

P Die erworbenen Fähigkeiten bei der Erstellung von OVR-Gleichungen für Kohlenwasserstoffe ermöglichen deren Verwendung bei der Untersuchung des Abschnitts „Sauerstoffhaltige Verbindungen“.
Beim Studium des Themas „Alkohole“ stellen die Studierenden die Gleichungen für die Oxidation von Alkoholen selbstständig nach folgenden Regeln auf:
1) Primäre Alkohole werden zu Aldehyden oxidiert
3CH 3 -CH 2 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 \u003d 3CH 3 -CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O;
2) Sekundäre Alkohole werden zu Ketonen oxidiert

3) Für tertiäre Alkohole ist die Oxidationsreaktion nicht typisch.
Zur Vorbereitung USE-Lehrer Es empfiehlt sich, zu diesen Eigenschaften zusätzliche Informationen anzugeben, die für Studierende zweifellos nützlich sein werden.
Bei der Oxidation von Methanol mit einer angesäuerten Lösung von Kaliumpermanganat oder Kaliumdichromat entsteht CO 2, primäre Alkohole können bei der Oxidation je nach Reaktionsbedingungen nicht nur Aldehyde, sondern auch Säuren bilden. Beispielsweise endet die Oxidation von Ethanol mit Kaliumdichromat in der Kälte mit der Bildung von Essigsäure und beim Erhitzen von Acetaldehyd:
3CH 3 -CH 2 OH + 2K 2 Cr 2 O 7 + 8H 2 SO 4 \u003d 3CH 3 -COOH + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O,
3CH 3 -CH 2 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 3CH 3 -CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O.
Erinnern wir die Schüler noch einmal an den Einfluss der Umwelt auf die Produkte von Alkoholoxidationsreaktionen, nämlich: Eine heiße neutrale Lösung von KMnO 4 oxidiert Methanol zu Kaliumcarbonat und die restlichen Alkohole zu Salzen der entsprechenden Carbonsäuren:

Beim Studium des Themas „Aldehyde und Ketone“ lenken wir die Aufmerksamkeit der Studierenden auf die Tatsache, dass Aldehyde nicht nur unter Einwirkung starker Oxidationsmittel (Luftsauerstoff, angesäuerte Lösungen von KMnO 4 usw.) leichter als Alkohole zu den entsprechenden Carbonsäuren oxidiert werden K 2 Cr 2 O 7), aber auch unter dem Einfluss von schwachem (Ammoniaklösung von Silberoxid oder Kupfer(II)-hydroxid):
5CH 3 -CHO + 2KMnO 4 + 3H 2 SO 4 = 5CH 3 -COOH + 2MnSO 4 + K 2 SO 4 + 3H 2 O,
3CH 3 -CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 \u003d 3CH 3 -COOH + Cr 2 (SO 4) 3 + K 2 SO 4 + 4H 2 O,
CH 3 -CHO + 2OH CH 3 -COONH 4 + 2Ag + 3NH 3 + H 2 O.
Besonderes Augenmerk legen wir seitdem auf die Oxidation von Methanal mit einer Ammoniaklösung von Silberoxid in diesem Fall entsteht Ammoniumcarbonat und keine Ameisensäure:
HCHO + 4OH = (NH 4) 2 CO 3 + 4Ag + 6NH 3 + 2H 2 O.
Wie unsere langjährige Erfahrung zeigt, erhöht die vorgeschlagene Methode zur Vermittlung des Schreibens von OVR-Gleichungen unter Beteiligung organischer Substanzen an Oberstufenschüler deren Abschluss Ergebnis verwenden in Chemie für ein paar Punkte.