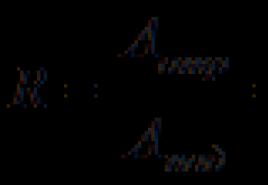กรดซัลฟิวริกเข้มข้น: คุณสมบัติ ปฏิกิริยา กรดซัลฟิวริก จุดเดือดของกรดซัลฟิวริกตามหน้าที่ของความดัน
คุณสมบัติทางกายภาพกรดซัลฟิวริกบริสุทธิ์ 100% (โมโนไฮเดรต) เป็นของเหลวไม่มีสีซึ่งแข็งตัวเป็นผลึกที่ +10 °C กรดซัลฟิวริกที่ทำปฏิกิริยามักจะมีความหนาแน่น 1.84 g/cm3 และมีประมาณ 95% H 2 SO 4 แข็งตัวได้ต่ำกว่า -20 °C เท่านั้น
จุดหลอมเหลวของโมโนไฮเดรตคือ 10.37 °C ด้วยความร้อนของการหลอมรวม 10.5 kJ/โมล ภายใต้สภาวะปกติ มันเป็นของเหลวหนืดมากที่มีค่าคงที่ไดอิเล็กตริกสูงมาก (e = 100 ที่ 25 °C) การแยกตัวด้วยไฟฟ้าที่ไม่มีนัยสำคัญของตัวเองของโมโนไฮเดรตดำเนินการแบบขนานในสองทิศทาง: [Н 3 SO 4 + ]·[НSO 4 - ] = 2 10 -4 และ [Н 3 О + ]·[НS 2 О 7 - ] = 4 10 - 5 . องค์ประกอบของโมเลกุล-ไอออนิกสามารถจำแนกได้โดยประมาณโดยข้อมูลต่อไปนี้ (เป็น%):
|
เมื่อเติมน้ำในปริมาณเล็กน้อย ความแตกแยกจะมีผลเหนือกว่าตามรูปแบบ:
H 2 O + H 2 SO 4<==>H 3 O + + HSO 4 -
คุณสมบัติทางเคมี.
H 2 SO 4 เป็นกรดไดเบสิกที่แรง
H2SO4<-->H + + HSO 4 -<-->2H + + SO 4 2-
ขั้นตอนแรก (สำหรับความเข้มข้นปานกลาง) นำไปสู่การแยกตัวออก 100%:
K 2 \u003d ( ) / \u003d 1.2 10 -2
1) ปฏิกิริยากับโลหะ:
ก) กรดซัลฟิวริกเจือจางจะละลายเฉพาะโลหะที่อยู่ในชุดของแรงดันไฟฟ้าทางด้านซ้ายของไฮโดรเจน:
Zn 0 + H 2 +1 SO 4 (razb) -> Zn +2 SO 4 + H 2 O
ข) เข้มข้น H 2 +6 SO 4 - ตัวออกซิไดซ์ที่แรง เมื่อทำปฏิกิริยากับโลหะ (ยกเว้น Au, Pt) สามารถลดได้ถึง S +4 O 2, S 0 หรือ H 2 S -2 (Fe, Al, Cr ยังไม่ทำปฏิกิริยาโดยไม่ให้ความร้อน - พวกมันไม่มีปฏิกิริยา):
2Ag 0 + 2H 2 +6 SO 4 --> Ag 2 +1 SO 4 + S +4 O 2 + 2H 2 O
8Na 0 + 5H 2 +6 SO 4 --> 4Na 2 +1 SO 4 + H 2 S -2 + 4H 2 O
2) เข้มข้น H 2 S +6 O 4 ตอบสนอง เมื่อถูกความร้อนด้วย อโลหะบางชนิด เนื่องจากคุณสมบัติการออกซิไดซ์อย่างแรง กลายเป็นสารประกอบกำมะถันที่มีสถานะออกซิเดชันต่ำกว่า (เช่น S + 4 O 2):
С 0 + 2H 2 S +6 O 4 (คอนซี) -> C +4 O 2 + 2S +4 O 2 + 2H 2 O
S 0 + 2H 2 S +6 O 4 (รวม) -> 3S +4 O 2 + 2H 2 O
2P 0 + 5H 2 S +6 O 4 (ต่อ) --> 5S +4 O 2 + 2H 3 P +5 O 4 + 2H 2 O
3) ด้วยออกไซด์พื้นฐาน:
CuO + H2SO4 --> CuSO4 + H2O
CuO + 2H + --> Cu 2+ + H 2 O
4) ด้วยไฮดรอกไซด์:
H 2 SO 4 + 2NaOH --> Na 2 SO 4 + 2H 2 O
H + + OH --> H 2 O
H 2 SO 4 + Cu(OH) 2 --> CuSO 4 + 2H 2 O
2H + + Cu(OH) 2 --> Cu 2+ + 2H 2 O
5) แลกเปลี่ยนปฏิกิริยากับเกลือ:
BaCl 2 + H 2 SO 4 --> BaSO 4 + 2HCl
Ba 2+ + SO 4 2- --> BaSO 4
การก่อตัวของตะกอนสีขาวของ BaSO 4 (ที่ไม่ละลายในกรด) ใช้เพื่อระบุกรดซัลฟิวริกและซัลเฟตที่ละลายน้ำได้
โมโนไฮเดรต (กรดซัลฟิวริกบริสุทธิ์ 100%) เป็นตัวทำละลายไอออไนซ์ที่มีลักษณะเป็นกรด ซัลเฟตของโลหะหลายชนิดละลายได้ดีในนั้น (กลายเป็นไบซัลเฟต) ในขณะที่เกลือของกรดอื่น ๆ จะละลายตามกฎก็ต่อเมื่อสามารถละลายได้ (ด้วยการเปลี่ยนเป็นไบซัลเฟต) กรดไนตริกมีลักษณะเป็นเบสอ่อนในโมโนไฮเดรต
HNO 3 + 2 H 2 SO 4<==>H 3 O + + NO 2 + + 2 HSO 4 -
คลอรีน - มากแค่ไหน กรดอ่อน
H 2 SO 4 + HClO 4 = H 3 SO 4 + + ClO 4 -
กรดฟลูออโรซัลโฟนิกและคลอโรซัลโฟนิกค่อนข้างแรงกว่า (HSO 3 F> HSO 3 Cl> HClO 4) โมโนไฮเดรตละลายสารอินทรีย์จำนวนมากที่มีอะตอมด้วยคู่อิเล็กตรอนที่ไม่แบ่งแยก (สามารถติดโปรตอนได้) บางส่วนของสิ่งเหล่านี้สามารถแยกกลับได้โดยไม่เปลี่ยนแปลงโดยเพียงแค่เจือจางสารละลายด้วยน้ำ โมโนไฮเดรตมีค่าคงที่จากการแช่แข็งสูง (6.12°) และบางครั้งก็ใช้เป็นสื่อในการกำหนดน้ำหนักโมเลกุล
เข้มข้น H 2 SO 4 เป็นสารออกซิไดซ์ที่ค่อนข้างแรง โดยเฉพาะอย่างยิ่งเมื่อถูกความร้อน (โดยปกติจะลดลงเหลือ SO 2) ตัวอย่างเช่น มันออกซิไดซ์ HI และ HBr บางส่วน (แต่ไม่ใช่ HCl) เพื่อให้เกิดฮาโลเจน นอกจากนี้ยังออกซิไดซ์โลหะหลายชนิด เช่น Cu, Hg เป็นต้น (ในขณะที่ทองคำและแพลตตินั่มมีความคงตัวเมื่อเทียบกับ H 2 SO 4) ดังนั้นปฏิกิริยากับทองแดงจึงเป็นไปตามสมการ:
Cu + 2 H 2 SO 4 \u003d CuSO 4 + SO 2 + H 2 O
ทำหน้าที่เป็นตัวออกซิไดซ์ กรดซัลฟิวริกมักจะลดลงเหลือ SO 2 . อย่างไรก็ตาม สามารถรีดิวซ์เป็น S และแม้แต่ H 2 S ได้ด้วยตัวรีดิวซ์ที่แรงที่สุด กรดซัลฟิวริกเข้มข้นทำปฏิกิริยากับไฮโดรเจนซัลไฟด์ตามสมการดังนี้
H 2 SO 4 + H 2 S \u003d 2H 2 O + SO 2 + S
ควรสังเกตว่าไฮโดรเจนในแก๊สลดลงบางส่วนด้วย ดังนั้นจึงไม่สามารถใช้เพื่อทำให้แห้งได้

ข้าว. 13. ค่าการนำไฟฟ้าของสารละลายกรดซัลฟิวริก
การละลายของกรดซัลฟิวริกเข้มข้นในน้ำจะมาพร้อมกับการปล่อยความร้อนที่สำคัญ (และปริมาตรรวมของระบบลดลงบางส่วน) โมโนไฮเดรตแทบจะไม่นำไฟฟ้า ในทางตรงกันข้าม สารละลายที่เป็นน้ำของกรดซัลฟิวริกเป็นตัวนำที่ดี ดังที่เห็นในรูป 13 กรดประมาณ 30% มีค่าการนำไฟฟ้าสูงสุด เส้นโค้งต่ำสุดสอดคล้องกับไฮเดรตที่มีองค์ประกอบ H 2 SO 4 · H 2 O
การปล่อยความร้อนจากการละลายของโมโนไฮเดรตในน้ำคือ (ขึ้นอยู่กับความเข้มข้นสุดท้ายของสารละลาย) สูงถึง 84 kJ/mol H 2 SO 4 ในทางตรงกันข้าม เมื่อผสมกรดซัลฟิวริก 66% ก่อนทำให้เย็นถึง 0 ° C กับหิมะ (1: 1 โดยน้ำหนัก) อุณหภูมิจะลดลงเหลือ -37 ° C
การเปลี่ยนแปลงความหนาแน่นของสารละลายในน้ำของ H 2 SO 4 ที่มีความเข้มข้น (wt.%) แสดงไว้ด้านล่าง:
|
|
ดังที่เห็นได้จากข้อมูลเหล่านี้ การหาความหนาแน่นของความเข้มข้นของกรดซัลฟิวริกที่สูงกว่า 90 โดยน้ำหนัก % ค่อนข้างจะคลาดเคลื่อน
แรงดันไอน้ำเหนือสารละลาย H 2 SO 4 ที่มีความเข้มข้นต่างกันที่อุณหภูมิต่างกันแสดงในรูปที่ 15. กรดซัลฟิวริกสามารถทำหน้าที่เป็นตัวทำให้แห้งได้ตราบใดที่แรงดันไอน้ำเหนือสารละลายนั้นน้อยกว่าแรงดันบางส่วนในแก๊สที่ถูกทำให้แห้ง

ข้าว. 15. แรงดันไอน้ำ

ข้าว. 16. จุดเดือดเหนือสารละลายของ H 2 SO 4 . โซลูชัน H 2 SO 4
เมื่อต้มสารละลายกรดซัลฟิวริกเจือจาง น้ำจะถูกกลั่นและจุดเดือดจะเพิ่มขึ้นเป็น 337 ° C เมื่อ 98.3% H 2 SO 4 เริ่มกลั่น (รูปที่ 16) ในทางตรงกันข้าม ซัลฟิวริกแอนไฮไดรด์ที่มากเกินไปจะระเหยจากสารละลายที่มีความเข้มข้นมากกว่า ไอน้ำของกรดซัลฟิวริกเดือดที่ 337 ° C ถูกแยกบางส่วนออกเป็น H 2 O และ SO 3 ซึ่งจะรวมตัวกันอีกครั้งเมื่อเย็นตัวลง ความร้อนกรดซัลฟิวริกที่เดือดทำให้สามารถใช้แยกกรดระเหยออกจากเกลือได้ (เช่น HCl จาก NaCl) เมื่อถูกความร้อน
ใบเสร็จ.
โมโนไฮเดรตสามารถได้มาจากการตกผลึกของกรดซัลฟิวริกเข้มข้นที่ -10 องศาเซลเซียส
การผลิตกรดซัลฟิวริก
ขั้นตอนที่ 1เตาเผาแบบหนาแน่น
4FeS 2 + 11O 2 --> 2Fe 2 O 3 + 8SO 2 + Q
กระบวนการนี้ต่างกัน:
1) บดเหล็กหนาแน่น (หนาแน่น)
2) วิธี "ฟลูอิไดซ์เบด"
3) 800 องศาเซลเซียส; ขจัดความร้อนส่วนเกิน
4) เพิ่มความเข้มข้นของออกซิเจนในอากาศ
ขั้นตอนที่ 2หลังจากทำความสะอาด เป่าแห้ง และแลกเปลี่ยนความร้อน ซัลเฟอร์ไดออกไซด์จะเข้าสู่อุปกรณ์สัมผัสซึ่งจะถูกออกซิไดซ์เป็นซัลฟิวริกแอนไฮไดรด์ (450 ° C - 500 ° C ตัวเร่งปฏิกิริยา V 2 O 5):
2SO2 + O2<-->2SO3
ขั้นตอนที่ 3หอดูดซับ:
nSO 3 + H 2 SO 4 (คอนซี) -> (H 2 SO 4 nSO 3) (โอเลี่ยม)
ไม่สามารถใช้น้ำได้เนื่องจากการก่อตัวของหมอก ใช้หัวฉีดเซรามิกและหลักการทวนกระแส
แอปพลิเคชัน.
จดจำ! ต้องเทกรดซัลฟิวริกลงในน้ำในส่วนเล็ก ๆ ไม่ใช่ในทางกลับกัน มิฉะนั้น รุนแรง ปฏิกิริยาเคมีซึ่งอาจส่งผลให้เกิดการไหม้อย่างรุนแรง

กรดกำมะถัน- หนึ่งในผลิตภัณฑ์หลักของอุตสาหกรรมเคมี ไปสู่การผลิตปุ๋ยแร่ธาตุ (ซูเปอร์ฟอสเฟต, แอมโมเนียมซัลเฟต), กรดและเกลือต่างๆ, ยาและสารซักฟอก, สีย้อม, เส้นใยเทียม, ระเบิด. มันถูกใช้ในโลหะวิทยา (การสลายตัวของแร่เช่นยูเรเนียม) สำหรับการทำให้บริสุทธิ์ของผลิตภัณฑ์ปิโตรเลียมเป็นสารดูดความชื้น ฯลฯ
สิ่งสำคัญในทางปฏิบัติคือกรดซัลฟิวริกที่แรงมาก (มากกว่า 75%) ไม่ทำปฏิกิริยากับธาตุเหล็ก ช่วยให้คุณสามารถจัดเก็บและขนส่งในถังเหล็กได้ ในทางตรงกันข้าม เจือจาง H 2 SO 4 จะละลายธาตุเหล็กได้ง่ายด้วยการปล่อยไฮโดรเจน คุณสมบัติการออกซิไดซ์นั้นไม่ธรรมดาเลย
กรดซัลฟิวริกที่แรงจะดูดซับความชื้นอย่างแรง ดังนั้นจึงมักใช้เพื่อทำให้ก๊าซแห้ง จากหลายๆ อินทรียฺวัตถุที่ประกอบด้วยไฮโดรเจนและออกซิเจนในองค์ประกอบของมัน มันเอาน้ำออกไป ซึ่งมักใช้ในเทคโนโลยี ด้วยสิ่งนี้ (เช่นเดียวกับ คุณสมบัติการออกซิไดซ์เข้มข้น H 2 SO 4) เกี่ยวข้องกับผลการทำลายล้างต่อเนื้อเยื่อพืชและสัตว์ กรดซัลฟิวริกที่บังเอิญโดนผิวหนังหรือชุดเดรสระหว่างทำงาน ควรล้างออกด้วยน้ำปริมาณมากทันที จากนั้นใช้สารละลายแอมโมเนียเจือจางในบริเวณที่ได้รับผลกระทบ จากนั้นล้างด้วยน้ำอีกครั้ง
โมเลกุลของกรดซัลฟิวริกบริสุทธิ์

รูปที่ 1 แผนภาพพันธะไฮโดรเจนในผลึก H 2 SO 4
โมเลกุลที่ก่อรูปผลึกโมโนไฮเดรต (H2O) 2 SO 2 เชื่อมต่อกันด้วยพันธะไฮโดรเจนที่ค่อนข้างแรง (25 กิโลจูล/โมล) ดังที่แสดงไว้ในรูปที่ 1. โมเลกุล (H2O) 2 SO 2 นั้นมีโครงสร้างของจัตุรมุขบิดเบี้ยวที่มีอะตอมกำมะถันอยู่ใกล้ศูนย์กลางและมีลักษณะเฉพาะด้วยพารามิเตอร์ต่อไปนี้: (d (S-OH) = 154 pm, PHO-S-OH = 104 °, d (S = O) \u003d 143 pm, ROSO \u003d 119 °ใน HOSO 3 - ion, d (S-OH) \u003d 161 และ d (SO) \u003d 145 pm และเมื่อไป SO 4 ion, 2-tetrahedron ได้รูปทรงที่ถูกต้องและพารามิเตอร์ต่างๆ อยู่ในแนวเดียวกัน
กรดกำมะถันให้ความชุ่มชื้น
สำหรับกรดซัลฟิวริกนั้น เป็นที่ทราบกันดีอยู่แล้วว่าผลึกไฮเดรตหลายชนิด ซึ่งองค์ประกอบดังกล่าวแสดงไว้ในรูปที่ 14. ในจำนวนนี้ น้ำที่ยากจนที่สุดคือเกลือออกโซเนียม: H 3 O + HSO 4 - เนื่องจากระบบที่อยู่ในการพิจารณามีแนวโน้มที่จะเกิด supercooling อุณหภูมิการเยือกแข็งที่สังเกตได้จริงจึงต่ำกว่าจุดหลอมเหลวมาก

ข้าว. 14. จุดหลอมเหลวในระบบ H 2 O·H 2 SO 4
คุณสมบัติทางกายภาพ
กรดซัลฟิวริกบริสุทธิ์ 100% (โมโนไฮเดรต) เป็นของเหลวไม่มีสีซึ่งแข็งตัวเป็นผลึกที่ +10 °C กรดซัลฟิวริกที่ทำปฏิกิริยามักจะมีความหนาแน่น 1.84 g/cm3 และมีประมาณ 95% H 2 SO 4 แข็งตัวได้ต่ำกว่า -20 °C เท่านั้น
จุดหลอมเหลวของโมโนไฮเดรตคือ 10.37 °C ด้วยความร้อนของการหลอมรวม 10.5 kJ/โมล ภายใต้สภาวะปกติ มันเป็นของเหลวหนืดมากที่มีค่าคงที่ไดอิเล็กตริกสูงมาก (e = 100 ที่ 25 °C) การแยกตัวด้วยไฟฟ้าที่ไม่มีนัยสำคัญของตัวเองของโมโนไฮเดรตดำเนินการแบบขนานในสองทิศทาง: [Н 3 SO 4 + ]·[НSO 4 - ] = 2 10 -4 และ [Н 3 О + ]·[НS 2 О 7 - ] = 4 10 - 5 . องค์ประกอบของโมเลกุล-ไอออนิกสามารถจำแนกได้โดยประมาณโดยข้อมูลต่อไปนี้ (เป็น%):
H 2 SO 4 HSO 4 - H 3 SO 4 + H 3 O + HS 2 O 7 - H 2 S 2 O 7
99,50,180,140,090,050,04
เมื่อเติมน้ำในปริมาณเล็กน้อย ความแตกแยกจะมีผลเหนือกว่าตามรูปแบบ: H 2 O + H 2 SO 4<==>H 3 O + + HSO 4 -
คุณสมบัติทางเคมี
H 2 SO 4 เป็นกรดไดเบสิกที่แรง
H2SO4<-->H + + HSO 4 -<-->2H + + SO 4 2-
ขั้นตอนแรก (สำหรับความเข้มข้นปานกลาง) นำไปสู่การแยกตัวออก 100%:
K2 = ( ) / = 1.2 10-2
1) ปฏิกิริยากับโลหะ:
ก) กรดซัลฟิวริกเจือจางจะละลายเฉพาะโลหะที่อยู่ในชุดแรงดันไฟฟ้าทางด้านซ้ายของไฮโดรเจน:
Zn 0 + H 2 +1 SO 4 (razb) -> Zn +2 SO 4 + H 2 O
b) เข้มข้น H 2 +6 SO 4 - ตัวออกซิไดซ์ที่แรง เมื่อทำปฏิกิริยากับโลหะ (ยกเว้น Au, Pt) สามารถลดได้ถึง S +4 O 2, S 0 หรือ H 2 S -2 (Fe, Al, Cr ยังไม่ทำปฏิกิริยาโดยไม่ให้ความร้อน - พวกมันไม่มีปฏิกิริยา):
- 2Ag 0 + 2H 2 +6 SO 4 --> Ag 2 +1 SO 4 + S +4 O 2 + 2H 2 O
- 8Na 0 + 5H 2 +6 SO 4 --> 4Na 2 +1 SO 4 + H 2 S -2 + 4H 2 O
- 2) เข้มข้น H 2 S +6 O 4 ทำปฏิกิริยาเมื่อถูกความร้อนกับอโลหะบางชนิดเนื่องจากคุณสมบัติการออกซิไดซ์อย่างแรง กลายเป็นสารประกอบกำมะถันที่มีสถานะออกซิเดชันต่ำกว่า (เช่น S + 4 O 2):
С 0 + 2H 2 S +6 O 4 (คอนซี) -> C +4 O 2 + 2S +4 O 2 + 2H 2 O
S 0 + 2H 2 S +6 O 4 (รวม) -> 3S +4 O 2 + 2H 2 O
- 2P 0 + 5H 2 S +6 O 4 (ต่อ) --> 5S +4 O 2 + 2H 3 P +5 O 4 + 2H 2 O
- 3) ด้วยออกไซด์พื้นฐาน:
CuO + H2SO4 --> CuSO4 + H2O
CuO + 2H + --> Cu 2+ + H 2 O
4) ด้วยไฮดรอกไซด์:
H 2 SO 4 + 2NaOH --> Na 2 SO 4 + 2H 2 O
H + + OH --> H 2 O
H 2 SO 4 + Cu(OH) 2 --> CuSO 4 + 2H 2 O
- 2H + + Cu(OH) 2 --> Cu 2+ + 2H 2 O
- 5) แลกเปลี่ยนปฏิกิริยากับเกลือ:
BaCl 2 + H 2 SO 4 --> BaSO 4 + 2HCl
Ba 2+ + SO 4 2- --> BaSO 4
การก่อตัวของตะกอนสีขาวของ BaSO 4 (ที่ไม่ละลายในกรด) ใช้เพื่อระบุกรดซัลฟิวริกและซัลเฟตที่ละลายน้ำได้
MgCO 3 + H 2 SO 4 --> MgSO 4 + H 2 O + CO 2 H 2 CO 3
โมโนไฮเดรต (กรดซัลฟิวริกบริสุทธิ์ 100%) เป็นตัวทำละลายไอออไนซ์ที่มีลักษณะเป็นกรด ซัลเฟตของโลหะหลายชนิดละลายได้ดีในนั้น (กลายเป็นไบซัลเฟต) ในขณะที่เกลือของกรดอื่น ๆ จะละลายตามกฎก็ต่อเมื่อสามารถละลายได้ (ด้วยการเปลี่ยนเป็นไบซัลเฟต) กรดไนตริกทำงานในโมโนไฮเดรตเป็นเบสอ่อน HNO 3 + 2 H 2 SO 4<==>H 3 O + + NO 2 + + 2 HSO 4 - เปอร์คลอริก - เป็นกรดอ่อนมาก Cl > HClO 4) โมโนไฮเดรตละลายสารอินทรีย์จำนวนมากที่มีอะตอมด้วยคู่อิเล็กตรอนที่ไม่แบ่งแยก (สามารถติดโปรตอนได้) บางส่วนของสิ่งเหล่านี้สามารถแยกกลับได้โดยไม่เปลี่ยนแปลงโดยเพียงแค่เจือจางสารละลายด้วยน้ำ โมโนไฮเดรตมีค่าคงที่จากการแช่แข็งสูง (6.12°) และบางครั้งก็ใช้เป็นสื่อในการกำหนดน้ำหนักโมเลกุล
เข้มข้น H 2 SO 4 เป็นสารออกซิไดซ์ที่ค่อนข้างแรง โดยเฉพาะอย่างยิ่งเมื่อถูกความร้อน (โดยปกติจะลดลงเหลือ SO 2) ตัวอย่างเช่น มันออกซิไดซ์ HI และ HBr บางส่วน (แต่ไม่ใช่ HCl) เพื่อให้เกิดฮาโลเจน นอกจากนี้ยังออกซิไดซ์โลหะหลายชนิด เช่น Cu, Hg เป็นต้น (ในขณะที่ทองคำและแพลตตินั่มมีความคงตัวเมื่อเทียบกับ H 2 SO 4) ดังนั้นปฏิกิริยากับทองแดงจึงเป็นไปตามสมการ:
Cu + 2 H 2 SO 4 \u003d CuSO 4 + SO 2 + H 2 O
ทำหน้าที่เป็นตัวออกซิไดซ์ กรดซัลฟิวริกมักจะลดลงเหลือ SO 2 . อย่างไรก็ตาม สามารถรีดิวซ์เป็น S และแม้แต่ H 2 S ได้ด้วยตัวรีดิวซ์ที่แรงที่สุด กรดซัลฟิวริกเข้มข้นทำปฏิกิริยากับไฮโดรเจนซัลไฟด์ตามสมการดังนี้
H 2 SO 4 + H 2 S \u003d 2H 2 O + SO 2 + S
ควรสังเกตว่าไฮโดรเจนในแก๊สลดลงบางส่วนด้วย ดังนั้นจึงไม่สามารถใช้เพื่อทำให้แห้งได้
ข้าว. 13.
การละลายของกรดซัลฟิวริกเข้มข้นในน้ำจะมาพร้อมกับการปล่อยความร้อนที่สำคัญ (และปริมาตรรวมของระบบลดลงบางส่วน) โมโนไฮเดรตแทบจะไม่นำไฟฟ้า ในทางตรงกันข้าม สารละลายที่เป็นน้ำของกรดซัลฟิวริกเป็นตัวนำที่ดี ดังที่เห็นในรูป 13 กรดประมาณ 30% มีค่าการนำไฟฟ้าสูงสุด เส้นโค้งต่ำสุดสอดคล้องกับไฮเดรตที่มีองค์ประกอบ H 2 SO 4 · H 2 O
การปล่อยความร้อนเมื่อละลายโมโนไฮเดรตในน้ำ (ขึ้นอยู่กับความเข้มข้นสุดท้ายของสารละลาย) สูงถึง 84 kJ/mol H 2 SO 4 ในทางตรงกันข้าม เมื่อผสมกรดซัลฟิวริก 66% ก่อนทำให้เย็นถึง 0 °C กับหิมะ (1:1 โดยน้ำหนัก) อุณหภูมิจะลดลงจนถึง -37 °C
การเปลี่ยนแปลงความหนาแน่นของสารละลายในน้ำของ H 2 SO 4 ที่มีความเข้มข้น (wt.%) แสดงไว้ด้านล่าง:
ดังที่เห็นได้จากข้อมูลเหล่านี้ การหาความหนาแน่นของความเข้มข้นของกรดซัลฟิวริกที่สูงกว่า 90 โดยน้ำหนัก % ค่อนข้างจะคลาดเคลื่อน แรงดันไอน้ำเหนือสารละลาย H 2 SO 4 ที่มีความเข้มข้นต่างกันที่อุณหภูมิต่างกันแสดงในรูปที่ 15. กรดซัลฟิวริกสามารถทำหน้าที่เป็นตัวทำให้แห้งได้ตราบใดที่แรงดันไอน้ำเหนือสารละลายนั้นน้อยกว่าแรงดันบางส่วนในแก๊สที่ถูกทำให้แห้ง

ข้าว. สิบห้า

ข้าว. 16. จุดเดือดเหนือสารละลาย H 2 SO 4 โซลูชัน H 2 SO 4
เมื่อต้มสารละลายกรดซัลฟิวริกเจือจาง น้ำจะถูกกลั่นและจุดเดือดจะเพิ่มขึ้นเป็น 337 ° C เมื่อ 98.3% H 2 SO 4 เริ่มกลั่น (รูปที่ 16) ในทางตรงกันข้าม ซัลฟิวริกแอนไฮไดรด์ที่มากเกินไปจะระเหยจากสารละลายที่มีความเข้มข้นมากกว่า ไอน้ำของกรดซัลฟิวริกเดือดที่ 337 ° C ถูกแยกบางส่วนออกเป็น H 2 O และ SO 3 ซึ่งจะรวมตัวกันอีกครั้งเมื่อเย็นตัวลง จุดเดือดสูงของกรดซัลฟิวริกช่วยให้สามารถใช้แยกกรดระเหยออกจากเกลือได้ (เช่น HCl จาก NaCl) เมื่อถูกความร้อน
ใบเสร็จ
โมโนไฮเดรตสามารถได้มาจากการตกผลึกของกรดซัลฟิวริกเข้มข้นที่ -10 องศาเซลเซียส
การผลิตกรดซัลฟิวริก
- ขั้นตอนที่ 1 เตาเผาแบบหนาแน่น
- 4FeS 2 + 11O 2 --> 2Fe 2 O 3 + 8SO 2 + Q
กระบวนการนี้ต่างกัน:
- 1) บดเหล็กหนาแน่น (หนาแน่น)
- 2) วิธี "ฟลูอิไดซ์เบด"
- 3) 800 องศาเซลเซียส; ขจัดความร้อนส่วนเกิน
- 4) เพิ่มความเข้มข้นของออกซิเจนในอากาศ
- ขั้นตอนที่ 2 หลังจากทำความสะอาด เป่าแห้ง และแลกเปลี่ยนความร้อน ซัลเฟอร์ไดออกไซด์จะเข้าสู่อุปกรณ์สัมผัสซึ่งจะถูกออกซิไดซ์เป็นซัลฟิวริกแอนไฮไดรด์ (450 ° C - 500 ° C ตัวเร่งปฏิกิริยา V 2 O 5):
- 2SO2 + O2
- ขั้นตอนที่ 3 หอดูดซับ:
nSO 3 + H 2 SO 4 (คอนซี) -> (H 2 SO 4 nSO 3) (โอเลี่ยม)
ไม่สามารถใช้น้ำได้เนื่องจากการก่อตัวของหมอก ใช้หัวฉีดเซรามิกและหลักการทวนกระแส
แอปพลิเคชัน.
จดจำ! ต้องเทกรดซัลฟิวริกลงในน้ำในส่วนเล็ก ๆ ไม่ใช่ในทางกลับกัน มิฉะนั้นอาจเกิดปฏิกิริยาเคมีรุนแรงซึ่งเป็นผลมาจากการที่บุคคลอาจได้รับการไหม้อย่างรุนแรง
กรดกำมะถันเป็นหนึ่งในผลิตภัณฑ์หลักของอุตสาหกรรมเคมี ไปที่การผลิตปุ๋ยแร่ธาตุ (ซูเปอร์ฟอสเฟต, แอมโมเนียมซัลเฟต), กรดและเกลือต่างๆ, ยาและสารซักฟอก, สีย้อม, เส้นใยประดิษฐ์, วัตถุระเบิด มันถูกใช้ในโลหะวิทยา (การสลายตัวของแร่เช่นยูเรเนียม) สำหรับการทำให้บริสุทธิ์ของผลิตภัณฑ์ปิโตรเลียมเป็นสารดูดความชื้น ฯลฯ
สิ่งสำคัญในทางปฏิบัติคือกรดซัลฟิวริกที่แรงมาก (มากกว่า 75%) ไม่ทำปฏิกิริยากับธาตุเหล็ก ช่วยให้คุณสามารถจัดเก็บและขนส่งในถังเหล็กได้ ในทางตรงกันข้าม เจือจาง H 2 SO 4 จะละลายธาตุเหล็กได้ง่ายด้วยการปล่อยไฮโดรเจน คุณสมบัติการออกซิไดซ์นั้นไม่ธรรมดาเลย
กรดซัลฟิวริกที่แรงจะดูดซับความชื้นอย่างแรง ดังนั้นจึงมักใช้เพื่อทำให้ก๊าซแห้ง จากสารอินทรีย์หลายชนิดที่มีไฮโดรเจนและออกซิเจน นำเอาน้ำซึ่งมักใช้ในเทคโนโลยี ในทำนองเดียวกัน (เช่นเดียวกับคุณสมบัติการออกซิไดซ์ของ H 2 SO 4) ที่แรง มีผลทำลายล้างต่อเนื้อเยื่อพืชและสัตว์ กรดซัลฟิวริกที่บังเอิญโดนผิวหนังหรือชุดเดรสระหว่างทำงาน ควรล้างออกด้วยน้ำปริมาณมากทันที จากนั้นใช้สารละลายแอมโมเนียเจือจางในบริเวณที่ได้รับผลกระทบ จากนั้นล้างด้วยน้ำอีกครั้ง
ทุกคนในชั้นเรียนเคมีศึกษากรด หนึ่งในนั้นเรียกว่ากรดซัลฟิวริกและถูกกำหนดให้เป็น HSO 4 บทความของเราจะเล่าเกี่ยวกับคุณสมบัติของกรดซัลฟิวริก
คุณสมบัติทางกายภาพของกรดซัลฟิวริก
กรดซัลฟิวริกบริสุทธิ์หรือโมโนไฮเดรตเป็นของเหลวที่ไม่มีสีซึ่งแข็งตัวเป็นผลึกที่ +10 องศาเซลเซียส กรดกำมะถันสำหรับปฏิกิริยาประกอบด้วย 95% H 2 SO 4 และมีความหนาแน่น 1.84 ก./ซม. 3 กรดดังกล่าว 1 ลิตรมีน้ำหนัก 2 กิโลกรัม กรดแข็งตัวที่อุณหภูมิ -20 องศาเซลเซียส ความร้อนของการหลอมเหลวคือ 10.5 kJ/mol ที่อุณหภูมิ 10.37°C
คุณสมบัติของกรดซัลฟิวริกเข้มข้นมีความหลากหลาย ตัวอย่างเช่น เมื่อละลายกรดนี้ในน้ำ ความร้อนจำนวนมาก (19 kcal / mol) จะถูกปล่อยออกมาเนื่องจากการก่อตัวของไฮเดรต ไฮเดรตเหล่านี้สามารถแยกได้จากสารละลายที่อุณหภูมิต่ำในรูปของของแข็ง
กรดกำมะถันเป็นหนึ่งในผลิตภัณฑ์พื้นฐานที่สุดในอุตสาหกรรมเคมี มันมีไว้สำหรับการผลิตปุ๋ยแร่ (แอมโมเนียมซัลเฟต, ซูเปอร์ฟอสเฟต), เกลือและกรดต่างๆ, ผงซักฟอกและยา, เส้นใยเทียม, สีย้อม, วัตถุระเบิด กรดซัลฟิวริกยังใช้ในโลหะวิทยา (เช่น การสลายตัวของแร่ยูเรเนียม) เพื่อทำให้ผลิตภัณฑ์ปิโตรเลียมบริสุทธิ์ เพื่อทำให้แห้งแก๊ส และอื่นๆ
คุณสมบัติทางเคมีของกรดซัลฟิวริก
คุณสมบัติทางเคมีของกรดซัลฟิวริกคือ:
- ปฏิกิริยากับโลหะ:
- กรดเจือจางจะละลายเฉพาะโลหะที่อยู่ทางด้านซ้ายของไฮโดรเจนในชุดของแรงดันไฟฟ้าเช่น H 2 +1 SO 4 + Zn 0 \u003d H 2 O + Zn + 2 SO 4;
- คุณสมบัติการออกซิไดซ์ของกรดซัลฟิวริกนั้นยอดเยี่ยม เมื่อทำปฏิกิริยากับโลหะชนิดต่างๆ (ยกเว้น Pt, Au) สามารถลดลงเป็น H 2 S -2, S +4 O 2 หรือ S 0 ตัวอย่างเช่น
- 2H 2 +6 SO 4 + 2Ag 0 = S +4 O 2 + Ag 2 +1 SO 4 + 2H 2 O;
- 5H 2 +6 SO 4 + 8Na 0 \u003d H 2 S -2 + 4Na 2 +1 SO 4 + 4H 2 O;
- กรดเข้มข้น H 2 S +6 O 4 ยังทำปฏิกิริยา (เมื่อถูกความร้อน) กับอโลหะบางชนิด ในขณะที่เปลี่ยนเป็นสารประกอบกำมะถันที่มีสถานะออกซิเดชันต่ำกว่า เช่น
- 2H 2 S +6 O 4 + C 0 = 2S +4 O 2 + C +4 O 2 + 2H 2 O;
- 2H 2 S +6 O 4 + S 0 = 3S +4 O 2 + 2H 2 O;
- 5H 2 S +6 O 4 + 2P 0 = 2H 3 P +5 O 4 + 5S +4 O 2 + 2H 2 O;
- ด้วยออกไซด์พื้นฐาน:
- H 2 SO 4 + CuO = CuSO 4 + H 2 O;
- ด้วยไฮดรอกไซด์:
- Cu(OH) 2 + H 2 SO 4 = CuSO 4 + 2H 2 O;
- 2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O;
- ปฏิกิริยากับเกลือในปฏิกิริยาแลกเปลี่ยน:
- H 2 SO 4 + BaCl 2 \u003d 2HCl + BaSO 4;
การก่อตัวของ BaSO 4 (ตกตะกอนสีขาว ไม่ละลายในกรด) ใช้เพื่อกำหนดกรดนี้และซัลเฟตที่ละลายน้ำได้
โมโนไฮเดรตเป็นตัวทำละลายไอออไนซ์ที่มีลักษณะเป็นกรด เป็นการดีที่จะละลายซัลเฟตของโลหะหลายชนิดในนั้น เช่น
- 2H 2 SO 4 + HNO 3 \u003d NO 2 + + H 3 O + + 2HSO 4 -;
- HClO 4 + H 2 SO 4 \u003d ClO 4 - + H 3 SO 4 +
กรดเข้มข้นเป็นสารออกซิไดซ์ที่แรงพอสมควร โดยเฉพาะอย่างยิ่งเมื่อถูกความร้อน เช่น 2H 2 SO 4 + Cu = SO 2 + CuSO 4 + H 2 O
ทำหน้าที่เป็นตัวออกซิไดซ์ กรดซัลฟิวริกมักจะลดลงเหลือ SO 2 . แต่สามารถลดเป็น S และแม้แต่ H 2 S เช่น H 2 S + H 2 SO 4 = SO 2 + 2H 2 O + S
โมโนไฮเดรตแทบนำไฟฟ้าไม่ได้ ในทางกลับกัน สารละลายกรดในน้ำเป็นตัวนำที่ดี กรดกำมะถันดูดซับความชื้นได้ดีจึงใช้เพื่อทำให้แห้งก๊าซต่างๆ กรดซัลฟิวริกทำหน้าที่เป็นสารดูดความชื้นตราบใดที่แรงดันไอน้ำเหนือสารละลายนั้นน้อยกว่าแรงดันในก๊าซที่กำลังถูกทำให้แห้ง
หากต้มสารละลายกรดซัลฟิวริกเจือจาง น้ำจะถูกลบออก ในขณะที่จุดเดือดจะเพิ่มขึ้นเป็น 337 ° C เช่น เมื่อเริ่มกลั่นกรดซัลฟิวริกที่ความเข้มข้น 98.3% ในทางกลับกัน จากสารละลายที่มีความเข้มข้นมากขึ้น ซัลฟิวริกแอนไฮไดรด์ส่วนเกินจะระเหยออกไป การต้มด้วยไอน้ำที่อุณหภูมิ 337 ° C กรดจะถูกย่อยสลายบางส่วนเป็น SO 3 และ H 2 O ซึ่งจะรวมกันอีกครั้งเมื่อเย็นลง จุดเดือดสูงของกรดนี้เหมาะสำหรับใช้ในการแยกกรดระเหยออกจากเกลือเมื่อถูกความร้อน
ข้อควรระวังในการจัดการกรด
เมื่อจัดการกับกรดซัลฟิวริก ต้องใช้ความระมัดระวังอย่างยิ่ง เมื่อกรดนี้สัมผัสกับผิวหนัง ผิวจะกลายเป็นสีขาว จากนั้นจึงเกิดเป็นสีน้ำตาลและสีแดง เนื้อเยื่อรอบข้างจะบวมขึ้น หากกรดนี้สัมผัสกับส่วนใดส่วนหนึ่งของร่างกาย จะต้องล้างออกด้วยน้ำอย่างรวดเร็ว และบริเวณที่ไหม้ควรหล่อลื่นด้วยสารละลายโซดา
ตอนนี้คุณรู้แล้วว่ากรดซัลฟิวริกซึ่งมีคุณสมบัติที่ได้รับการศึกษามาเป็นอย่างดี เป็นสิ่งที่ขาดไม่ได้สำหรับการผลิตและการขุดที่หลากหลาย
คำนิยาม
ปราศจากน้ำ กรดกำมะถันเป็นของเหลวหนืดหนักที่ผสมกับน้ำได้ง่ายในสัดส่วนใดๆ: ปฏิกิริยาดังกล่าวมีลักษณะพิเศษโดยคายความร้อนขนาดใหญ่เป็นพิเศษ (~880 kJ / mol ที่การเจือจางแบบไม่สิ้นสุด) และสามารถนำไปสู่การเดือดระเบิดและการกระเด็นของส่วนผสมได้หากน้ำอยู่ เพิ่มกรด; ด้วยเหตุนี้จึงเป็นสิ่งสำคัญมากที่ต้องใช้ลำดับย้อนกลับในการเตรียมสารละลายและเติมกรดลงในน้ำ อย่างช้าๆ และด้วยการกวน
คุณสมบัติทางกายภาพบางประการของกรดซัลฟิวริกแสดงไว้ในตาราง
แอนไฮดรัส H 2 SO 4 เป็นสารประกอบที่โดดเด่นที่มีค่าคงที่ไดอิเล็กตริกสูงผิดปกติและมีค่าการนำไฟฟ้าสูงมาก ซึ่งเกิดจากการแตกตัวอัตโนมัติของไอออน (การสร้างอัตโนมัติ) ของสารประกอบ เช่นเดียวกับกลไกการนำถ่ายทอดการถ่ายโอนโปรตอน ซึ่งทำให้มั่นใจได้ถึงการไหลของ กระแสไฟฟ้าผ่านของเหลวหนืดด้วย จำนวนมากพันธะไฮโดรเจน
ตารางที่ 1. คุณสมบัติทางกายภาพของกรดซัลฟิวริก
รับกรดกำมะถัน
กรดกำมะถันเป็นสารเคมีทางอุตสาหกรรมที่สำคัญที่สุดและเป็นกรดปริมาณมากที่ถูกที่สุดที่ผลิตได้ทุกที่ในโลก
กรดซัลฟิวริกเข้มข้น (“น้ำมันกรดกำมะถัน”) ได้รับครั้งแรกโดยให้ความร้อนแก่ “กรดกำมะถันสีเขียว” FeSO 4 ×nH 2 O และใช้ในปริมาณมากเพื่อให้ได้ Na 2 SO 4 และ NaCl
ที่ กระบวนการที่ทันสมัยสำหรับการผลิตกรดซัลฟิวริก จะใช้ตัวเร่งปฏิกิริยาที่ประกอบด้วยวาเนเดียมออกไซด์ (V) ออกไซด์ด้วยการเติมโพแทสเซียมซัลเฟตบนตัวพาของซิลิกอนไดออกไซด์หรือคีเซลกูร์ ซัลเฟอร์ไดออกไซด์ SO 2 ได้มาจากการเผาไหม้กำมะถันบริสุทธิ์หรือโดยการคั่วแร่ซัลไฟด์ (โดยหลักคือ ไพไรต์หรือแร่ Cu, Ni และ Zn) ในกระบวนการสกัดโลหะเหล่านี้ จากนั้น SO 2 จะถูกออกซิไดซ์เป็นไตรออกไซด์ จากนั้น จะได้กรดซัลฟิวริกโดย ละลายในน้ำ:
S + O 2 → SO 2 (ΔH 0 - 297 kJ / mol);
SO 2 + ½ O 2 → SO 3 (ΔH 0 - 9.8 kJ / mol);
SO 3 + H 2 O → H 2 SO 4 (ΔH 0 - 130 kJ / mol)
คุณสมบัติทางเคมีของกรดซัลฟิวริก
กรดซัลฟิวริกเป็นกรดไดบาซิกที่แรง ในระยะแรก ในสารละลายที่มีความเข้มข้นต่ำ จะแยกตัวออกเกือบทั้งหมด:
H 2 SO 4 ↔H + + HSO 4 -.
ความแตกแยกในระยะที่สอง
HSO 4 - ↔H + + SO 4 2-
ดำเนินไปในระดับที่น้อยกว่า ค่าคงที่การแยกตัวของกรดซัลฟิวริกในระยะที่สอง แสดงในรูปของกิจกรรมไอออน K 2 = 10 -2
ในฐานะที่เป็นกรดไดบาซิก กรดซัลฟิวริกจะสร้างเกลือสองชุด: กรดปานกลางและกรด เกลือปานกลางของกรดซัลฟิวริกเรียกว่าซัลเฟตและเกลือที่เป็นกรดเรียกว่าไฮโดรซัลเฟต
กรดซัลฟิวริกดูดซับไอน้ำอย่างตะกละตะกลาม จึงมักใช้เพื่อทำให้ก๊าซแห้ง ความสามารถในการดูดซับน้ำยังอธิบายถึงการไหม้เกรียมของสารอินทรีย์หลายชนิด โดยเฉพาะอย่างยิ่งที่อยู่ในกลุ่มคาร์โบไฮเดรต (ไฟเบอร์ น้ำตาล ฯลฯ) เมื่อสัมผัสกับกรดซัลฟิวริกเข้มข้น กรดซัลฟิวริกกำจัดไฮโดรเจนและออกซิเจนออกจากคาร์โบไฮเดรต ซึ่งก่อตัวเป็นน้ำ และคาร์บอนจะถูกปลดปล่อยออกมาในรูปของถ่านหิน
กรดซัลฟิวริกเข้มข้น โดยเฉพาะอย่างยิ่งร้อน เป็นตัวออกซิไดซ์ที่แรง มันออกซิไดซ์ HI และ HBr (แต่ไม่ใช่ HCl) เพื่อให้ปราศจากฮาโลเจน ถ่านหินเป็น CO 2 กำมะถันเป็น SO 2 ปฏิกิริยาเหล่านี้แสดงโดยสมการ:
8HI + H 2 SO 4 \u003d 4I 2 + H 2 S + 4H 2 O;
2HBr + H 2 SO 4 \u003d Br 2 + SO 2 + 2H 2 O;
C + 2H 2 SO 4 \u003d CO 2 + 2SO 2 + 2H 2 O;
S + 2H 2 SO 4 \u003d 3SO 2 + 2H 2 O
ปฏิกิริยาของกรดซัลฟิวริกกับโลหะจะแตกต่างกันไปตามความเข้มข้น กรดซัลฟิวริกเจือจางออกซิไดซ์ด้วยไฮโดรเจนไอออน ดังนั้นจึงทำปฏิกิริยากับโลหะที่อยู่ในชุดของแรงดันไฟฟ้าจนถึงไฮโดรเจนเท่านั้น ตัวอย่างเช่น
Zn + H 2 SO 4 \u003d ZnSO 4 + H 2
อย่างไรก็ตาม ตะกั่วไม่ละลายในกรดเจือจางเนื่องจากเกลือ PbSO 4 ที่เกิดขึ้นนั้นไม่ละลายน้ำ
กรดซัลฟิวริกเข้มข้นเป็นสารออกซิไดซ์เนื่องจากกำมะถัน (VI) มันออกซิไดซ์โลหะในซีรีย์แรงดันไฟฟ้าจนถึงและรวมถึงเงิน ผลิตภัณฑ์ของการรีดิวซ์อาจแตกต่างกันไปตามกิจกรรมของโลหะและสภาวะ (ความเข้มข้นของกรด อุณหภูมิ) เมื่อทำปฏิกิริยากับโลหะที่มีปฏิกิริยาต่ำ เช่น ทองแดง กรดจะลดลงเหลือ SO 2:
Cu + 2H 2 SO 4 \u003d CuSO 4 + SO 2 + 2H 2 O.
เมื่อทำปฏิกิริยากับโลหะที่มีฤทธิ์มากขึ้น ผลิตภัณฑ์รีดิวซ์สามารถเป็นได้ทั้งไดออกไซด์และซัลเฟอร์อิสระและไฮโดรเจนซัลไฟด์ ตัวอย่างเช่น เมื่อทำปฏิกิริยากับสังกะสี ปฏิกิริยาอาจเกิดขึ้น:
Zn + 2H 2 SO 4 \u003d ZnSO 4 + SO 2 + 2H 2 O;
3Zn + 4H 2 SO 4 = 3ZnSO 4 + S↓ + 4H 2 O;
4Zn + 5H 2 SO 4 \u003d 4ZnSO 4 + H 2 S + 4H 2 O
การใช้กรดซัลฟิวริก
การใช้กรดซัลฟิวริกแตกต่างกันไปในแต่ละประเทศและจากทศวรรษสู่ทศวรรษ ตัวอย่างเช่น ในสหรัฐอเมริกา พื้นที่หลักของการใช้ H 2 SO 4 คือการผลิตปุ๋ย (70%) ตามด้วยการผลิตสารเคมี โลหะวิทยา การกลั่นน้ำมัน (~5% ในแต่ละพื้นที่) ในสหราชอาณาจักร การกระจายการบริโภคตามอุตสาหกรรมแตกต่างกัน: เพียง 30% ของ H 2 SO 4 ที่ผลิตเท่านั้นที่ใช้ในการผลิตปุ๋ย แต่ 18% ไปที่สี เม็ดสี และสารตัวกลางสีย้อม 16% สำหรับการผลิตเคมี 12% สำหรับสบู่และผงซักฟอก 10% สำหรับการผลิตเส้นใยธรรมชาติและเส้นใยประดิษฐ์และ 2.5% ใช้ในโลหะวิทยา
ตัวอย่างการแก้ปัญหา
ตัวอย่าง 1
| ออกกำลังกาย | กำหนดมวลของกรดซัลฟิวริกที่สามารถหาได้จากไพไรต์หนึ่งตัน ถ้าผลผลิตของซัลเฟอร์ออกไซด์ (IV) ในปฏิกิริยาการคั่วเท่ากับ 90% และซัลเฟอร์ออกไซด์ (VI) ในปฏิกิริยา ตัวเร่งปฏิกิริยาออกซิเดชันกำมะถัน (IV) - 95% ของทฤษฎี |
| วิธีการแก้ | ให้เราเขียนสมการปฏิกิริยาสำหรับการยิงไพไรต์: 4FeS 2 + 11O 2 \u003d 2Fe 2 O 3 + 8SO 2 คำนวณปริมาณสารหนาแน่น: n(FeS 2) = m(FeS 2) / M(FeS 2); M (FeS 2) \u003d Ar (Fe) + 2 × Ar (S) \u003d 56 + 2 × 32 \u003d 120 g / mol; n (FeS 2) \u003d 1,000 กก. / 120 \u003d 8.33 kmol เนื่องจากในสมการปฏิกิริยาสัมประสิทธิ์ของซัลเฟอร์ไดออกไซด์มีขนาดใหญ่เป็นสองเท่าของค่าสัมประสิทธิ์ของ FeS 2 ปริมาณซัลเฟอร์ออกไซด์ (IV) ที่เป็นไปได้ในทางทฤษฎีคือ: n (SO 2) theor \u003d 2 × n (FeS 2) \u003d 2 × 8.33 \u003d 16.66 kmol และปริมาณโมลของซัลเฟอร์ออกไซด์ (IV) ที่ได้รับคือ: n (SO 2) ปฏิบัติ \u003d η × n (SO 2) theor \u003d 0.9 × 16.66 \u003d 15 kmol ลองเขียนสมการปฏิกิริยาสำหรับการเกิดออกซิเดชันของซัลเฟอร์ออกไซด์ (IV) ถึงซัลเฟอร์ออกไซด์ (VI): 2SO 2 + O 2 \u003d 2SO 3 ปริมาณซัลเฟอร์ออกไซด์ (VI) ที่เป็นไปได้ในทางทฤษฎีคือ: n(SO 3) ทฤษฎีหรือ \u003d n (SO 2) ปฏิบัติ \u003d 15 kmol และปริมาณโมลของซัลเฟอร์ออกไซด์ (VI) ที่ได้รับคือ: n(SO 3) ปฏิบัติ \u003d η × n (SO 3) theor \u003d 0.5 × 15 \u003d 14.25 kmol เราเขียนสมการปฏิกิริยาสำหรับการผลิตกรดซัลฟิวริก: ดังนั้น 3 + H 2 O \u003d H 2 SO 4 ค้นหาปริมาณของสารกรดซัลฟิวริก: n (H 2 SO 4) \u003d n (SO 3) ปฏิบัติ \u003d 14.25 kmol ผลผลิตปฏิกิริยาคือ 100% มวลของกรดซัลฟิวริกคือ: ม. (H 2 SO 4) \u003d n (H 2 SO 4) × M (H 2 SO 4); M(H 2 SO 4) = 2×Ar(H) + Ar(S) + 4×Ar(O) = 2×1 + 32 + 4×16 = 98 ก./โมล; ม. (H 2 SO 4) \u003d 14.25 × 98 \u003d 1397 กก. |
| ตอบ | มวลของกรดซัลฟิวริกเท่ากับ 1397 กก. |
กรดกำมะถัน H2SO4, มวลโมเลกุล 98.082; ไม่มีสี ของเหลวน้ำมันไม่มีกลิ่น กรดไดบาซิกที่แรงมากที่ 18°C pK a 1 - 2.8, K 2 1.2 10 -2, pK a 2 l.92; ความยาวพันธะในโมเลกุล S=O 0.143 nm, S-OH 0.154 nm, มุม HOSOH 104°, OSO 119°; เดือดด้วยหลากหลายรูปแบบเป็นส่วนผสม azeotropic (98.3% H 2 SO 4 และ 1.7% H 2 O ที่มีจุดเดือด 338.8 ° C ดูตารางที่ 1) กรดซัลฟิวริกซึ่งสอดคล้องกับเนื้อหา 100% H 2 SO 4 มีองค์ประกอบ (%): H 2 SO 4 99.5, 0.18, 0.14, H 3 O + 0.09, H 2 S 2 O 7 0.04, HS 2 O 7 0.05 ผสมกับน้ำและ SO 3 ได้ทุกสัดส่วน ในสารละลายที่เป็นน้ำ กรดซัลฟิวริกเกือบจะแยกตัวออกเป็น H + และ . รูปแบบไฮเดรต H 2 SO 4 nH 2 O โดยที่ n = 1, 2, 3, 4 และ 6.5
สารละลาย SO 3 ในกรดซัลฟิวริกเรียกว่าโอเลี่ยม ซึ่งก่อตัวเป็นสารประกอบสองชนิด H 2 SO 4 SO 3 และ H 2 SO 4 2SO 3 Oleum ยังมีกรดไพโรซัลฟิวริกซึ่งได้จากปฏิกิริยา: H 2 SO 4 + + SO 3: H 2 S 2 O 7


จุดเดือดของสารละลายในน้ำของกรดซัลฟิวริก ถึง เพิ่มขึ้นตามความเข้มข้นที่เพิ่มขึ้นและถึงค่าสูงสุดที่เนื้อหา 98.3% H 2 SO 4 (ตารางที่ 2) จุดเดือดของน้ำมันจะลดลงตามปริมาณ SO 3 ที่เพิ่มขึ้น ด้วยการเพิ่มความเข้มข้นของสารละลายในน้ำของกรดซัลฟิวริก ความดันไอทั้งหมดเหนือสารละลายจะลดลงและที่เนื้อหา 98.3% H 2 SO 4 จะถึงค่าต่ำสุด ด้วยการเพิ่มความเข้มข้นของ SO 3 ในโอเลี่ยม ความดันไอทั้งหมดที่อยู่เหนือมันจะเพิ่มขึ้น ความดันไอเหนือสารละลายของกรดซัลฟิวริก ค. และน้ำมันสามารถคำนวณได้จากสมการ: lgp (Pa) \u003d A - B / T + 2.126 ค่าของสัมประสิทธิ์ A และ B ขึ้นอยู่กับ ความเข้มข้นของกรดซัลฟิวริก ค. ไอน้ำเหนือสารละลายที่เป็นน้ำของกรดซัลฟิวริก ค. ประกอบด้วยส่วนผสมของไอน้ำ H 2 SO 4 และ SO 3 ในขณะที่องค์ประกอบของไอแตกต่างจากองค์ประกอบของของเหลวที่ความเข้มข้นทั้งหมดของกรดซัลฟิวริก ค. ยกเว้นของผสมอะซีโอโทรปิกที่สอดคล้องกัน
เมื่ออุณหภูมิเพิ่มขึ้นการแยกตัวของ H 2 SO 4 H 2 O + SO 3 - Q จะเพิ่มขึ้น สมการสำหรับการพึ่งพาอุณหภูมิของค่าคงที่สมดุล lnК p = 14.74965 - 6.71464ln (298 / T) - 8, 10161 10 4 T 2 -9643.04 /T-9.4577 10 -3 T+2.19062 x 10 -6 T 2 . ที่ความดันปกติ ระดับความแตกแยก: 10 -5 (373 K), 2.5 (473 K), 27.1 (573 K), 69.1 (673 K) ความหนาแน่นของกรดกำมะถัน 100% สามารถกำหนดได้โดยสมการ: d = 1.8517 - - 1.1 10 -3 t + 2 10 -6 t 2 g / cm 3 ด้วยการเพิ่มความเข้มข้นของสารละลายกรดซัลฟิวริก ความจุความร้อนจะลดลงและถึงขั้นต่ำสำหรับกรดซัลฟิวริก 100% ในขณะที่ความจุความร้อนของโอเลี่ยมจะเพิ่มขึ้นตามปริมาณ SO 3 ที่เพิ่มขึ้น
เมื่อความเข้มข้นเพิ่มขึ้นและอุณหภูมิลดลง ค่าการนำความร้อน l จะลดลง: l \u003d 0.518 + 0.0016t - (0.25 + + t / 1293) C / 100 โดยที่ C คือความเข้มข้นของกรดซัลฟิวริก c. เป็น% . แม็กซ์ ความหนืดมี oleum H 2 SO 4 SO 3 เมื่ออุณหภูมิเพิ่มขึ้น ชั่วโมง ลดลง ไฟฟ้า ความต้านทานของกรดกำมะถันต่อ มีค่าน้อยที่สุดที่ความเข้มข้น 30 และ 92% H 2 SO 4 และสูงสุดที่ความเข้มข้น 84 และ 99.8% H 2 SO 4 สำหรับโอเลี่ยมขั้นต่ำ r ที่ความเข้มข้น 10% SO 3 . เมื่ออุณหภูมิเพิ่มขึ้น r SULFURIC ACID จะเพิ่มขึ้น อิเล็กทริก การซึมผ่าน 100% ห้องกรดกำมะถัน 101 (298.15 K), 122 (281.15 K); แช่แข็ง ค่าคงที่ 6.12 ebulioscopic คงที่ 5.33; ค่าสัมประสิทธิ์การแพร่ของไอ SULFURIC ACID ในอากาศเปลี่ยนแปลงตามอุณหภูมิ D \u003d 1.67 10 -5 T 3/2 cm 2 / s
กรดซัลฟิวริกเป็นสารออกซิไดซ์ที่ค่อนข้างแรง โดยเฉพาะอย่างยิ่งเมื่อถูกความร้อน ออกซิไดซ์ HI และ HBr บางส่วนเพื่อให้เป็นฮาโลเจน คาร์บอนเป็น CO 2, S ถึง SO 2 ออกซิไดซ์โลหะจำนวนมาก (Cu, Hg ฯลฯ) ในกรณีนี้ กรดซัลฟิวริกจะลดลงเหลือ SO 2 และสารรีดิวซ์ที่ทรงพลังที่สุดจะลดลงเหลือ S และ H 2 S. Conc. H 2 SO 4 ลดลงบางส่วนโดย H 2 ซึ่งเป็นสาเหตุที่ทำให้ไม่สามารถใช้เพื่อทำให้แห้งได้ แตกต่าง ปฏิกิริยา H 2 SO 4 กับโลหะทั้งหมดที่อยู่ในอนุกรมไฟฟ้าเคมีของแรงดันไฟฟ้าทางด้านซ้ายของไฮโดรเจน โดยปล่อย H 2 . ออกซิไดซ์ คุณสมบัติของเจือจาง H 2 SO 4 นั้นไม่เคยมีมาก่อน กรดซัลฟูริกให้เกลือสองชุด: ซัลเฟตปานกลางและไฮโดรซัลเฟตที่เป็นกรด (ดู ซัลเฟตอนินทรีย์) เช่นเดียวกับอีเทอร์ (ดู ซัลเฟตอินทรีย์) Peroxomonosulphuric (กรดของ Caro) H 2 SO 5 และ peroxodisulfuric H 2 S 2 O 8 กรดเป็นที่รู้จักกัน (ดู กำมะถัน)
ใบเสร็จ.วัตถุดิบสำหรับการได้รับกรดซัลฟิวริกคือ: S, ซัลไฟด์โลหะ, H 2 S, ก๊าซไอเสียจากโรงไฟฟ้าพลังความร้อน, ซัลเฟตของ Fe, Ca, ฯลฯ หลัก ขั้นตอนของการได้รับกรดซัลฟิวริก k.: 1) การคั่ววัตถุดิบเพื่อให้ได้ SO 2 ; 2) การเกิดออกซิเดชันของ SO 2 ถึง SO 3 (การแปลง); 3) SO 3 การดูดซึม ในอุตสาหกรรม มีการใช้สองวิธีเพื่อให้ได้กรดซัลฟิวริก ซึ่งแตกต่างกันในวิธีที่ SO 2 ถูกออกซิไดซ์ การสัมผัสโดยใช้ตัวเร่งปฏิกิริยาที่เป็นของแข็ง (หน้าสัมผัส) และไนตรัสกับไนโตรเจนออกไซด์ เพื่อให้ได้กรดซัลฟิวริกโดยวิธีการสัมผัส โรงงานสมัยใหม่ใช้ตัวเร่งปฏิกิริยาวาเนเดียมที่เปลี่ยน Pt และ Fe ออกไซด์ Pure V 2 O 5 มีกิจกรรมเร่งปฏิกิริยาที่อ่อนแอซึ่งเพิ่มขึ้นอย่างรวดเร็วเมื่อมีเกลือโลหะอัลคาไลโดยที่เกลือ K มีอิทธิพลมากที่สุด 7 V 2 O 5 และ K 2 S 2 O 7 V 2 O 5 สลายตัวที่ 315 -330, 365-380 และ 400-405 °C ตามลำดับ) สารออกฤทธิ์ภายใต้ตัวเร่งปฏิกิริยาอยู่ในสถานะหลอมเหลว
โครงร่างสำหรับการเกิดออกซิเดชันของ SO 2 ถึง SO 3 สามารถแสดงได้ดังนี้:
ในระยะแรกถึงสมดุล ขั้นตอนที่สองช้าและกำหนดความเร็วของกระบวนการ
การผลิตกรดซัลฟิวริกจากกำมะถันโดยวิธีการสัมผัสคู่และการดูดซับสองครั้ง (รูปที่ 1) ประกอบด้วยขั้นตอนต่อไปนี้ อากาศหลังการทำความสะอาดจากฝุ่นจะถูกส่งโดยเครื่องเป่าลมแก๊สไปยังหอทำแห้ง ซึ่งจะถูกทำให้แห้งด้วยกรดซัลฟิวริก 93-98% เพื่อให้มีความชื้น 0.01% โดยปริมาตร อากาศแห้งจะเข้าสู่เตากำมะถันหลังจากให้ความร้อนล่วงหน้า ความร้อนในเครื่องแลกเปลี่ยนความร้อนตัวใดตัวหนึ่งของหน่วยสัมผัส เตาเผากำมะถันที่จ่ายโดยหัวฉีด: S + O 2 : SO 2 + + 297.028 kJ ก๊าซที่มีปริมาตร SO 2 10-14% จะถูกทำให้เย็นลงในหม้อไอน้ำและหลังจากการเจือจางด้วยอากาศเป็นปริมาณ SO 2 9-10% โดยปริมาตรที่ 420 ° C จะเข้าสู่อุปกรณ์สัมผัสสำหรับขั้นตอนแรกของการแปลง ซึ่งดำเนินการกับตัวเร่งปฏิกิริยาสามชั้น (SO 2 + V 2 O 2 : : SO 3 + 96.296 kJ) หลังจากนั้นก๊าซจะถูกทำให้เย็นลงในเครื่องแลกเปลี่ยนความร้อน จากนั้นก๊าซที่มี SO 3 8.5-9.5% ที่ 200 ° C จะเข้าสู่ขั้นตอนแรกของการดูดซึมเข้าสู่ตัวดูดซับ ชลประทานด้วย oleum และ 98% SULFURIC ACID เป็น.: SO 3 + H 2 O: H 2 SO 4 + + 130.56 kJ . ถัดไป ก๊าซจะถูกทำความสะอาดจากการกระเด็นของกรดซัลฟิวริก ให้ความร้อนถึง 420 ° C และเข้าสู่ขั้นตอนที่สองของการแปลง ซึ่งเกิดขึ้นบนตัวเร่งปฏิกิริยาสองชั้น ก่อนการดูดซับระยะที่สอง ก๊าซจะถูกทำให้เย็นลงในเครื่องประหยัดและป้อนเข้าไปในตัวดูดซับระยะที่สอง ให้น้ำด้วยกรดซัลฟูริก 98% จากนั้นหลังจากทำความสะอาดจากการกระเด็น ก๊าซจะถูกปล่อยสู่ชั้นบรรยากาศ 
ข้าว. 1. โครงการผลิตกรดกำมะถันจากกำมะถัน: เตาเผา 1 กำมะถัน หม้อไอน้ำกู้คืนความร้อน 2 ตัว; 3 - ประหยัด; เรือนไฟ 4 สตาร์ท; 5, 6- เครื่องแลกเปลี่ยนความร้อนของเตาเผาเริ่มต้น; อุปกรณ์ 7 พิน; เครื่องแลกเปลี่ยนความร้อน 8 เครื่อง; ตัวดูดซับ 9-oleum; 10 หออบแห้ง; 11 และ 12, ตามลำดับ, ตัวดูดซับโมโนไฮเดรตที่หนึ่งและที่สอง; ตัวสะสมกรด 13 ตัว

รูปที่ 2 โครงการสำหรับการผลิตกรดซัลฟิวริกจากไพไรต์: เครื่องป้อน 1 จาน; 2 เตา; หม้อไอน้ำกู้คืนความร้อน 3 ตัว; 4 ไซโคลน; เครื่องตกตะกอนไฟฟ้าสถิต 5 เครื่อง; 6 หอซักล้าง; เครื่องตกตะกอนไฟฟ้าสถิต 7 เปียก; 8 หอระเบิด; หออบแห้ง 9; 10 กับดักน้ำกระเซ็น; ตัวดูดซับโมโนไฮเดรต 11 ตัวแรก; วิกิแลกเปลี่ยนความร้อน 12 ครั้ง; 13 - อุปกรณ์ติดต่อ; ตัวดูดซับ 14-oleum; ตัวดูดซับโมโนไฮเดรต 15 วินาที; 16 ตู้เย็น; 17 คอลเลกชัน

ข้าว. 3. โครงการสำหรับการผลิตกรดซัลฟิวริกโดยวิธีไนตรัส: 1 - denitratz หอคอย; 2, 3- ผลิตภัณฑ์แรกและครั้งที่สอง หอคอย; 4-ออกซิไดซ์ หอคอย; 5, 6, 7- ดูดซับ หอคอย; 8 - เครื่องตกตะกอนไฟฟ้าสถิต
การผลิตกรดซัลฟิวริกจากโลหะซัลไฟด์ (รูปที่ 2) นั้นซับซ้อนกว่ามากและประกอบด้วยการดำเนินการดังต่อไปนี้ การคั่วของ FeS 2 ดำเนินการในเตาเผาฟลูอิไดซ์เบดแบบเป่าลม: 4FeS 2 + 11O 2: 2Fe 2 O 3 + 8SO 2 + 13476 kJ ก๊าซย่างที่มีปริมาณ SO 2 13-14% มีอุณหภูมิ 900 °C เข้าสู่หม้อไอน้ำซึ่งจะถูกทำให้เย็นลงถึง 450 °C การกำจัดฝุ่นจะดำเนินการในพายุไซโคลนและเครื่องตกตะกอนไฟฟ้าสถิต นอกจากนี้ ก๊าซจะไหลผ่านหอซักล้าง 2 แห่ง ซึ่งได้รับการชลประทานด้วยกรดซัลฟิวริก 40% และ 10% ในขณะเดียวกัน ก๊าซก็ถูกทำให้บริสุทธิ์จากฝุ่น ฟลูออรีน และสารหนูในที่สุด มีการเตรียมการตกตะกอนไฟฟ้าสถิตแบบเปียกสองขั้นตอนสำหรับการทำให้ก๊าซบริสุทธิ์จากละออง SULFURIC ACID ที่เกิดขึ้นในหอล้าง หลังจากการอบแห้งในหอทำให้แห้ง ก่อนที่ก๊าซจะเจือจางเป็น 9% SO 2 จะถูกป้อนไปยังขั้นตอนการแปลงแรก (เตียงตัวเร่งปฏิกิริยา 3 เตียง) โดยเครื่องเป่าลม ในเครื่องแลกเปลี่ยนความร้อน ก๊าซจะได้รับความร้อนสูงถึง 420 °C เนื่องจากความร้อนของก๊าซที่มาจากขั้นตอนแรกของการแปลงสภาพ SO 2 ถูกออกซิไดซ์เป็น 92-95% ใน SO 3 ไปที่ขั้นตอนแรกของการดูดซึมในตัวดูดซับโอเลี่ยมและโมโนไฮเดรต ซึ่งจะถูกปล่อยออกมาจาก SO 3 ถัดไป ก๊าซที่มี SO 2 ~ 0.5% จะเข้าสู่ขั้นตอนการแปลงที่สอง ซึ่งเกิดขึ้นในชั้นตัวเร่งปฏิกิริยาหนึ่งหรือสองชั้น ก๊าซได้รับความร้อนเบื้องต้นในเครื่องแลกเปลี่ยนความร้อนอีกกลุ่มหนึ่งที่อุณหภูมิสูงถึง 420 °C เนื่องจากความร้อนของก๊าซที่มาจากขั้นตอนที่สองของการเร่งปฏิกิริยา หลังจากแยก SO 3 ในระยะที่สองของการดูดซับ ก๊าซจะถูกปล่อยสู่ชั้นบรรยากาศ
ระดับการแปลง SO 2 เป็น SO 3 ในวิธีการสัมผัสคือ 99.7% ระดับการดูดกลืน SO 3 คือ 99.97% การผลิตกรดซัลฟิวริกยังดำเนินการในขั้นตอนเดียวของการเร่งปฏิกิริยา ในขณะที่ระดับของการแปลง SO 2 เป็น SO 3 ไม่เกิน 98.5% ก่อนปล่อยสู่ชั้นบรรยากาศ ก๊าซจะถูกทำให้บริสุทธิ์จาก SO 2 ที่เหลือ (ดูการทำให้บริสุทธิ์ด้วยแก๊ส) ผลผลิตของการติดตั้งที่ทันสมัยคือ 1,500-3100 ตัน / วัน
สาระสำคัญของวิธีไนตรัส (รูปที่ 3) คือก๊าซที่คั่วหลังจากการทำให้เย็นและทำความสะอาดจากฝุ่นแล้วจะได้รับการบำบัดด้วยไนโตรซีที่เรียกว่าไนโตรซี ถึง. ซึ่งในโซล ไนโตรเจนออกไซด์. SO 2 ถูกดูดซับโดยไนโตสแล้วออกซิไดซ์: SO 2 + N 2 O 3 + H 2 O: H 2 SO 4 + NO ผลลัพธ์ NO นั้นละลายได้ไม่ดีในไนโตรและถูกปล่อยออกมา จากนั้นออกซิเจนบางส่วนจะถูกออกซิไดซ์ในเฟสของแก๊สเป็น NO 2 ของผสมของ NO และ NO 2 ถูกดูดกลับโดยกรดซัลฟิวริก เป็นต้น ไนโตรเจนออกไซด์จะไม่ถูกใช้ในกระบวนการไนตรัสและจะกลับสู่การผลิต เนื่องจากการดูดซับกรดซัลฟิวริกที่ไม่สมบูรณ์ไปเป็นก๊าซไอเสียบางส่วน ข้อดีของวิธีไนตรัส: ความเรียบง่ายของการออกแบบฮาร์ดแวร์ ต้นทุนที่ต่ำกว่า (ต่ำกว่าแบบสัมผัส 10-15%) ความเป็นไปได้ของการประมวลผล SO 2 100%
การวัดค่าของกระบวนการสร้างไนตรัสของหอคอยนั้นง่ายมาก: SO 2 ถูกประมวลผลในหอคอยเรียงราย 7-8 แห่งด้วยเซรามิก หัวฉีด หนึ่งในเสา (กลวง) เป็นตัวออกซิไดเซอร์ที่ปรับได้ ปริมาณ. หอคอยมีตัวสะสมกรด ตู้เย็น ปั๊มที่จ่ายกรดไปยังถังแรงดันเหนือหอคอย มีการติดตั้งพัดลมหางไว้ด้านหน้าอาคารสองหลังสุดท้าย เครื่องตกตะกอนไฟฟ้าสถิตทำหน้าที่ในการทำให้ก๊าซบริสุทธิ์จากละอองของกรดซัลฟิวริก ไนโตรเจนออกไซด์ที่จำเป็นสำหรับกระบวนการนั้นได้มาจาก HNO 3 เพื่อลดการปล่อยไนโตรเจนออกไซด์สู่บรรยากาศและการประมวลผล SO 2 100% วงจรการประมวลผล SO 2 ที่ปราศจากไนตรัสได้รับการติดตั้งระหว่างโซนการผลิตและโซนดูดซับร่วมกับวิธีกรดน้ำสำหรับการดักจับไนโตรเจนออกไซด์แบบลึก ข้อเสียของวิธีไนตรัสคือผลิตภัณฑ์ที่มีคุณภาพต่ำ: ความเข้มข้นของกรดซัลฟิวริกคือ 75% การมีอยู่ของไนโตรเจนออกไซด์ Fe และสิ่งสกปรกอื่น ๆ
เพื่อลดความเป็นไปได้ของการตกผลึกของกรดซัลฟิวริก ในระหว่างการขนส่งและการเก็บรักษา ได้มีการกำหนดมาตรฐานสำหรับเกรดเชิงพาณิชย์ของกรดซัลฟิวริก ซึ่งมีความเข้มข้นที่สอดคล้องกับอุณหภูมิการตกผลึกต่ำสุด เนื้อหา กรดกำมะถัน ค. ในเทคโนโลยี เกรด (%): ทาวเวอร์ (ไนตรัส) 75, ติดต่อ 92.5-98.0, oleum 104.5, oleum เปอร์เซ็นต์สูง 114.6, แบตเตอรี่ 92-94 กรดซัลฟูริกถูกเก็บไว้ในถังเหล็กที่มีปริมาตรสูงสุด 5,000 ม. 3 ความจุทั้งหมดในคลังสินค้าได้รับการออกแบบสำหรับการผลิตสิบวัน Oleum และ SULFURIC ACID ถูกขนส่งในถังเหล็กรางรถไฟ คอนซี และแบตเตอรี่ SULFURIC ACID ถึง ถูกขนส่งในถังเหล็กทนกรด ถังสำหรับการขนส่งโอเลี่ยมถูกหุ้มด้วยฉนวนกันความร้อน และน้ำมันจะถูกทำให้ร้อนก่อนเติม
กรดซัลฟิวริกถูกกำหนดโดย colorimetrically และ photometrically ในรูปแบบของสารแขวนลอยของ BaSO 4 - phototurbidimetrically เช่นเดียวกับ coulometrically กระบวนการ.
แอปพลิเคชัน. กรดซัลฟูริกใช้ในการผลิตปุ๋ยแร่ เป็นอิเล็กโทรไลต์ในแบตเตอรี่ตะกั่ว สำหรับการผลิตกรดและเกลือแร่ต่างๆ เส้นใยเคมี สีย้อม สารที่ก่อให้เกิดควันและวัตถุระเบิด ในน้ำมัน งานโลหะ สิ่งทอ หนัง และอุตสาหกรรมอื่นๆ ใช้ในงานเลี้ยง การสังเคราะห์สารอินทรีย์ในปฏิกิริยาการคายน้ำ (การได้รับไดเอทิลอีเทอร์, เอสเทอร์), ความชุ่มชื้น (เอธานอลจากเอทิลีน), ซัลโฟเนชัน (สารซักฟอกสังเคราะห์และผลิตภัณฑ์ขั้นกลางในการผลิตสีย้อม), อัลคิเลชัน (การได้รับไอโซคเทน, โพลีเอทิลีนไกลคอล, คาโปรแลคแทม) เป็นต้น ผู้บริโภครายใหญ่ที่สุดของกรดซัลฟูริกคือการผลิตปุ๋ยแร่ สำหรับปุ๋ยฟอสฟอรัส P 2 O 5 1 ตัน จะมีการใช้กรดซัลฟิวริก 2.2-3.4 ตัน และสำหรับกรดซัลฟิวริก 1 ตัน (NH 4) 2 SO 4 -0.75 ตัน ดังนั้นพืชกรดซัลฟิวริกจึงมีแนวโน้มที่จะสร้าง ซับซ้อนกับโรงงานเพื่อผลิตปุ๋ยแร่ การผลิตกรดซัลฟิวริกของโลกในปี 2530 มีจำนวนถึง 152 ล้านตัน
กรดกำมะถันและโอเลี่ยมเป็นสารที่มีฤทธิ์รุนแรงมากที่ส่งผลต่อระบบทางเดินหายใจ ผิวหนัง เยื่อเมือก ทำให้หายใจลำบาก ไอ มักเป็นโรคกล่องเสียงอักเสบ หลอดลมอักเสบ หลอดลมอักเสบ ฯลฯ MAC aerosol กรดซัลฟิวริกกรดในอากาศของพื้นที่ทำงาน 1, 0 มก. / ม. 3 ในตู้เอทีเอ็ม อากาศ 0.3 มก. / ม. 3 (สูงสุดเดี่ยว) และ 0.1 มก. / ม. 3 (เฉลี่ยต่อวัน) ความเข้มข้นที่เป็นอันตรายของไอระเหยของกรดซัลฟิวริกคือ 0.008 มก. / ล. (สัมผัส 60 นาที) อันตรายถึงชีวิต 0.18 มก. / ล. (60 นาที) ระดับอันตราย 2 กรดซัลฟิวริกของละอองลอยสามารถเกิดขึ้นได้ในบรรยากาศอันเป็นผลมาจากการปล่อยสารเคมีและโลหะวิทยา อุตสาหกรรมที่มี S ออกไซด์และตกลงมาเป็นฝนกรด
วรรณคดี: คู่มือกรดกำมะถัน ed. ก.ม. มาลิน่า 2nd ed., M., 1971; Amelin A.G. เทคโนโลยีของกรดซัลฟิวริก 2nd ed., M. , 1983; Vasiliev B.T. , Otvagina M.I. , เทคโนโลยีของกรดซัลฟิวริก, M. , 1985. Yu.V. ฟิลาตอฟ.
สารานุกรมเคมี เล่ม 4 >>