อัลเคนโพแทสเซียมเปอร์แมงกาเนตในตัวกลางที่เป็นกรด ออกซิเดชันของสารประกอบอินทรีย์ประเภทต่างๆ
สถาบันเทคโนโลยีแห่งรัฐเซนต์ปีเตอร์สเบิร์ก
(มหาวิทยาลัยเทคนิค)
แผนก เคมีอินทรีย์คณะที่ 4
กลุ่ม 476
งานหลักสูตร
ออกซิเดชันของอัลคีน
นักเรียน………………………………………………………Rytina A.I.
อาจารย์………………………………... Piterskaya Yu.L.
เซนต์ปีเตอร์สเบิร์ก
การแนะนำ
1.Epoxidation (ปฏิกิริยาของ N.A. Prilezhaev, 1909)
2. ไฮดรอกซิเลชั่น
2.1ต่อต้าน-ไฮดรอกซิเลชัน
2.2ซิน-ไฮดรอกซิเลชัน
3. ความแตกแยกออกซิเดชันของอัลคีน
4.โอโซโนไลซิส
5. ออกซิเดชันของอัลคีนต่อหน้าเกลือแพลเลเดียม
บทสรุป
รายชื่อแหล่งที่มาที่ใช้
การแนะนำ
ออกซิเดชันเป็นหนึ่งในการเปลี่ยนแปลงที่สำคัญและพบบ่อยที่สุด สารประกอบอินทรีย์.
ในเคมีอินทรีย์ ออกซิเดชันหมายถึงกระบวนการที่นำไปสู่การสูญเสียสารประกอบในไฮโดรเจนหรือการเสริมสมรรถนะในออกซิเจน ในกรณีนี้อิเล็กตรอนจะถูกพรากไปจากโมเลกุล ดังนั้นการรีดักชั่นหมายถึงการแยกโมเลกุลออกซิเจนออกจากโมเลกุลอินทรีย์หรือการเติมไฮโดรเจนลงไป
ในปฏิกิริยารีดอกซ์ สารออกซิไดซ์เป็นสารประกอบที่มีความสัมพันธ์สูงกับอิเล็กตรอน (อิเล็กโทรฟิล) และสารรีดิวซ์เป็นสารประกอบที่มีแนวโน้มที่จะบริจาคอิเล็กตรอน (นิวคลีโอไทล์) ความง่ายของการเกิดออกซิเดชันของสารประกอบจะเพิ่มขึ้นตามนิวคลีโอฟิลิกของมัน
ตามกฎแล้วในระหว่างการออกซิเดชั่นของสารประกอบอินทรีย์จะไม่มีการถ่ายโอนอิเล็กตรอนโดยสมบูรณ์ดังนั้นจึงไม่มีการเปลี่ยนแปลงความจุของอะตอมคาร์บอน ดังนั้นแนวคิดของสถานะออกซิเดชัน - ประจุตามเงื่อนไขของอะตอมในโมเลกุลซึ่งคำนวณตามสมมติฐานที่ว่าโมเลกุลประกอบด้วยไอออนเท่านั้น - เป็นเพียงเงื่อนไขและเป็นทางการในธรรมชาติเท่านั้น
เมื่อเขียนสมการสำหรับปฏิกิริยารีดอกซ์ จำเป็นต้องหาตัวรีดิวซ์ ตัวออกซิไดซ์ และจำนวนอิเล็กตรอนที่ให้และรับ ตามกฎแล้ว ค่าสัมประสิทธิ์จะถูกเลือกโดยใช้วิธีสมดุลอิเล็กตรอน-ไอออน (วิธีครึ่งปฏิกิริยา)
วิธีนี้จะพิจารณาการถ่ายโอนอิเล็กตรอนจากอะตอมหรือไอออนหนึ่งไปยังอีกอะตอมหนึ่ง โดยคำนึงถึงธรรมชาติของตัวกลาง (กรด ด่าง หรือเป็นกลาง) ที่เกิดปฏิกิริยา ในการทำให้จำนวนอะตอมออกซิเจนและไฮโดรเจนเท่ากัน จะมีการแนะนำโมเลกุลของน้ำและโปรตอน (หากตัวกลางมีสภาพเป็นกรด) หรือโมเลกุลของน้ำและไอออนไฮดรอกไซด์ (หากตัวกลางนั้นเป็นด่าง)
ดังนั้น เมื่อเขียนปฏิกิริยาครึ่งปฏิกิริยารีดักชันและออกซิเดชัน เราจะต้องเริ่มจากองค์ประกอบของไอออนที่มีอยู่ในสารละลายจริงๆ สารที่แยกตัวได้ไม่ดี ละลายได้ไม่ดี หรือถูกปล่อยออกมาในรูปของก๊าซ ควรเขียนให้อยู่ในรูปโมเลกุล
ตัวอย่างเช่น พิจารณากระบวนการออกซิเดชันของเอทิลีนด้วยสารละลายน้ำเจือจางของโพแทสเซียมเปอร์แมงกาเนต (ปฏิกิริยาวากเนอร์) ในระหว่างปฏิกิริยานี้ เอทิลีนจะถูกออกซิไดซ์เป็นเอทิลีนไกลคอล และโพแทสเซียมเปอร์แมงกาเนตจะลดลงเป็นแมงกานีสไดออกไซด์ เติมไฮดรอกซิล 1 สองตัวที่บริเวณที่เกิดพันธะคู่:
3C 2 H 4 + 2KMnO 4 +4H 2 O→ 3C 2 H 6 O 2 + 2MnO 2 +2KOH
ครึ่งปฏิกิริยาลดลง: MnO 4 เลเซอร์ + 2H 2 O + 3 จ → MnO 2 + 4OH เลเยอร์ 2
ปฏิกิริยาออกซิเดชั่นครึ่งปฏิกิริยา: C 2 H 4 + 2OH - − 2 จ → C2H6O23
ในที่สุดเราก็มีรูปแบบไอออนิก:
2MnO 4 Â + 4H 2 O + 3C 2 H 4 + 6OH Â → 2MnO 2 + 8OH Â + 3C 2 H 6 O 2
หลังจากลดเงื่อนไขที่คล้ายกันที่จำเป็นแล้ว เราก็เขียนสมการในรูปแบบโมเลกุล:
3C 2 H 4 + 2KMnO 4 + 4 H 2 O = 3C 2 H 6 O 2 + 2MnO 2 + 2KOH
ลักษณะของตัวออกซิไดซ์บางชนิด
ออกซิเจน
ออกซิเจนในอากาศถูกนำมาใช้กันอย่างแพร่หลายในกระบวนการทางเทคโนโลยี เนื่องจากเป็นสารออกซิไดซ์ที่ถูกที่สุด แต่การออกซิเดชั่นโดยออกซิเจนในบรรยากาศนั้นเต็มไปด้วยปัญหาที่เกี่ยวข้องกับการควบคุมกระบวนการซึ่งเกิดขึ้นในทิศทางต่างๆ โดยปกติการออกซิเดชั่นจะดำเนินการที่ อุณหภูมิสูงต่อหน้าตัวเร่งปฏิกิริยา
โอโซน
โอโซน O 3 ใช้ในการผลิตอัลดีไฮด์และคีโตนหากหาได้ยากด้วยวิธีอื่น ส่วนใหญ่มักใช้โอโซนเพื่อกำหนดโครงสร้างของสารประกอบไม่อิ่มตัว โอโซนเกิดจากการกระทำของการปล่อยกระแสไฟฟ้าอย่างเงียบ ๆ กับออกซิเจน ข้อดีอย่างหนึ่งที่สำคัญของโอโซนเมื่อเปรียบเทียบกับคลอรีนคือการไม่มีสารพิษหลังการบำบัด 2
ด่างทับทิม
โพแทสเซียมเปอร์แมงกาเนตเป็นสารออกซิไดซ์ที่ใช้กันมากที่สุด รีเอเจนต์สามารถละลายได้ในน้ำ (6.0% ที่ 20°С) เช่นเดียวกับในเมทานอล อะซิโตน และกรดอะซิติก สำหรับการเกิดออกซิเดชัน สารละลายน้ำ (บางครั้งอะซิโตน) ของ KMnO 4 จะถูกนำมาใช้ในสภาพแวดล้อมที่เป็นกลาง เป็นกรด หรือเป็นด่าง เมื่อดำเนินการตามกระบวนการแล้ว สภาพแวดล้อมที่เป็นกลางเกลือแมกนีเซียมและอลูมิเนียมจะถูกเติมลงในมวลปฏิกิริยา หรือคาร์บอนไดออกไซด์ถูกส่งผ่านเพื่อทำให้โพแทสเซียมไฮดรอกไซด์ที่ปล่อยออกมาเป็นกลางระหว่างปฏิกิริยา ปฏิกิริยาออกซิเดชันของ KMnO 4 ในสภาพแวดล้อมที่เป็นกรดมักเกิดขึ้นเมื่อมีกรดซัลฟิวริก สภาพแวดล้อมที่เป็นด่างในระหว่างการออกซิเดชันจะถูกสร้างขึ้นโดย KOH ที่เกิดขึ้นระหว่างการทำปฏิกิริยา หรือถูกเติมเข้าไปในมวลปฏิกิริยาตั้งแต่แรก ในสภาพแวดล้อมที่เป็นด่างและเป็นกลางเล็กน้อย KMnO 4 จะออกซิไดซ์ตามสมการ:
KMnO4+ 3 จ+ 2H 2 O = K + + MnO 2 + 4OH เลเยอร์
ในสภาพแวดล้อมที่เป็นกรด:
KMnO4+ 5 จ+ 8H + = K + + Mn 2+ + 4H 2 O 3
โพแทสเซียมเปอร์แมงกาเนตใช้เพื่อให้ได้ 1,2-ไดออลจากอัลคีนในการออกซิเดชันของแอลกอฮอล์ปฐมภูมิ อัลดีไฮด์ และอัลคิลารีนไปจนถึงกรดคาร์บอกซิลิก เช่นเดียวกับการแตกแยกออกซิเดชันของโครงกระดูกคาร์บอนที่พันธะหลาย ๆ
ในทางปฏิบัติ มักจะใช้ KMnO 4 ส่วนเกินที่ค่อนข้างใหญ่ (มากกว่า 100%) สิ่งนี้อธิบายได้จากข้อเท็จจริงที่ว่าภายใต้สภาวะปกติ KMnO 4 จะสลายตัวเป็นแมงกานีสไดออกไซด์บางส่วนโดยปล่อย O 2 . สลายตัวระเบิดได้ด้วยความเข้มข้น H 2 SO 4 เมื่อถูกความร้อนต่อหน้าสารรีดิวซ์ ส่วนผสมของโพแทสเซียมเปอร์แมงกาเนตกับสารอินทรีย์ก็ระเบิดได้เช่นกัน 4
เพราซิด
กรดเปอร์อะซิติกและกรดเพอร์ซิติกถูกเตรียมโดยการทำปฏิกิริยาไฮโดรเจนเปอร์ออกไซด์ 25-90% กับกรดคาร์บอกซิลิกที่สอดคล้องกันตามปฏิกิริยาต่อไปนี้:
RCOOH + H 2 O 2 = RCOOOH + H 2 O
ในกรณีของกรดอะซิติก ความสมดุลนี้จะถูกสร้างขึ้นค่อนข้างช้า และเพื่อเร่งการก่อตัวของเพราซิด กรดซัลฟิวริกมักจะถูกเติมเป็นตัวเร่งปฏิกิริยา กรดฟอร์มิกมีความแข็งแรงเพียงพอในตัวเองเพื่อให้เกิดความสมดุลอย่างรวดเร็ว
กรดเปอร์ไตรฟลูออโรอะซิติกที่ได้จากการผสมกับกรดไตรฟลูออโรอะซิติกโดยปฏิกิริยาของไตรฟลูออโรอะซิติกแอนไฮไดรด์กับไฮโดรเจนเปอร์ออกไซด์ 90% จะเป็นสารออกซิไดซ์ที่แรงยิ่งขึ้นไปอีก กรดเปอร์อะซิติกสามารถเตรียมได้ในลักษณะเดียวกันจากอะซิติกแอนไฮไดรด์และไฮโดรเจนเปอร์ออกไซด์
โดยเฉพาะความนิยมเป็นเรื่องยาก ม-กรดคลอโรเปอร์เบนโซอิกเนื่องจากค่อนข้างปลอดภัยในการจัดการ ค่อนข้างเสถียรและสามารถเก็บไว้ได้นาน
ออกซิเดชันเกิดขึ้นเนื่องจากการปล่อยอะตอมออกซิเจน:
RCOOOH = RCOOH + [O]
Peracids ใช้เพื่อให้ได้อีพอกไซด์จากอัลคีน เช่นเดียวกับแลคโตนจากคีโตนอะลิไซคลิก
ไฮโดรเจนเปอร์ออกไซด์
ไฮโดรเจนเปอร์ออกไซด์เป็นของเหลวไม่มีสีที่ผสมกับน้ำ เอทานอล และไดเอทิลอีเทอร์ สารละลาย 30% ของ H 2 O 2 เรียกว่าเปอร์ไฮโดรล ยาที่มีความเข้มข้นสูงอาจทำปฏิกิริยาระเบิดกับสารอินทรีย์ได้ ในระหว่างการเก็บรักษาจะสลายตัวเป็นออกซิเจนและน้ำ ความคงตัวของไฮโดรเจนเปอร์ออกไซด์จะเพิ่มขึ้นตามการเจือจาง สำหรับการเกิดออกซิเดชันจะใช้สารละลายน้ำที่มีความเข้มข้นต่าง ๆ (ตั้งแต่ 3 ถึง 90%) ในตัวกลางที่เป็นกลางกรดหรือด่าง
เอช 2 โอ 2 = เอช 2 โอ + [O]
โดยการกระทำของรีเอเจนต์นี้กับสารประกอบคาร์บอนิลα,β-ไม่อิ่มตัวในตัวกลางที่เป็นอัลคาไลน์ จะได้อีพอกซีอัลดีไฮด์และคีโตนที่สอดคล้องกัน และเพราซิดถูกสังเคราะห์โดยปฏิกิริยาออกซิเดชันของกรดคาร์บอกซิลิกในตัวกลางที่เป็นกรด สารละลาย 30% ของ H 2 O 2 ในกรดอะซิติกออกซิไดซ์อัลคีนเป็น 1,2-diols ใช้ไฮโดรเจนเปอร์ออกไซด์: สำหรับการผลิตเปอร์ออกไซด์อินทรีย์และอนินทรีย์, เปอร์บอเรตและ Na เปอร์คาร์บอเนต; เป็นตัวออกซิไดซ์ในเชื้อเพลิงจรวด ในการผลิตอีพอกไซด์, ไฮโดรควิโนน, ไพโรคาเทชิน, เอทิลีนไกลคอล, กลีเซอรีน, เครื่องเร่งการหลอมโลหะของกลุ่มไธอูแรม ฯลฯ สำหรับฟอกน้ำมัน ไขมัน ขน หนัง วัสดุสิ่งทอ กระดาษ สำหรับการทำให้เจอร์เมเนียมและวัสดุเซมิคอนดักเตอร์ซิลิคอนบริสุทธิ์ เป็นยาฆ่าเชื้อเพื่อทำให้น้ำเสียในครัวเรือนและอุตสาหกรรมเป็นกลาง ในการแพทย์; เป็นแหล่งของ O 2 ในเรือดำน้ำ H 2 O 2 เป็นส่วนหนึ่งของรีเอเจนต์ของเฟนตัน (Fe 2 + + H 2 O 2) ซึ่งใช้เป็นแหล่งของอนุมูลอิสระ OH ในการสังเคราะห์สารอินทรีย์ 5
รูทีเนียมและออสเมียมเตตรอกไซด์
Osmium tetroxide OsO 4 เป็นผงสีขาวถึงสีเหลืองซีดที่มีค่า MP 40.6เซลเซียส; ที เบล 131.2เซลเซียส Sublime ที่อุณหภูมิห้อง ละลายในน้ำ (7.47 กรัมใน 100 มล. ที่ 25°С), CCl 4 (250 กรัมในตัวทำละลาย 100 กรัมที่ 20°С) เมื่อมีสารประกอบอินทรีย์จะเปลี่ยนเป็นสีดำเนื่องจากการลด OsO 2 6
RuO 4 เป็นปริซึมสีเหลืองทองที่มี MP 25.4°С ระเหิดได้อย่างเห็นได้ชัดที่อุณหภูมิห้อง ละลายได้ปานกลางในน้ำ (2.03 กรัมใน 100 มล. ที่ 20 องศาเซลเซียส) ละลายได้มากใน CCl 4 สารออกซิไดซ์ที่แรงกว่า OsO4 อุณหภูมิสูงกว่า 100°С มันจะระเบิด เช่นเดียวกับออสเมียมเตตรอกไซด์ มันมีพิษสูงและมีราคาแพง
สารออกซิไดซ์เหล่านี้ใช้สำหรับการเกิดออกซิเดชันของอัลคีนไปเป็น α-ไกลคอลภายใต้สภาวะที่ไม่รุนแรง
ไดออกซิเรน
ที่ใช้กันมากที่สุดคือ dimethyldioxirane และ methyl(trifluoromethyl)dioxirane

ไดออกซิเรนมักเตรียมไว้ ใน แหล่งกำเนิดจากคีโตนที่สอดคล้องกันและ KHSO 5 (หรือ K 2 SO 4 KHSO 4 2KHSO 5 (oxone)) ในตัวกลางที่เป็นด่างเล็กน้อย 7:
ไดออกซิเรนมีลักษณะเฉพาะคือการเกิดปฏิกิริยาสูง รวมกับความสามารถในการคัดเลือกที่ดี และใช้สำหรับการเกิดออกซิเดชันของพันธะ C-H ที่ไม่กระตุ้นในอัลเคน ในการเตรียมอีพอกไซด์จากอัลคีน สำหรับการเกิดออกซิเดชันของเอมีน ออกไซม ซัลไฟด์ ซัลฟอกไซด์ ฯลฯ .
ออกซิเดชันของอัลคีนสามารถเกิดขึ้นได้หลายทิศทาง:
1) ด้วยการเก็บรักษาโครงกระดูกคาร์บอนของโมเลกุล นี่คือวิธีที่อิพอกซิเดชันและไฮดรอกซิเลชันของพันธะคู่ดำเนินต่อไป ซึ่งนำไปสู่การก่อตัวของทรานส์หรือซิส-ไกลคอลในบริเวณใกล้เคียง
2) ด้วยการแตกของพันธะคู่; นี่คือวิธีที่โอโซโนไลซิสและการเกิดออกซิเดชันของอัลคีนหมดสิ้นดำเนินการ ซึ่งนำไปสู่การก่อตัวของสารประกอบคาร์บอนิลและกรดคาร์บอกซิลิกประเภทต่างๆ
ใช้สารออกซิไดซ์หลายชนิดขึ้นอยู่กับชนิดของออกซิเดชัน
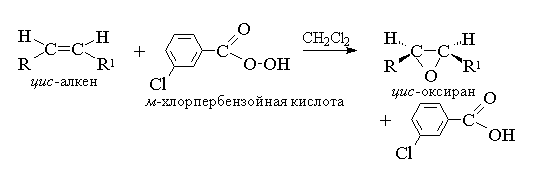
1. อิพอกซิเดชัน(ปฏิกิริยาของ N.A. Prilezhaev, 1909)
อัลคีนแบบอะไซคลิกและไซคลิก เมื่อทำปฏิกิริยากับเพราซิด (peracids) RCOOOH ในสภาพแวดล้อมที่ไม่มีขั้วและไม่แยแส จะก่อตัวเป็นอีพอกไซด์ (ออกซีเรน) ดังนั้นปฏิกิริยาในตัวเองจึงเรียกว่าปฏิกิริยาอิพอกซิเดชัน

ตามระบบการตั้งชื่อสมัยใหม่ ไอยูแพค- วงแหวนสามสมาชิกที่มีอะตอมออกซิเจนหนึ่งอะตอมเรียกว่าออกซิเรน
อิพอกซิเดชันของอัลคีนควรได้รับการพิจารณาว่าเป็นกระบวนการซิงโครนัสและประสานงานกัน โดยที่ตัวกลางไอออนิก เช่น ไฮดรอกซิลไอออนบวก OH+ ไม่เข้าร่วม กล่าวอีกนัยหนึ่ง อิพอกซิเดชันของอัลคีนเป็นกระบวนการ ซิน- การยึดอะตอมออกซิเจนหนึ่งอะตอมเข้ากับพันธะคู่โดยคงโครงสร้างขององค์ประกอบทดแทนไว้ที่พันธะคู่ไว้อย่างสมบูรณ์ 8

มีการเสนอลักษณะกลไกของกระบวนการที่ประสานกันสำหรับอิพอกซิเดชัน

เนื่องจากการโจมตีของพันธะคู่โดยอะตอมออกซิเจนของเพราซิดนั้นมีความเป็นไปได้เท่ากันบนทั้งสองด้านของระนาบพันธะคู่ ดังนั้นผลลัพธ์ของออกซิเรนจะเป็นอย่างใดอย่างหนึ่ง เมโส- รูปแบบหรือของผสมของอีแนนทิโอเมอร์ peracids ต่อไปนี้ถูกใช้เป็นสารอิพอกซิไดซ์: เปอร์เบนโซอิก, ม-คลอโรเปอร์เบนโซอิก, โมโนเพอร์ทาลิก, เปอร์อะซิติก, ไตรฟลูออโรเปติก และเพอร์ฟอร์มิก Peracids ของซีรีย์อะโรมาติกใช้ในรูปแบบของรีเอเจนต์แต่ละตัวในขณะที่ peracids ของซีรีย์อะลิฟาติก - CH 3 CO 3 H, CF 3 CO 3 H และ HCO 3 H ไม่ได้ถูกแยกออก แบบฟอร์มส่วนบุคคลและถูกใช้หลังจากการก่อรูปโดยปฏิกิริยาของไฮโดรเจนเปอร์ออกไซด์ 30% หรือ 90% และกรดคาร์บอกซิลิกที่เกี่ยวข้อง เปอร์เบนโซอินและ ม-กรดคลอโรเปอร์เบนโซอิกได้มาจากปฏิกิริยาออกซิเดชันของเบนโซอิกและ ม- กรดคลอโรเบนโซอิกที่มีไฮโดรเจนเปอร์ออกไซด์ 70% ในสารละลายของกรดมีเทนซัลโฟนิกหรือจากกรดคลอไรด์ของกรดเหล่านี้และไฮโดรเจนเปอร์ออกไซด์


กรดโมโนเพอร์ทาลิกได้มาจากวิธีการที่คล้ายกันจากทาทาลิกแอนไฮไดรด์และไฮโดรเจนเปอร์ออกไซด์ 30%

ปัจจุบันมีการใช้กรด monoperoxyphthalic ในรูปของเกลือ Mg อย่างกว้างขวาง
เริ่มแรก กรดเปอร์เบนโซอิกหรือโมโนเพอร์ทาลิก 10 ถูกนำมาใช้เพื่อให้ได้ออกซิเรน (อีพอกไซด์):

ปัจจุบันอีพอกซิเดชันที่ใช้กันมากที่สุดคือ ม-กรดคลอโรเปอร์เบนโซอิก ต่างจากเพราซิดชนิดอื่นๆ ตรงที่สามารถเก็บรักษาไว้ได้นาน (สูงสุด 1 ปี) และปลอดภัยอย่างยิ่งในการจัดการ อัตราผลตอบแทนของออกซิเรนที่ได้จากการออกซิเดชันของอัลคีนแบบอะไซคลิกและไซคลิก ม-กรดคลอโรเปอร์เบนโซอิกในสารละลายเมทิลีนคลอไรด์ คลอโรฟอร์ม หรือไดออกเซน มักจะค่อนข้างสูง 11



เปอร์ซิดมักถูกสร้างขึ้นโดยตรงในส่วนผสมที่ทำปฏิกิริยาของไฮโดรเจนเปอร์ออกไซด์ 90% และกรดคาร์บอกซิลิกในเมทิลีนคลอไรด์

อัลคีนที่มีพันธะคู่คอนจูเกตกับหมู่คาร์บอนิลหรือสารทดแทนตัวรับอื่นๆ จะไม่ทำงาน และสำหรับการเกิดออกซิเดชัน จะดีกว่าถ้าใช้สารออกซิไดซ์ที่แรงกว่า เช่น กรดไตรฟลูออโรเพอร์อะซิติก ที่ได้จากไตรฟลูออโรอะซิติกแอนไฮไดรด์และไฮโดรเจนเปอร์ออกไซด์ 90% ในเมทิลีนคลอไรด์ กรด Peroxycarboximidic RC(NH)OOH เป็นผลิตภัณฑ์ขั้นกลางที่ไม่เสถียรที่เกิดขึ้นในปฏิกิริยาของไนไตรล์ด้วยสารละลายอัลคาไลน์ของไฮโดรเจนเปอร์ออกไซด์ 12:
เอทิลีนออกไซด์ที่ง่ายที่สุดนั้นผลิตขึ้นทางอุตสาหกรรมโดยการออกซิเดชันของเอทิลีนกับออกซิเจนโดยมีเงินเป็นตัวเร่งปฏิกิริยา 13

2. ไฮดรอกซิเลชั่น
รู้จักรีเอเจนต์ออกซิไดซ์จำนวนหนึ่งด้วยความช่วยเหลือซึ่งภายใต้สภาวะที่ไม่รุนแรงจึงเป็นไปได้ที่จะเพิ่มกลุ่มไฮดรอกซิลสองกลุ่มลงในอัลคีน
ปฏิกิริยาไฮดรอกซิเลชันของอัลคีนซึ่งเกิดขึ้นภายใต้อิทธิพลของสารละลายเย็นของโพแทสเซียมเปอร์แมงกาเนตและมาพร้อมกับการเปลี่ยนสีเรียกว่าปฏิกิริยาวากเนอร์ (1888) ปัจจุบันมีการใช้สารสังเคราะห์เพียงเล็กน้อยเนื่องจากมีการก่อตัวของผลพลอยได้จำนวนมาก อย่างไรก็ตาม ปฏิกิริยานี้สามารถนำมาใช้เมื่อศึกษาโครงสร้างของสารประกอบอินทรีย์เป็นการทดสอบเชิงคุณภาพสำหรับพันธะคู่ ไฮดรอกซิเลชันของไซโคลเฮกซีนโดยการกระทำของสารละลายน้ำของโพแทสเซียมเปอร์แมงกาเนตในความเย็นดำเนินการครั้งแรกโดย V.V. มาร์คอฟนิคอฟ. ในปัจจุบัน ออสเมียม (VIII) ออกไซด์มักใช้สำหรับไฮดรอกซิเลชันของอัลคีน (ปฏิกิริยา Krige, 1936) 14.
Osmium tetroxide OsO 4 เป็นสารผลึกไม่มีสีที่ละลายที่ 40 o C และละลายได้ง่ายในอีเทอร์ เมื่อไซโคลเฮกซีนถูกออกซิไดซ์ด้วยสารละลายไม่มีตัวตนของรีเอเจนต์นี้ ตะกอนสีดำจะถูกปล่อยออกมาซึ่งเป็นไซคลิกเอสเตอร์ของกรดออสมิก I 15:
อีเทอร์เกิดขึ้นจากการเปิดพันธะคู่คาร์บอน-คาร์บอนของพันธะคู่อัลคีนและพันธะคู่ของโลหะออกไซด์ 2 ตัวพร้อมกัน จากนั้นเอสเทอร์นี้จะถูกไฮโดรไลซ์โดยใช้โซเดียมซัลไฟต์เป็นตัวเร่งปฏิกิริยา ผลิตภัณฑ์ไฮโดรไลซิสคือ cis-cyclohexanediol-1,2(II) ซึ่งมีไฮดรอกซิลอยู่ในบริเวณ β กล่าวคือ ด้านหน้าและไฮโดรเจนในภูมิภาคαเช่น ด้านหลัง.
2.1 ต่อต้าน-ไฮดรอกซิเลชัน
วงแหวนออกซีเรนที่มีสมาชิกสามส่วนเปิดออกได้ง่ายภายใต้อิทธิพลของรีเอเจนต์นิวคลีโอฟิลิกหลากหลายชนิด การไฮโดรไลซิสของออกซิเรนถูกเร่งด้วยทั้งกรดและเบส ในทั้งสองกรณี vicinal diols เช่น glycols จะเกิดขึ้น ในการเร่งปฏิกิริยาด้วยกรด ในระยะแรก อะตอมของออกซิเจนออกซีเรนจะถูกโปรตอนเพื่อสร้างไอออนบวกออกโซเนียมแบบไซคลิก ซึ่งเปิดขึ้นอันเป็นผลมาจากการโจมตีของนิวคลีโอฟิลิกของโมเลกุลน้ำ 16:

ขั้นตอนสำคัญในการเปิดวงแหวน ซึ่งเป็นตัวกำหนดอัตราของกระบวนการทั้งหมด คือการโจมตีของนิวคลีโอฟิลิกโดยน้ำบนรูปแบบของออกซีเรนที่ถูกโปรตอน ในทางกลไก กระบวนการนี้คล้ายกับการเปิดโบรโมเนียมไอออนจากการโจมตีของนิวคลีโอฟิลิกโดยโบรไมด์ไอออนหรือสารนิวคลีโอฟิลิกอื่นๆ จากตำแหน่งเหล่านี้ ผลลัพธ์ของสเตอริโอเคมีควรเป็นรูปแบบ ความมึนงง-ไกลคอลระหว่างการสลายตัวของไซคลิกอีพอกไซด์ แท้จริงแล้วในระหว่างการไฮโดรไลซิสที่เร่งปฏิกิริยาด้วยกรดของไซโคลเฮกซีนออกไซด์หรือไซโคลเพนทีนออกไซด์โดยเฉพาะ ความมึนงง-1,2-ไดออล
ดังนั้นกระบวนการสองขั้นตอนของอัลคีนอิพอกซิเดชันตามด้วยการไฮโดรไลซิสของกรดของอิพอกไซด์โดยรวมจึงสอดคล้องกับปฏิกิริยา ต่อต้าน- ไฮดรอกซิเลชันของอัลคีน
ทั้งสองขั้นตอน ต่อต้าน- ไฮดรอกซีเลชันของอัลคีนสามารถนำมารวมกันได้หากอัลคีนได้รับการบำบัดด้วยไฮโดรเจนเปอร์ออกไซด์ 30-70% ที่เป็นน้ำในกรดฟอร์มิกหรือกรดไตรฟลูออโรอะซิติก กรดทั้งสองชนิดนี้มีความแข็งแรงพอที่จะทำให้เกิดการเปิดของวงแหวนออกซีเรน

การเปิดวงแหวนออกซีเรนที่เป็นตัวเร่งปฏิกิริยายังทำให้เกิดการก่อตัวของไซคลิกด้วย ความมึนงง-ไกลคอล
ดังนั้นกระบวนการสองขั้นตอนของอิพอกซิเดชันของอัลคีนตามด้วยการไฮโดรไลซิสของอัลคาไลน์ของอีพอกไซด์ก็เป็นปฏิกิริยาเช่นกัน ต่อต้าน- ไฮดรอกซิเลชันของอัลคีน
2.2 ซิน-ไฮดรอกซิเลชัน
เกลือและออกไซด์บางชนิดของโลหะทรานซิชันในสถานะออกซิเดชันที่สูงกว่าคือรีเอเจนต์ที่มีประสิทธิภาพ ซิน- ไฮดรอกซิเลชันของพันธะคู่ของอัลคีน เมื่อเติมไฮดรอกซิลทั้งสองหมู่เข้าที่ด้านเดียวกันของพันธะคู่ การออกซิเดชันของอัลคีนกับโพแทสเซียมเปอร์แมงกาเนตเป็นหนึ่งในวิธีการที่เก่าแก่ที่สุด ซิน-ไฮดรอกซิเลชันของพันธะคู่ยังคงใช้กันอย่างแพร่หลายแม้ว่าจะมีข้อจำกัดโดยธรรมชาติก็ตาม ซิส-1,2-ไซโคลเฮกเซนไดออลได้รับครั้งแรกโดย V.V. Markovnikov ในปี พ.ศ. 2421 โดยไฮดรอกซิเลชันของไซโคลเฮกซีนด้วยสารละลายโพแทสเซียมเปอร์แมงกาเนตที่เป็นน้ำที่อุณหภูมิ 0 0 C

วิธีการนี้ได้รับการพัฒนาในภายหลังในผลงานของนักวิทยาศาสตร์ชาวรัสเซีย E.E. วากเนอร์ ดังนั้น ซิน-ไฮดรอกซิเลชันของอัลคีนภายใต้การกระทำของสารละลายน้ำของโพแทสเซียมเปอร์แมงกาเนตเรียกว่าปฏิกิริยาวากเนอร์ โพแทสเซียมเปอร์แมงกาเนตเป็นสารออกซิไดซ์ที่แรงซึ่งไม่เพียงแต่สามารถไฮดรอกซีเลตพันธะคู่เท่านั้น แต่ยังแยกไดออลที่เกิดขึ้นออกด้วย เพื่อหลีกเลี่ยงการเสื่อมสลายของไกลคอลเพิ่มเติมให้มากที่สุดเท่าที่จะเป็นไปได้ สภาวะของปฏิกิริยาจะต้องได้รับการควบคุมอย่างระมัดระวัง ผลผลิตของไกลคอลมักจะต่ำ (30-60%) ผลลัพธ์ที่ดีที่สุดทำได้โดยไฮดรอกซิเลชันของอัลคีนในสภาพแวดล้อมที่เป็นด่างเล็กน้อย (pH ~ 8 9) ที่ 0-5 0 C ด้วยสารละลายน้ำเจือจาง 1% ของ KMnO 4 17


ในขั้นแรก การออกซิเดชันของอัลคีนกับโพแทสเซียมเปอร์แมงกาเนตจะทำให้เกิดไซคลิกเอสเตอร์ของกรดแมงกานีส ซึ่งจะถูกไฮโดรไลซ์ทันทีเป็นไดออลใกล้เคียง

ไม่ได้แยกไซคลิกเอสเตอร์ของกรดแมงกานีสเป็นตัวกลาง แต่การก่อตัวของมันตามมาจากการทดลองที่มีป้ายกำกับว่า 18 O โพแทสเซียมเปอร์แมงกาเนต: อะตอมออกซิเจนทั้งสองในไกลคอลจะถูกติดฉลากระหว่างการเกิดออกซิเดชันของอัลคีน KMn 18 O 4 ซึ่งหมายความว่าอะตอมออกซิเจนทั้งสองถูกถ่ายโอนจากตัวออกซิไดซ์และไม่ได้มาจากตัวทำละลาย - น้ำซึ่งสอดคล้องกับกลไกที่นำเสนอ
อีกวิธีหนึ่ง ซิน- ไฮดรอกซิเลชันของอัลคีนภายใต้อิทธิพลของออสเมียม (VIII) ออกไซด์ OsO 4 ถูกเสนอโดย R. Kriege ในปี 1936 ออสเมียมเตตรอกไซด์เป็นสารผลึกไม่มีสี ระเหยง่าย ละลายได้ดีในอีเทอร์ ไดออกเซน ไพริดีน และตัวทำละลายอินทรีย์อื่นๆ เมื่อออสเมียมเตตรอกไซด์ทำปฏิกิริยากับอัลคีนในอีเทอร์หรือไดออกเซน จะเกิดการตกตะกอนสีดำของเอสเทอร์ของกรดออสมิกแบบไซคลิก - ออสเมต ซึ่งสามารถแยกออกได้ง่ายในแต่ละรูปแบบ การเติม OsO 4 ลงในพันธะคู่จะถูกเร่งอย่างเห็นได้ชัดในสารละลายในไพริดีน การสลายตัวของออสเมตไปเป็นไกลคอลในบริเวณใกล้เคียงทำได้โดยการกระทำของสารละลายในน้ำของโซเดียมไฮโดรซัลไฟต์หรือไฮโดรเจนซัลไฟด์

ผลผลิตของผลิตภัณฑ์ ซิน- ไฮดรอกซิเลชันของอัลคีนในวิธีนี้สูงกว่าเมื่อใช้เปอร์แมงกาเนตเป็นสารออกซิไดซ์อย่างมีนัยสำคัญ ข้อได้เปรียบที่สำคัญของวิธี Krige คือการไม่มีผลิตภัณฑ์ที่มีความแตกแยกออกซิเดชันของอัลคีนซึ่งเป็นลักษณะของการเกิดออกซิเดชันของเปอร์แมงกาเนต 18
 19
19

ออสเมียมเตตรอกไซด์เป็นสารเคมีที่มีราคาแพงมากและหาซื้อได้ยาก และยังเป็นพิษอีกด้วย ดังนั้นจึงใช้ออสเมียม (VIII) ออกไซด์ในการสังเคราะห์สารที่เข้าถึงยากในปริมาณเล็กน้อยเพื่อให้ได้ไดออลผลผลิตสูงสุด เพื่อให้ง่ายขึ้น ซิน-ไฮดรอกซิเลชันของอัลคีนภายใต้อิทธิพลของ OsO 4 ซึ่งเป็นเทคนิคที่ได้รับการพัฒนาที่ช่วยให้สามารถใช้ตัวเร่งปฏิกิริยาในปริมาณตัวเร่งปฏิกิริยาของรีเอเจนต์นี้เท่านั้น ไฮดรอกซิเลชันของอัลคีนดำเนินการโดยใช้ไฮโดรเจนเปอร์ออกไซด์ต่อหน้า OsO 4 ตัวอย่างเช่น:

โดยสรุป เราสามารถให้ความสัมพันธ์สเตอริโอเคมีระหว่างอัลคีนได้ ถูกต้อง- หรือ ความมึนงง-การกำหนดค่าและการกำหนดค่าของ vicinal diol ที่เป็นผลลัพธ์ซึ่งสามารถเป็นได้ ถูกต้อง- หรือ ความมึนงง-ไอโซเมอร์ เม็ดเลือดแดง- หรือ ทรีโอ-รูปร่าง, เมโส- หรือ ดี,แอล-รูปแบบขึ้นอยู่กับองค์ประกอบทดแทนในแอลคีน 20:

ความสัมพันธ์ทางสเตอริโอเคมีที่คล้ายกันจะสังเกตได้ในปฏิกิริยาอื่นๆ ซิน- หรือ ต่อต้าน- การเติมพันธะหลายพันธะของไฮโดรเจน ไฮโดรเจนเฮไลด์ น้ำ ฮาโลเจน โบรอนไฮไดรด์ และรีเอเจนต์อื่นๆ
3. ความแตกแยกออกซิเดชันอัลคีน
ในระหว่างการออกซิเดชันของอัลคีนด้วยสารละลายน้ำอัลคาไลน์ของโพแทสเซียมเปอร์แมงกาเนตเมื่อถูกความร้อนหรือด้วยสารละลาย KMnO 4 ในกรดซัลฟิวริกในน้ำรวมถึงในระหว่างการออกซิเดชันของอัลคีนด้วยสารละลายโครเมียม (VI) ออกไซด์ CrO 3 ในกรดอะซิติกหรือ โพแทสเซียมไดโครเมตและกรดซัลฟิวริกซึ่งเป็นไกลคอลที่เกิดขึ้นในช่วงแรกจะถูกทำลายโดยออกซิเดชั่น ผลลัพธ์สุดท้ายคือความแตกแยกของโครงกระดูกคาร์บอนบริเวณที่เกิดพันธะคู่และการก่อตัวของคีโตนและ/หรือกรดคาร์บอกซิลิกเป็นผลิตภัณฑ์ขั้นสุดท้าย ขึ้นอยู่กับองค์ประกอบทดแทนบนพันธะคู่ หากอะตอมของคาร์บอนทั้งสองอะตอมที่พันธะคู่มีหมู่อัลคิลเพียงกลุ่มเดียว ผลลัพธ์สุดท้ายของการเกิดออกซิเดชันแบบหมดจดจะเป็นส่วนผสมของกรดคาร์บอกซิลิก ส่วนอัลคีนเตตร้าที่ถูกแทนที่ที่พันธะคู่จะถูกออกซิไดซ์เป็นคีโตนสองตัว อัลคีนที่ถูกทดแทนเดี่ยวด้วยพันธะคู่ที่ปลายถูกตัดแยกเป็นกรดคาร์บอกซิลิกและคาร์บอนไดออกไซด์ 21

 22
22
เนื่องจากกรดคาร์บอกซิลิกและคีโตนให้ผลผลิตต่ำ ปฏิกิริยาออกซิเดชันแบบละเอียดถี่ถ้วนของอัลคีนในเวอร์ชันคลาสสิกจึงไม่พบการใช้งานในวงกว้าง และก่อนหน้านี้ใช้เพื่อกำหนดโครงสร้างของอัลคีนเริ่มต้นจากผลออกซิเดชันแบบทำลายล้างเป็นหลัก ในปัจจุบัน ออกซิเดชันของอัลคีน (R-CH=CH-R และ R-CH=CH 2) กับกรดคาร์บอกซิลิก (RCOOH) โดยใช้โพแทสเซียมเปอร์แมงกาเนตหรือไดโครเมตดำเนินการภายใต้การเร่งปฏิกิริยาด้วยการถ่ายโอนเฟส ผลผลิตของกรดคาร์บอกซิลิกเกิน 90%

4. โอโซโนไลซิสของอัลคีน
ปฏิกิริยาของอัลคีนกับโอโซนเป็นวิธีการที่สำคัญที่สุดสำหรับการแยกออกซิเดชันของอัลคีนที่พันธะคู่ เป็นเวลาหลายทศวรรษแล้วที่ปฏิกิริยานี้เป็นวิธีการหลักในการกำหนดโครงสร้างของไฮโดรคาร์บอนเริ่มต้น และยังพบว่าใช้ในการสังเคราะห์สารประกอบคาร์บอนิลต่างๆ ปฏิกิริยาของอัลคีนกับโอโซนทำได้โดยการผ่านกระแสประมาณ 5% ของส่วนผสมของโอโซนและออกซิเจนไปเป็นสารละลายของอัลคีนในเมทิลีนคลอไรด์หรือเอทิลอะซิเตตที่ -80 0 -100 0 C ความสมบูรณ์ของปฏิกิริยาคือ ควบคุมโดยการทดสอบโอโซนอิสระด้วยโพแทสเซียมไอโอไดด์ กลไกของปฏิกิริยาที่แปลกประหลาดและซับซ้อนนี้ก่อตั้งขึ้นโดยผลงานของ Krige เป็นหลัก ผลิตภัณฑ์แรกของไซโคล 1,3 ไดโพลาร์นอกเหนือจากพันธะคู่คือสิ่งที่เรียกว่าโมลิโอโซไนด์ (1,2,3-ไตรออกโซเลน) ผลิตภัณฑ์นี้ไม่เสถียรและสลายตัวเพิ่มเติมตามธรรมชาติเมื่อมีวงแหวนเปิดและเกิดโอโซไนด์ปกติ (1,2,4-ไตรออกโซเลน) 23 เป็นผลิตภัณฑ์ขั้นสุดท้าย
 24
24
เป็นที่ยอมรับกันโดยทั่วไปว่าการเปลี่ยนโมโลโซไนด์ไปเป็นโอโซไนด์ธรรมดาเกิดขึ้นผ่านกลไกการแยกตัวและการรวมตัวกันใหม่ โมโลโซไนด์เกิดขึ้นเองตามธรรมชาติของวงแหวน 1,2,3-ไตรออกโซเลนที่ไม่เสถียรเพื่อสร้างสารประกอบคาร์บอนิลและไอออนแบบไบโพลาร์ ซึ่งจากนั้นจะทำปฏิกิริยาซึ่งกันและกันตามรูปแบบการเติมไซโคลแอดดิชัน 1,3 ไดโพลาร์

รูปแบบข้างต้นสำหรับการจัดเรียงโมโลโซไนด์ใหม่ให้เป็นโอโซไนด์ปกติได้รับการยืนยันจากข้อเท็จจริงที่ว่าหากก่อนการก่อตัวของโอโซไนด์โดยสมบูรณ์ มีสารประกอบคาร์บอนิลอีกตัวอยู่ในส่วนผสมของปฏิกิริยาในฐานะ "ตัวสกัดกั้น" ของไอออนไบโพลาร์ ดังนั้น - เรียกว่า “โอโซไนด์ผสม” เกิดขึ้น ตัวอย่างเช่น ด้วยโอโซนิลไลเซชัน ถูกต้อง-stilbene เมื่อมีเบนซาลดีไฮด์ที่มีป้ายกำกับเป็นไอโซโทป 18 O ฉลากนี้เป็นส่วนหนึ่งของอีเทอร์แทนที่จะเป็นสะพานเปอร์ออกไซด์ของโอโซไนด์:
ผลลัพธ์นี้เป็นไปตามข้อตกลงที่ดีกับการก่อตัวของโอโซไนด์ผสมเมื่อรวมตัวกันใหม่ของไอออนไบโพลาร์ที่มีป้ายกำกับว่าเบนซาลดีไฮด์:

โอโซนเป็นสารประกอบที่ไม่เสถียรมากซึ่งจะสลายตัวแบบระเบิดได้ พวกมันไม่ได้แยกออกจากกัน แต่ถูกแยกย่อยตามการกระทำของผู้สำเร็จราชการแทนพระองค์ที่หลากหลาย จำเป็นต้องแยกแยะระหว่างความแตกแยกแบบรีดักทีฟและแบบออกซิเดชั่น ในระหว่างการไฮโดรไลซิส โอโซนจะค่อยๆ สลายตัวเป็นสารประกอบคาร์บอนิลและไฮโดรเจนเปอร์ออกไซด์ ไฮโดรเจนเปอร์ออกไซด์ออกซิไดซ์อัลดีไฮด์เป็นกรดคาร์บอกซิลิก นี่คือสิ่งที่เรียกว่าการสลายตัวแบบออกซิเดชันของโอโซน:

ดังนั้นในระหว่างการสลายตัวแบบออกซิเดชันของโอโซน กรดคาร์บอกซิลิกและ (หรือ) คีโตน ขึ้นอยู่กับโครงสร้างของแอลคีนเริ่มต้น ออกซิเจนในอากาศ ไฮโดรเจนเปอร์ออกไซด์ เปอร์แอซิด หรือซิลเวอร์ไฮดรอกไซด์สามารถใช้เป็นตัวออกซิไดซ์ได้ ในทางปฏิบัติในทางปฏิบัติมักใช้ไฮโดรเจนเปอร์ออกไซด์ในกรดอะซิติกหรือกรดฟอร์มิกรวมถึงไฮโดรเจนเปอร์ออกไซด์ในตัวกลางที่เป็นด่างเพื่อจุดประสงค์นี้


ในทางปฏิบัติ วิธีการสลายตัวแบบออกซิเดชันของโอโซนจะใช้เพื่อให้ได้กรดคาร์บอกซิลิกเป็นหลัก
ความแตกแยกที่ลดลงของโอโซนมีความสำคัญมากกว่า สารรีดิวซ์ที่ใช้กันมากที่สุดคือสังกะสีและกรดอะซิติก ไตรฟีนิลฟอสฟีน หรือไดเมทิลซัลไฟด์ ในกรณีนี้ ผลิตภัณฑ์สุดท้ายของโอโซโนไลซิสคืออัลดีไฮด์หรือคีโตน ขึ้นอยู่กับโครงสร้างของแอลคีนดั้งเดิม


 25
25
จากตัวอย่างข้างต้น เป็นที่แน่ชัดว่าอัลคีนเตตระแทนที่ด้วยพันธะคู่ในระหว่างการสลายโอโซโนไลซิสและการสลายตัวของโอโซไนด์แบบลดลงในเวลาต่อมาจะทำให้เกิดคีโตน 2 ตัว ในขณะที่อัลคีนที่มีไตรแทนที่จะให้คีโตนและอัลดีไฮด์ อัลคีนสมมาตรที่ถูกแทนที่จะผลิตอัลดีไฮด์สองตัวในระหว่างการสลายโอโซโนไลซิส และอัลคีนที่มีพันธะปลายจะเกิดเป็นอัลดีไฮด์และฟอร์มาลดีไฮด์
การปรับเปลี่ยนโอโซโนไลซิสที่น่าสนใจคือวิธีการที่ใช้โซเดียมโบโรไฮไดรด์เป็นตัวรีดิวซ์โอโซไนด์ ในกรณีนี้ ผลิตภัณฑ์ที่เกิดปฏิกิริยาขั้นสุดท้ายคือแอลกอฮอล์ปฐมภูมิหรือทุติยภูมิที่เกิดขึ้นระหว่างรีดิวซ์อัลดีไฮด์และเอ็กซ์โทน ตามลำดับ 26


โอโซโนไลซิสของอัลคีนเป็นกระบวนการที่ซับซ้อน ใช้แรงงานเข้มข้น และเกิดการระเบิดได้ ซึ่งต้องใช้อุปกรณ์พิเศษ ด้วยเหตุนี้ จึงมีการพัฒนาวิธีการอื่นๆ สำหรับการแยกออกซิเดชันของอัลคีนไปเป็นสารประกอบคาร์บอนิลและกรดคาร์บอกซิลิก ซึ่งแทนที่ปฏิกิริยาโอโซโนไลซิสในการฝึกสังเคราะห์ได้สำเร็จ
หนึ่งในวิธีการเตรียมสมัยใหม่สำหรับการทำลายอัลคีนแบบออกซิเดชันถูกเสนอในปี 1955 โดย R. Lemieux วิธีการนี้มีพื้นฐานมาจากไฮดรอกซิเลชันของอัลคีนกับโพแทสเซียมเปอร์แมงกาเนต ตามด้วยการแยกไกลคอลของไกลคอลด้วยโซเดียมเปอเรตเอต NaIO 4 ที่ pH ~ 7 8 ตัวคาบหน่วยเองก็ไม่ทำปฏิกิริยากับอัลคีน ผลิตภัณฑ์ของความแตกแยกออกซิเดชันสองขั้นตอนนี้คือคีโตนหรือกรดคาร์บอกซิลิก เนื่องจากอัลดีไฮด์ยังถูกออกซิไดซ์เป็นกรดคาร์บอกซิลิกภายใต้เงื่อนไขเหล่านี้ ในวิธีของ Lemieux ปัญหาที่ใช้เวลานานในการแยกหนึ่งในผลิตภัณฑ์ที่ทำปฏิกิริยา ซึ่งก็คือแมงกานีสไดออกไซด์ จะไม่เกิดขึ้น เนื่องจากทั้งไดออกไซด์และแมงกาเนตจะถูกออกซิไดซ์อีกครั้งโดยคาเรียเทตไปเป็นไอออนของเปอร์แมงกาเนต ซึ่งช่วยให้สามารถใช้โพแทสเซียมเปอร์แมงกาเนตในปริมาณตัวเร่งปฏิกิริยาเท่านั้น ด้านล่างนี้เป็นตัวอย่างทั่วไปบางส่วนของความแตกแยกออกซิเดชันของอัลคีนโดยใช้วิธี Lemieux

Citronellol ซึ่งเป็นแอลกอฮอล์ที่พบในน้ำมันดอกกุหลาบ น้ำมันเจอเรเนียม และน้ำมันเลมอน ถูกออกซิไดซ์โดยส่วนผสมของโพแทสเซียมเปอร์แมงกาเนตและโซเดียมเพอริเดตในอะซิโตนที่เป็นน้ำที่อุณหภูมิ 5–10 0 C ถึงกรด 6-ไฮดรอกซี-4-เมทิลเฮกเซนคาร์บอกซิลิกที่ให้ผลผลิตเชิงปริมาณ

ในรูปแบบอื่นของวิธีนี้ ปริมาณตัวเร่งปฏิกิริยาของออสเมียมเตตรอกไซด์จะถูกใช้แทนโพแทสเซียมเปอร์แมงกาเนต (Lemieux และ Johnson 1956) ข้อได้เปรียบพิเศษของการใช้ OsO 4 และ NaIO 4 ร่วมกันก็คือ ช่วยให้คุณสามารถหยุดการเกิดออกซิเดชันที่ระยะอัลดีไฮด์ได้ ออสเมียมเตตรอกไซด์จะเพิ่มพันธะคู่ของอัลคีนเพื่อสร้างออสเมต ซึ่งถูกออกซิไดซ์โดยโซเดียมเพอริเดตเป็นสารประกอบคาร์บอนิลเพื่อสร้างออสเมียมเตตรอกไซด์ขึ้นมาใหม่

แทนที่จะใช้ออสเมียมเตตรอกไซด์ สามารถใช้รูทีเนียมเตตรอกไซด์ RuO 4 ได้ การทำลายอัลคีนแบบออกซิเดชันตาม Lemieux-Johnson นำไปสู่ผลิตภัณฑ์เดียวกันกับโอโซโนไลซิสที่มีการแตกแยกโอโซไนด์ลดลง

ในแง่ของคุณลักษณะของเคมีอินทรีย์สมัยใหม่ หมายความว่า OsO 4 -NaIO 4 รวมกันคือ เทียบเท่าสังเคราะห์ปฏิกิริยาของโอโซโนไลซิสของอัลคีนตามด้วยความแตกแยกที่ลดลง ในทำนองเดียวกัน การออกซิเดชันของอัลคีนที่มีส่วนผสมของเปอร์แมงกาเนตและคาเรียเดตจะเทียบเท่ากับการสังเคราะห์ของโอโซโนไลซิสกับการสลายตัวของโอโซนแบบออกซิเดชัน
ดังนั้นการออกซิเดชันของอัลคีนจึงไม่ได้เป็นเพียงชุดวิธีการเตรียมสำหรับการเตรียมแอลกอฮอล์ อีพอกไซด์ ไดออล อัลดีไฮด์ คีโตน และกรดคาร์บอกซิลิกเท่านั้น แต่ยังเป็นวิธีหนึ่งที่เป็นไปได้ในการกำหนดโครงสร้างของอัลคีนดั้งเดิมอีกด้วย ดังนั้น ตามผลของการทำลายออกซิเดชันของอัลคีน จึงสามารถกำหนดตำแหน่งของพันธะคู่ในโมเลกุลได้ ในขณะที่ผลลัพธ์ทางสเตอริโอเคมี ซิน-หรือ ต่อต้านไฮดรอกซิเลชันของอัลคีนช่วยให้เราสามารถสรุปเกี่ยวกับเรขาคณิตของมันได้
5. ออกซิเดชันของอัลคีนต่อหน้าเกลือแพลเลเดียม
มีการวิจัยจำนวนมากที่เกี่ยวข้องกับการเกิดออกซิเดชันของอัลคีนกับสารประกอบคาร์บอนิลโดยใช้แพลเลเดียมคลอไรด์ สาเหตุหลักมาจากความสำคัญทางอุตสาหกรรมของปฏิกิริยาที่ผลิตอะซีตัลดีไฮด์จากเอทิลีน (กระบวนการของ Wacker) ในระหว่างการออกซิเดชัน แพลเลเดียมคลอไรด์จะลดลงเป็นแพลเลเดียม ซึ่งเป็นกระบวนการที่น่าสนใจอย่างจำกัด หากไม่ใช่เพราะความจริงที่ว่าแพลเลเดียมคลอไรด์ราคาแพงสามารถใช้ในปริมาณตัวเร่งปฏิกิริยาต่อหน้าสารออกซิไดซ์ตัวที่สอง ซึ่งส่วนใหญ่มักจะเป็นคอปเปอร์ (II) คลอไรด์ ซึ่งออกซิไดซ์แพลเลเดียมเป็นแพลเลเดียม (II) โดยตัวมันเองจะถูกรีดิวซ์เป็นทองแดง (I) ปฏิกิริยารีออกซิเดชั่นของทองแดง (I) ไปเป็นทองแดง (II) สามารถทำได้โดยใช้ออกซิเจนในบรรยากาศ ดังนั้น กระบวนการโดยรวมจึงน่าสนใจมากเช่นเดียวกับวิธีการออกซิเดชันทางอุตสาหกรรม 27.
เอทิลีนถูกออกซิไดซ์อย่างง่ายดายเป็นอะซีตัลดีไฮด์ 28:
กลไกที่เสนอ 29:
ปฏิกิริยานี้เกิดขึ้นในสภาพแวดล้อมที่เป็นกรด ซึ่งไม่ได้มาพร้อมกับการเปลี่ยนแปลงจำนวนอะตอมของคาร์บอนในโมเลกุลเอทิลีน และปัจจุบันเป็นแหล่งสำคัญของอะซีตัลดีไฮด์ในอุตสาหกรรม
ออกซิเดชันของเอทิลีนที่คล้ายคลึงกันภายใต้เงื่อนไขเดียวกันเกิดขึ้นที่อะตอมคาร์บอนที่เติมไฮโดรเจนน้อยที่สุดของพันธะคู่ด้วยการก่อตัวของคีโตน โดยเฉพาะอย่างยิ่งการออกซิเดชันของโพรพีนทำให้เกิดอะซิโตน และการเกิดออกซิเดชันของไซโคลเฮกซีนทำให้เกิดไซโคลเฮกซาโนน
บทสรุป
ปฏิกิริยาออกซิเดชันเป็นกลุ่มสำคัญของปฏิกิริยาพันธะคู่ โดยทั่วไป ปฏิกิริยาออกซิเดชันจะมีส่วนพิเศษในเคมีอินทรีย์ เมื่อพิจารณาปฏิกิริยาเหล่านี้ จำเป็นต้องคำนึงถึงไม่เพียงแต่ลักษณะของสารประกอบอินทรีย์ที่ถูกออกซิไดซ์เท่านั้น แต่ยังต้องคำนึงถึงลักษณะของตัวออกซิไดซ์ด้วย การมีอยู่หรือไม่มีตัวเร่งปฏิกิริยา สภาพแวดล้อมที่เกิดปฏิกิริยา ฯลฯ
ดังนั้นคุณจึงต้องจำสารออกซิไดซ์และเงื่อนไขในการใช้อยู่บ่อยครั้งเพื่อให้ได้ผลิตภัณฑ์ออกซิเดชันที่ต้องการ ตัวอย่างเช่น ปฏิกิริยาออกซิเดชันของอัลคีนกับสารละลายโพแทสเซียมเปอร์แมงกาเนตเจือจางทำให้เกิดไดออล (ไกลคอล) ในขณะที่สารละลายเข้มข้นของโพแทสเซียมเปอร์แมงกาเนตจะแตกโมเลกุลอัลคีนที่พันธะคู่ด้วยการก่อตัวของผลิตภัณฑ์ที่ประกอบด้วยออกซิเจน ดังนั้นสารออกซิไดซ์ชนิดเดียวกันในสภาพแวดล้อมที่ต่างกันจึงให้ผลิตภัณฑ์ออกซิเดชันต่างกัน
ในบรรดาปฏิกิริยาออกซิเดชัน ปฏิกิริยาโอโซนที่เราพิจารณาถือเป็นปฏิกิริยาที่สำคัญที่สุด ซึ่งทำให้เราสามารถกำหนดโครงสร้างของอัลคีนดั้งเดิมจากผลิตภัณฑ์ขั้นสุดท้ายได้ ในงานนี้ ได้มีการทบทวนปฏิกิริยาออกซิเดชันหลักของอัลคีนและตัวเร่งปฏิกิริยาที่ใช้ในระหว่างกระบวนการออกซิเดชัน
รายการแหล่งที่มาที่ใช้:
1) Reutov O. A. เคมีอินทรีย์ ใน 4 ส่วน 1.-ม.:บีนอม. ห้องปฏิบัติการความรู้, 2547.-567 น.
2) Remy G. หลักสูตรเคมีอนินทรีย์ ต. 1 ม.: สำนักพิมพ์วรรณกรรมต่างประเทศ พ.ศ. 2506 – 920 น.
3) Kazakov D.V., Voloshin A.I., Kazakov V.P., Shereshchovets V.V., Kabalnova N.N. เคมีและเคมีเรืองแสงของไดออกซิเรน อ.: เนากา, 2542
4) ทราเวน วี.เอฟ . เคมีอินทรีย์: ตำราเรียนสำหรับมหาวิทยาลัย: 2 เล่ม / V.F. Traven. - อ.: ICC "Akademkniga", 2547. - ต. 1
5) Haynes A. วิธีการออกซิเดชันของสารประกอบอินทรีย์ อัลเคน อัลคีน อัลไคน์ และอารีนส์ อ.: มีร์, 1988.
6) Morrison R., Boyd R. "เคมีอินทรีย์" M.: Mir, 1974
7) ชาบารอฟ ยู.เอส. “เคมีอินทรีย์” ตอนที่ 1 ม.: เคมี 2537
8) เปตรอฟ เอ.เอ., บัลยัน เอช.วี., ทรอชเชนโก้ เอ.ที. เคมีอินทรีย์: หนังสือเรียน ม.-5 ปรับปรุงใหม่ และเพิ่มเติม - เซนต์ปีเตอร์สเบิร์ก: “Ivan Fedorov”, 2002.-624 p.
9)ล. ไฟเซอร์, เอ็ม. เคมีอินทรีย์ของ Fizer หลักสูตรขั้นสูง เล่ม 1-ม. “เคมี”, 2512, 688 หน้า
10) พล็อตนิคอฟ วี.เอฟ., ปิเตอร์สกายา ยู.แอล. อัลคีเนส คู่มือการศึกษา - เซนต์ปีเตอร์สเบิร์ก: SPbGTI (TU) - 2003 - 20 น.
11) Neyland O. Ya บทที่ II อัลคีเนส // เคมีอินทรีย์: หนังสือเรียน. สำหรับเคมี มหาวิทยาลัย - อ.: “อุดมศึกษา”, 2533.
12) มีนาคม ดี. เคมีอินทรีย์: ใน 4 เล่ม/ทรานส์ จากภาษาอังกฤษ – อ.: มีร์, 1987. – ต. 4. 470 น.
13) Terney A. เคมีอินทรีย์สมัยใหม่: ใน 2 เล่ม - M.: Mir, 1981.
14) Hauptmann Z., Graefe Y., Remane H. “เคมีอินทรีย์” M.: เคมี, 1979
15) ดยุก V.G., Malinovsky M.S. "หลักสูตรเคมีอินทรีย์" เคียฟ: โรงเรียนวิชชา 2530
16) http://www.chemistry.ssu.samara.ru/chem2/u442.htm
17) http://www.xumuk.ru/
1 เปตรอฟ เอ.เอ., บัลยัน เอช.วี., ทรอชเชนโก้ เอ.ที.
เคมีอินทรีย์: หนังสือเรียนมหาวิทยาลัย หน้า 85 26 26 ทราเวน
บทคัดย่อ >> เคมี CH2 + 3O2 2CO2 + 2H2O b) เมื่อใด ออกซิเดชันอัลคีน CH2 + 3O2 2CO2 + 2H2O b) เมื่อใด ออกซิเดชันสารละลายเจือจางของโพแทสเซียมเปอร์แมงกาเนตจะเกิดขึ้น... บนพันธะคู่ c) เมื่อยาก
สารละลายโพแทสเซียมเปอร์แมงกาเนตเดือดในสภาวะที่เป็นกรด
ทฤษฎีเคมีทั่วไปพร้อมองค์ประกอบวิธีการสอนแผ่นโกง >> เคมี วิธีการผลิตสารประกอบคาร์บอนิล -ออกซิเดชัน แอลกอฮอล์ เป็นตัวออกซิไดซ์... ให้ผลผลิต ~90%) 5. ออกซิเดชันออกซิเดชัน - ได้รับอัลดีไฮด์และคีโตนออกซิเดชัน ไฮโดรคาร์บอนของกลุ่มเอทิลีน...ไม่ให้น้ำ 7. ปฏิกิริยาออกซิเดชัน
- อัลดีไฮด์และคีโตน...
26 26 ทราเวนออกซิเรน (อีพอกไซด์) แอลกอฮอล์ เป็นตัวออกซิไดซ์... ให้ผลผลิต ~90%) 5. ออกซิเดชันเพราซิด วิธีที่นิยมใช้กันมากที่สุด... 1,2-epoxycyclo-m-chlorobenzoic acid hexane acid แอลกอฮอล์ เป็นตัวออกซิไดซ์... ให้ผลผลิต ~90%) 5. ออกซิเดชัน peracids อินทรีย์จะมาพร้อมกับการเติมออกซิเจน...
ข้อมูลทั่วไปเกี่ยวกับแอลกอฮอล์ โพลีออล
26 26 ทราเวน...) สามารถรับได้ - ได้รับอัลดีไฮด์และคีโตน ออกซิเดชันโพแทสเซียมเปอร์แมงกาเนต หรือ เตโทรออกไซด์... . อธิบายกลไกการเกิดปฏิกิริยา แอลกอฮอล์ เป็นตัวออกซิไดซ์... ให้ผลผลิต ~90%) 5.โพลีออล แอลกอฮอล์ เป็นตัวออกซิไดซ์... ให้ผลผลิต ~90%) 5.เอทิลีนไกลคอลดำเนินการแตกต่างกัน ... กลไก: (m 21) ช่วงเวลา วิธีการผลิตสารประกอบคาร์บอนิล -กลีเซอรอลทำให้เกิดฟอร์มาลดีไฮด์...
เนื้อหานี้อาจเป็นเรื่องยากที่จะเชี่ยวชาญด้วยตัวเองเนื่องจากมีข้อมูลจำนวนมาก ความแตกต่างมากมาย และ BUT และ IF ทุกประเภท อ่านอย่างระมัดระวัง!
เราจะพูดถึงอะไรกันแน่?
นอกเหนือจากการเกิดออกซิเดชันโดยสมบูรณ์ (การเผาไหม้) สารประกอบอินทรีย์บางประเภทยังมีลักษณะเฉพาะด้วยปฏิกิริยาออกซิเดชันที่ไม่สมบูรณ์ ซึ่งจะถูกแปลงเป็นประเภทอื่น
มีสารออกซิไดซ์เฉพาะสำหรับแต่ละประเภท: CuO (สำหรับแอลกอฮอล์), Cu(OH) 2 และ OH (สำหรับอัลดีไฮด์) และอื่นๆ
แต่มีสารออกซิไดซ์แบบคลาสสิกสองตัวที่พูดแล้วเป็นสากลสำหรับหลายคลาส
นี่คือโพแทสเซียมเปอร์แมงกาเนต - KMnO 4 และโพแทสเซียม ไบโครเมต (ไดโครเมต) – K 2 Cr 2 O 7 . สารเหล่านี้เป็นสารออกซิไดซ์ที่แรงเนื่องจากแมงกานีสอยู่ในสถานะออกซิเดชัน +7 และโครเมียมในสถานะออกซิเดชัน +6 ตามลำดับ
ปฏิกิริยากับสารออกซิไดซ์เหล่านี้เกิดขึ้นค่อนข้างบ่อย แต่ไม่มีคำแนะนำที่ครอบคลุมเกี่ยวกับหลักการในการเลือกผลิตภัณฑ์ของปฏิกิริยาดังกล่าว
ในทางปฏิบัติ มีปัจจัยหลายประการที่มีอิทธิพลต่อการเกิดปฏิกิริยา (อุณหภูมิ สภาพแวดล้อม ความเข้มข้นของรีเอเจนต์ ฯลฯ) บ่อยครั้งผลลัพธ์ที่ได้คือส่วนผสมของผลิตภัณฑ์ ดังนั้นจึงแทบเป็นไปไม่ได้เลยที่จะคาดเดาผลิตภัณฑ์ที่จะเกิดขึ้น
แต่สิ่งนี้ไม่เหมาะสำหรับการสอบ Unified State: คุณไม่สามารถเขียนที่นั่นว่า "อาจเป็นสิ่งนี้ หรือสิ่งนี้ หรือสิ่งนั้น หรือส่วนผสมของผลิตภัณฑ์" จำเป็นต้องมีข้อมูลเฉพาะเจาะจง
ผู้เขียนงานมอบหมายให้ใช้ตรรกะบางอย่าง ซึ่งเป็นหลักการที่แน่นอนตามที่ควรจะเขียนผลิตภัณฑ์บางอย่าง น่าเสียดายที่พวกเขาไม่ได้แบ่งปันกับใครเลย
ปัญหานี้ค่อนข้างจะหลีกเลี่ยงได้ในคู่มือส่วนใหญ่: ให้แสดงปฏิกิริยาสองหรือสามปฏิกิริยาเป็นตัวอย่าง
ในบทความนี้ฉันนำเสนอสิ่งที่เรียกว่าผลการวิเคราะห์การวิจัยของงาน Unified State Examination ตรรกะและหลักการของการเกิดปฏิกิริยาออกซิเดชันกับเปอร์แมงกาเนตและไดโครเมตได้รับการแก้ไขอย่างแม่นยำ (ตามมาตรฐาน Unified State Examination) สิ่งแรกก่อน
การกำหนดสถานะออกซิเดชัน.
ประการแรก เมื่อเราจัดการกับปฏิกิริยารีดอกซ์ จะมีตัวออกซิไดซ์และตัวรีดิวซ์อยู่เสมอ
ตัวออกซิไดซ์คือแมงกานีสในเปอร์แมงกาเนตหรือโครเมียมในไดโครเมต ตัวรีดิวซ์คืออะตอมในอินทรียวัตถุ (กล่าวคือ อะตอมของคาร์บอน)
การระบุผลิตภัณฑ์นั้นไม่เพียงพอที่จะทำให้ปฏิกิริยาต้องเท่ากัน สำหรับการปรับสมดุล จะใช้วิธีการสมดุลแบบอิเล็กทรอนิกส์แบบดั้งเดิม หากต้องการใช้วิธีนี้ จำเป็นต้องกำหนดสถานะออกซิเดชันของตัวรีดิวซ์และตัวออกซิไดซ์ก่อนและหลังปฏิกิริยา
ฉันไม่มี สารอินทรีย์เรารู้สถานะออกซิเดชันตั้งแต่เกรด 9:
แต่คงไม่ได้เรียนวิชาออร์แกนิกตอนชั้นประถมศึกษาปีที่ 9 ดังนั้น ก่อนที่จะเรียนรู้วิธีเขียน OVR ในเคมีอินทรีย์ คุณจำเป็นต้องเรียนรู้วิธีระบุสถานะออกซิเดชันของคาร์บอนในสารอินทรีย์ สิ่งนี้ทำแตกต่างออกไปเล็กน้อย แตกต่างจากเคมีอนินทรีย์
คาร์บอนมีสถานะออกซิเดชันสูงสุดที่ +4 และต่ำสุดที่ -4 และสามารถแสดงระดับของการเกิดออกซิเดชันของช่องว่างนี้ได้: -4, -3, -2, -1, 0, +1, +2, +3, +4
ก่อนอื่นคุณต้องจำไว้ว่าสถานะออกซิเดชันคืออะไร
สถานะออกซิเดชันคือประจุทั่วไปที่ปรากฏบนอะตอม โดยสมมติว่าคู่อิเล็กตรอนถูกเลื่อนไปทางอะตอมที่มีอิเล็กโทรเนกาติตีมากกว่าโดยสิ้นเชิง
ดังนั้นระดับของการเกิดออกซิเดชันจึงถูกกำหนดโดยจำนวนคู่อิเล็กตรอนที่ถูกแทนที่: หากมันถูกแทนที่ไปยังอะตอมที่กำหนดมันจะได้รับประจุลบ (-) ส่วนเกินหากจากอะตอมก็จะได้รับประจุบวก (+) ส่วนเกิน ค่าใช้จ่าย. โดยหลักการแล้ว นี่คือทฤษฎีทั้งหมดที่คุณต้องรู้เพื่อกำหนดสถานะออกซิเดชันของอะตอมคาร์บอน
ในการกำหนดสถานะออกซิเดชันของอะตอมคาร์บอนในสารประกอบ เราต้องพิจารณาแต่ละพันธะของมัน และดูว่าคู่อิเล็กตรอนจะเปลี่ยนไปในทิศทางใด และประจุส่วนเกิน (+ หรือ -) จะเกิดขึ้นจากสิ่งนี้บนอะตอมคาร์บอนเท่าใด
ลองดูตัวอย่างที่เฉพาะเจาะจง:
ที่คาร์บอน พันธะสามพันธะกับไฮโดรเจน- คาร์บอนและไฮโดรเจน - ไหนมีอิเลคโตรเนกาติวิตีมากกว่ากัน? คาร์บอน ซึ่งหมายความว่าคู่อิเล็กตรอนจะเปลี่ยนไปเป็นคาร์บอนตามพันธะทั้งสามนี้ คาร์บอนรับประจุลบหนึ่งประจุจากไฮโดรเจนแต่ละตัว ปรากฎว่า -3
การเชื่อมต่อที่สี่คือกับคลอรีน คาร์บอนและคลอรีน - ไหนมีประจุไฟฟ้ามากกว่ากัน? คลอรีน ซึ่งหมายความว่าคู่อิเล็กตรอนจะเปลี่ยนไปทางคลอรีนตามพันธะนี้ คาร์บอนจะมีประจุบวก +1 หนึ่งประจุ
จากนั้นคุณเพียงแค่ต้องเพิ่ม: -3 + 1 = -2 สถานะออกซิเดชันของอะตอมคาร์บอนนี้คือ -2

มาดูสถานะออกซิเดชันของอะตอมคาร์บอนแต่ละอะตอมกัน:

คาร์บอนมีพันธะสามพันธะกับไฮโดรเจน คาร์บอนและไฮโดรเจน - ไหนมีอิเลคโตรเนกาติวิตีมากกว่ากัน? คาร์บอน ซึ่งหมายความว่าคู่อิเล็กตรอนจะเปลี่ยนไปเป็นคาร์บอนตามพันธะทั้งสามนี้ คาร์บอนรับประจุลบหนึ่งประจุจากไฮโดรเจนแต่ละตัว ปรากฎว่า -3
และอีกหนึ่งการเชื่อมต่อกับคาร์บอนอีกตัวหนึ่ง คาร์บอนและคาร์บอนอีกตัวหนึ่ง - อิเลคโตรเนกาติวีตี้ของพวกมันเท่ากัน ดังนั้นจึงไม่มีการกระจัดของคู่อิเล็กตรอน (พันธะไม่ใช่ขั้ว) 

อะตอมนี้มีพันธะ 2 พันธะกับออกซิเจน 1 อะตอม และอีกพันธะกับออกซิเจน 1 อะตอม (ซึ่งเป็นส่วนหนึ่งของหมู่ OH) อะตอมออกซิเจนที่มีอิเลคโตรเนกาติตีมากขึ้นในพันธะสามพันธะจะดึงดูดคู่อิเล็กตรอนจากคาร์บอน และคาร์บอนจะมีประจุ +3
ตามพันธะที่สี่ คาร์บอนจะเชื่อมต่อกับคาร์บอนอีกตัวหนึ่ง ดังที่เราได้กล่าวไปแล้ว คู่อิเล็กตรอนจะไม่เปลี่ยนตำแหน่งตามพันธะนี้


คาร์บอนเชื่อมต่อกับอะตอมไฮโดรเจนด้วยพันธะสองพันธะ คาร์บอนซึ่งมีอิเลคโตรเนกาติวิตีมากกว่า จะดึงอิเล็กตรอนออกไปหนึ่งคู่สำหรับแต่ละพันธะกับไฮโดรเจน และจะมีประจุเท่ากับ -2
พันธะคาร์บอนคู่เชื่อมต่อกับอะตอมออกซิเจน ออกซิเจนที่มีอิเลคโตรเนกาติตีมากขึ้นจะดึงดูดอิเล็กตรอนคู่หนึ่งเข้าหาตัวมันเองตลอดแต่ละพันธะ ปรากฎว่าคาร์บอนมีคู่อิเล็กตรอน 2 คู่ คาร์บอนจะมีประจุ +2
เมื่อรวมกันแล้วจะได้ +2 -2 = 0

พิจารณาสถานะออกซิเดชันของอะตอมคาร์บอนนี้:
พันธะสามที่มีไนโตรเจนที่มีอิเลคโตรเนกาติตีมากกว่าจะทำให้คาร์บอนมีประจุ +3 แต่พันธะกับคาร์บอนจะไม่เปลี่ยนคู่อิเล็กตรอน

ออกซิเดชันกับเปอร์แมงกาเนต
จะเกิดอะไรขึ้นกับทับทิม?
ปฏิกิริยารีดอกซ์กับเปอร์แมงกาเนตสามารถเกิดขึ้นได้ในสภาพแวดล้อมที่แตกต่างกัน (เป็นกลาง, เป็นด่าง, เป็นกรด) และขึ้นอยู่กับสภาพแวดล้อมว่าปฏิกิริยาจะเกิดขึ้นอย่างไรและผลิตภัณฑ์ใดจะก่อตัวขึ้น
ดังนั้นจึงสามารถไปได้ 3 ทิศทาง คือ

เปอร์แมงกาเนตซึ่งเป็นตัวออกซิไดซ์จะลดลง ต่อไปนี้เป็นผลิตภัณฑ์ของการบูรณะ:
- สภาพแวดล้อมที่เป็นกรด.
ตัวกลางถูกทำให้เป็นกรดด้วยกรดซัลฟิวริก (H 2 SO 4) แมงกานีสจะถูกรีดิวซ์เป็นสถานะออกซิเดชัน +2 และผลิตภัณฑ์เพื่อการฟื้นฟูจะเป็น:
KMnO 4 + H 2 SO 4 → MnSO 4 + K 2 SO 4 + H 2 O
- สภาพแวดล้อมที่เป็นด่าง.
เพื่อสร้างสภาพแวดล้อมที่เป็นด่าง จึงมีการเติมอัลคาไลที่มีความเข้มข้นพอสมควร (KOH) แมงกานีสจะถูกรีดิวซ์เป็นสถานะออกซิเดชัน +6 ผลิตภัณฑ์เพื่อการฟื้นฟู
KMnO 4 + KOH → K 2 MnO 4 + H 2 O
- สภาพแวดล้อมที่เป็นกลาง(และเป็นด่างเล็กน้อย).
ในสภาพแวดล้อมที่เป็นกลาง นอกจากเปอร์แมงกาเนตแล้ว น้ำยังทำปฏิกิริยา (ซึ่งเราเขียนทางด้านซ้ายของสมการ) แมงกานีสจะลดลงเหลือ +4 (MnO 2) ผลิตภัณฑ์รีดักชันจะเป็น:
KMnO 4 + H 2 O → MnO 2 + KOH
และในสภาพแวดล้อมที่เป็นด่างเล็กน้อย (เมื่อมีสารละลาย KOH ที่มีความเข้มข้นต่ำ):
KMnO 4 + KOH → MnO 2 + H 2 O

จะเกิดอะไรขึ้นกับอินทรียวัตถุ?
สิ่งแรกที่คุณต้องเข้าใจคือทุกอย่างเริ่มต้นจากแอลกอฮอล์! นี่คือระยะเริ่มต้นของการเกิดออกซิเดชัน คาร์บอนที่หมู่ไฮดรอกซิลเกาะอยู่จะเกิดปฏิกิริยาออกซิเดชัน
ในระหว่างการออกซิเดชั่น อะตอมของคาร์บอนจะ "ได้รับ" พันธะกับออกซิเจน ดังนั้น เมื่อเขียนแผนผังปฏิกิริยาออกซิเดชัน ให้เขียน [O] เหนือลูกศร:
แอลกอฮอล์เบื้องต้น ออกซิไดซ์ก่อนเป็นอัลดีไฮด์ จากนั้นเป็นกรดคาร์บอกซิลิก:

ออกซิเดชัน แอลกอฮอล์รอง แตกออกในระยะที่สอง เนื่องจากคาร์บอนอยู่ตรงกลาง คีโตนจึงถูกสร้างขึ้น ไม่ใช่อัลดีไฮด์ (อะตอมของคาร์บอนในกลุ่มคีโตนไม่สามารถสร้างพันธะทางกายภาพกับหมู่ไฮดรอกซิลได้อีกต่อไป):

คีโตน, แอลกอฮอล์ระดับอุดมศึกษาและ กรดคาร์บอกซิลิกไม่ออกซิไดซ์อีกต่อไป:

กระบวนการออกซิเดชันจะเป็นไปตามขั้นตอน ตราบใดที่ยังมีที่ว่างสำหรับการเกิดออกซิเดชันและมีเงื่อนไขครบถ้วน ปฏิกิริยาจะดำเนินต่อไป ทุกอย่างจบลงด้วยผลิตภัณฑ์ที่ไม่ออกซิไดซ์ภายใต้เงื่อนไขที่กำหนด: แอลกอฮอล์ระดับตติยภูมิ คีโตน หรือกรด
เป็นที่น่าสังเกตว่าขั้นตอนของการเกิดออกซิเดชันของเมธานอล ขั้นแรก มันถูกออกซิไดซ์กับอัลดีไฮด์ที่เกี่ยวข้อง จากนั้นเป็นกรดที่เกี่ยวข้อง:

ลักษณะเฉพาะของผลิตภัณฑ์นี้ (กรดฟอร์มิก) คือคาร์บอนในกลุ่มคาร์บอกซิลถูกพันธะกับไฮโดรเจน และหากคุณมองใกล้ ๆ คุณจะสังเกตเห็นว่านี่ไม่ใช่อะไรมากไปกว่ากลุ่มอัลดีไฮด์:

และหมู่อัลดีไฮด์ดังที่เราพบก่อนหน้านี้ จะถูกออกซิไดซ์ต่อไปเป็นหมู่คาร์บอกซิล:

คุณจำสารที่เกิดขึ้นได้หรือไม่? สูตรรวมของมันคือ H 2 CO 3 นี้ กรดคาร์บอนิกซึ่งแตกตัวเป็นคาร์บอนไดออกไซด์และน้ำ:
เอช 2 CO 3 → H 2 O + CO 2
ดังนั้นเมทานอล ฟอร์มิคอลดีไฮด์ และ กรดฟอร์มิก(เนื่องจากหมู่อัลดีไฮด์) ถูกออกซิไดซ์เป็นคาร์บอนไดออกไซด์
ออกซิเดชันเล็กน้อย
ออกซิเดชั่นอย่างอ่อนคือ ออกซิเดชันโดยไม่มีความร้อนสูงในสภาพแวดล้อมที่เป็นกลางหรือเป็นด่างเล็กน้อย (เขียน 0 เหนือปฏิกิริยา °หรือ 20 °) .
สิ่งสำคัญคือต้องจำไว้ว่าแอลกอฮอล์จะไม่ออกซิไดซ์ภายใต้สภาวะที่ไม่รุนแรง ดังนั้นหากพวกมันก่อตัวขึ้นปฏิกิริยาออกซิเดชั่นจะหยุดลง สารใดบ้างที่จะเกิดปฏิกิริยาออกซิเดชั่นอ่อนๆ
- ประกอบด้วยพันธะคู่ C=C (ปฏิกิริยาวากเนอร์)
ในกรณีนี้ พันธะ π ขาดและหมู่ไฮดรอกซิล "อยู่บน" พันธะที่ปล่อยออกมา ผลลัพธ์ที่ได้คือแอลกอฮอล์ไดไฮโดรริก:

มาเขียนปฏิกิริยาออกซิเดชันเล็กน้อยของเอทิลีน (เอธีน) กัน มาเขียนสารตั้งต้นและทำนายผลคูณกันดีกว่า ในเวลาเดียวกันเรายังไม่ได้เขียน H 2 O และ KOH ซึ่งอาจปรากฏทางด้านขวาของสมการหรือทางด้านซ้ายก็ได้ และเราจะกำหนดระดับออกซิเดชันของสารที่เกี่ยวข้องกับปฏิกิริยารีดอกซ์ทันที:

มาสร้างสมดุลทางอิเล็กทรอนิกส์กันเถอะ (เราหมายถึงว่ามีตัวรีดิวซ์สองตัว - อะตอมของคาร์บอนสองตัวพวกมันถูกออกซิไดซ์แยกกัน):

มาตั้งค่าสัมประสิทธิ์กัน:

ในตอนท้ายคุณต้องเพิ่มผลิตภัณฑ์ที่ขาดหายไป (H 2 O และ KOH) ด้านขวามีโพแทสเซียมไม่เพียงพอ ซึ่งหมายความว่าจะมีด่างทางด้านขวา เราใส่สัมประสิทธิ์ไว้ข้างหน้า. ด้านซ้ายมีไฮโดรเจนไม่เพียงพอ ด้านซ้ายจึงมีน้ำ เราใส่สัมประสิทธิ์ไว้ข้างหน้า:

ลองทำแบบเดียวกันกับโพรพิลีน (โพรพีน):


ไซโคลอัลคีนมักจะหลุดเข้าไป อย่าปล่อยให้มันรบกวนคุณ เป็นไฮโดรคาร์บอนธรรมดาที่มีพันธะคู่:

ไม่ว่าพันธะคู่นี้จะอยู่ที่ใดก็ตาม ออกซิเดชันจะดำเนินการในลักษณะเดียวกัน:

- ประกอบด้วยหมู่อัลดีไฮด์.
หมู่อัลดีไฮด์จะมีปฏิกิริยา (ทำปฏิกิริยาได้ง่ายกว่า) มากกว่ากลุ่มแอลกอฮอล์ ดังนั้นอัลดีไฮด์จะออกซิไดซ์ ก่อนเป็นกรด:

ลองดูตัวอย่างของอะซีตัลดีไฮด์ (เอทานอล) มาเขียนสารตั้งต้นและผลิตภัณฑ์และจัดเรียงสถานะออกซิเดชันกันดีกว่า มาสร้างความสมดุลและใส่ค่าสัมประสิทธิ์ไว้หน้าตัวรีดิวซ์และตัวออกซิไดซ์:

ในสภาพแวดล้อมที่เป็นกลางและสภาพแวดล้อมที่เป็นด่างเล็กน้อย ปฏิกิริยาจะแตกต่างกันเล็กน้อย
ในสภาพแวดล้อมที่เป็นกลาง อย่างที่เราจำได้ เราจะเขียนน้ำทางด้านซ้ายของสมการ และอัลคาไลทางด้านขวาของสมการ (ที่เกิดขึ้นระหว่างปฏิกิริยา):

ในกรณีนี้ กรดและด่างจะปรากฏเคียงข้างกันในส่วนผสมเดียว การทำให้เป็นกลางเกิดขึ้น

พวกมันไม่สามารถอยู่เคียงข้างกันและทำปฏิกิริยาได้ เกลือจึงก่อตัวขึ้น:
ยิ่งไปกว่านั้น หากเราดูค่าสัมประสิทธิ์ในสมการ เราจะเข้าใจว่ามีกรด 3 โมล และอัลคาไล 2 โมล อัลคาไล 2 โมลสามารถทำให้กรดเป็นกลางได้เพียง 2 โมล (เกิดเกลือ 2 โมล) และยังมีกรดเหลืออยู่หนึ่งโมล ดังนั้นสมการสุดท้ายจะเป็น:

ในสภาพแวดล้อมที่เป็นด่างเล็กน้อย อัลคาไลมีมากเกินไป - จะถูกเติมก่อนเกิดปฏิกิริยา ดังนั้นกรดทั้งหมดจึงถูกทำให้เป็นกลาง:

สถานการณ์ที่คล้ายกันเกิดขึ้นระหว่างการเกิดออกซิเดชันของมีธานอล อย่างที่เราจำได้มันถูกออกซิไดซ์เป็นคาร์บอนไดออกไซด์:

ต้องคำนึงว่าคาร์บอนมอนอกไซด์ (IV) CO 2 มีสภาพเป็นกรด และก็จะทำปฏิกิริยากับด่าง และเนื่องจากกรดคาร์บอนิกเป็น dibasic จึงสามารถเกิดทั้งเกลือกรดและเกลือปานกลางได้ ขึ้นอยู่กับอัตราส่วนระหว่างอัลคาไลและคาร์บอนไดออกไซด์:
หากอัลคาไลมีอัตราส่วน 2:1 ต่อคาร์บอนไดออกไซด์จากนั้นเกลือโดยเฉลี่ยจะเป็น:
หรืออาจมีความเป็นด่างเพิ่มขึ้นอย่างมีนัยสำคัญ (มากกว่าสองเท่า) หากเพิ่มขึ้นมากกว่าสองเท่า อัลคาไลที่เหลือก็จะยังคงอยู่:
3KOH + CO 2 → K 2 CO 3 + H 2 O + KOH
สิ่งนี้จะเกิดขึ้นในสภาพแวดล้อมที่เป็นด่าง (ซึ่งมีอัลคาไลมากเกินไป เนื่องจากมันถูกเติมลงในส่วนผสมของปฏิกิริยาก่อนเกิดปฏิกิริยา) หรือในสภาพแวดล้อมที่เป็นกลาง เมื่อมีอัลคาไลจำนวนมากเกิดขึ้น
แต่ถ้าอัลคาไลสัมพันธ์กับคาร์บอนไดออกไซด์เป็น 1:1แล้วจะมีเกลือที่เป็นกรด:
เกาะ + CO 2 → KHCO 3
หากมีก๊าซคาร์บอนไดออกไซด์เกินความจำเป็น ก็จะมีก๊าซคาร์บอนไดออกไซด์เหลืออยู่มากเกินไป:
เกาะ + 2CO 2 → KHCO 3 + CO 2
สิ่งนี้จะเกิดขึ้นในสภาพแวดล้อมที่เป็นกลางหากมีการสร้างอัลคาไลเพียงเล็กน้อย
มาเขียนสารตั้งต้นผลิตภัณฑ์วาดสมดุลใส่สถานะออกซิเดชันไว้หน้าตัวออกซิไดซ์ตัวรีดิวซ์และผลิตภัณฑ์ที่เกิดขึ้นจากพวกมัน:

ในสภาพแวดล้อมที่เป็นกลาง อัลคาไล (4KOH) จะก่อตัวทางด้านขวา:

ตอนนี้เราต้องเข้าใจว่าจะเกิดอะไรขึ้นระหว่างการทำงานร่วมกันของ CO 2 สามโมลและอัลคาไลสี่โมล
3CO 2 + 4KOH → 3KHCO 3 + KOH
KHCO 3 + KOH → K 2 CO 3 + H 2 O
ปรากฎดังนี้:
3CO 2 + 4KOH → 2KHCO 3 + K 2 CO 3 + H 2 O
ดังนั้น ทางด้านขวาของสมการ เราจึงเขียนไบคาร์บอเนต 2 โมลและคาร์บอเนต 1 โมล:

แต่ในสภาพแวดล้อมที่เป็นด่างอ่อนไม่มีปัญหาดังกล่าวเนื่องจากมีอัลคาไลมากเกินไปเกลือโดยเฉลี่ยจึงจะเกิดขึ้น:

สิ่งเดียวกันนี้จะเกิดขึ้นระหว่างการเกิดออกซิเดชันของอัลดีไฮด์ของกรดออกซาลิก:

เช่นเดียวกับในตัวอย่างก่อนหน้านี้ กรด dibasic ถูกสร้างขึ้น และตามสมการ ควรได้รับอัลคาไล 4 โมล (เนื่องจากเปอร์แมงกาเนต 4 โมล)
ในสภาพแวดล้อมที่เป็นกลาง อัลคาไลทั้งหมดไม่เพียงพอที่จะทำให้กรดทั้งหมดเป็นกลางได้อย่างสมบูรณ์
อัลคาไลสามโมลจะเกิดเป็นเกลือกรด โดยเหลืออัลคาไลหนึ่งโมล:
3HOOC–COOH + 4KOH → 3KOOC–COOH + KOH
และอัลคาไลหนึ่งโมลนี้ไปทำปฏิกิริยากับเกลือกรดหนึ่งโมล:
KOOC–COOH + KOH → KOOC–COOK + H 2 O
ปรากฎดังนี้:
3HOOC–COOH + 4KOH → 2KOOC–COOH + KOOC–COOK + H 2 O
สมการสุดท้าย:

ในสภาพแวดล้อมที่เป็นด่างเล็กน้อย เกลือปานกลางจะเกิดขึ้นเนื่องจากมีความเป็นด่างมากเกินไป:

- ประกอบด้วยพันธะสามค≡ ค.
จำสิ่งที่เกิดขึ้นระหว่างการออกซิเดชันเล็กน้อยของสารประกอบที่มีพันธะคู่ได้หรือไม่? ถ้าจำไม่ได้ ให้เลื่อนกลับไปจำ
พันธะ π แตกตัวและหมู่ไฮดรอกซิลเกาะติดกับอะตอมของคาร์บอน มันเป็นหลักการเดียวกันที่นี่ เพียงจำไว้ว่าพันธะสามมีพันธะ π สองพันธะ ขั้นแรกสิ่งนี้จะเกิดขึ้นตามพันธะ π แรก:
จากนั้นผ่านพันธะ π อีกอัน:

โครงสร้างที่อะตอมของคาร์บอนหนึ่งอะตอมมีกลุ่มไฮดรอกซิลสองกลุ่มนั้นไม่เสถียรอย่างยิ่ง เมื่อบางสิ่งไม่เสถียรทางเคมี ก็มักจะทำให้บางสิ่ง “หลุดออกไป” น้ำก็ตกลงมาดังนี้:

ส่งผลให้เกิดหมู่คาร์บอนิล
ลองดูตัวอย่าง:
เอธิน (อะเซทิลีน) พิจารณาขั้นตอนของการเกิดออกซิเดชันของสารนี้:

การกำจัดน้ำ:




เช่นเดียวกับในตัวอย่างก่อนหน้านี้ มีกรดและด่างอยู่ในส่วนผสมปฏิกิริยาเดียว การทำให้เป็นกลางเกิดขึ้นและเกิดเกลือขึ้น อย่างที่คุณเห็นจากค่าสัมประสิทธิ์ของด่างเปอร์แมงกาเนตจะมี 8 โมลนั่นคือเพียงพอที่จะทำให้กรดเป็นกลางได้ สมการสุดท้าย:

พิจารณาการเกิดออกซิเดชันของบิวทีน-2:

การกำจัดน้ำ:

ไม่มีกรดเกิดขึ้นที่นี่ ดังนั้นจึงไม่จำเป็นต้องกังวลกับการทำให้เป็นกลาง
สมการปฏิกิริยา:

ความแตกต่างเหล่านี้ (ระหว่างการออกซิเดชันของคาร์บอนที่ขอบและตรงกลางโซ่) แสดงให้เห็นอย่างชัดเจนจากตัวอย่างของเพนไทน์:

การกำจัดน้ำ:

ผลลัพธ์ที่ได้คือสารที่มีโครงสร้างที่น่าสนใจดังนี้

หมู่อัลดีไฮด์ยังคงออกซิไดซ์ต่อไป:
มาเขียนสารตั้งต้นผลิตภัณฑ์กำหนดสถานะออกซิเดชันสร้างสมดุลวางค่าสัมประสิทธิ์ไว้หน้าตัวออกซิไดซ์และตัวรีดิวซ์:

ควรสร้างอัลคาไล 2 โมล (เนื่องจากค่าสัมประสิทธิ์ด้านหน้าเปอร์แมงกาเนตคือ 2) ดังนั้นกรดทั้งหมดจึงถูกทำให้เป็นกลาง:

ออกซิเดชันอย่างรุนแรง.
ออกซิเดชันอย่างหนักคือออกซิเดชันใน เปรี้ยว, ความเป็นด่างสูงสิ่งแวดล้อม. แล้วก็อินด้วย เป็นกลาง (หรือเป็นด่างเล็กน้อย) แต่เมื่อถูกความร้อน.
ในสภาพแวดล้อมที่เป็นกรดบางครั้งอาจได้รับความร้อนเช่นกัน แต่เพื่อให้เกิดออกซิเดชันอย่างรุนแรงในสภาพแวดล้อมที่ไม่มีกรด การให้ความร้อนถือเป็นข้อกำหนดเบื้องต้น
สารใดจะเกิดปฏิกิริยาออกซิเดชั่นรุนแรง? (ขั้นแรก เราจะวิเคราะห์เฉพาะในสภาพแวดล้อมที่เป็นกรด - จากนั้นเราจะเพิ่มความแตกต่างที่เกิดขึ้นระหว่างการเกิดออกซิเดชันในสภาพแวดล้อมที่เป็นด่างสูงและเป็นกลางหรือเป็นด่างอ่อน (เมื่อถูกความร้อน))
เมื่อเกิดออกซิเดชันอย่างรุนแรง กระบวนการนี้จะดำเนินไปจนสูงสุด ตราบใดที่ยังมีบางสิ่งที่จะออกซิไดซ์ การเกิดออกซิเดชันจะดำเนินต่อไป
- แอลกอฮอล์. อัลดีไฮด์.
ลองพิจารณาออกซิเดชันของเอธานอล มันจะค่อยๆ ออกซิไดซ์เป็นกรด:

มาเขียนสมการกัน เราจดบันทึกสารตั้งต้น ผลิตภัณฑ์ของปฏิกิริยารีดอกซ์ เข้าสู่สถานะออกซิเดชัน และรวบรวมสมดุล มาทำให้ปฏิกิริยาเท่ากัน:

หากทำปฏิกิริยาที่จุดเดือดของอัลดีไฮด์ เมื่อเกิดขึ้น อัลดีไฮด์จะระเหย (ลอยออกไป) ออกจากส่วนผสมของปฏิกิริยาโดยไม่ต้องมีเวลาออกซิไดซ์เพิ่มเติม ผลลัพธ์เดียวกันนี้สามารถทำได้ในสภาวะที่อ่อนโยนมาก (ความร้อนต่ำ) ในกรณีนี้ เราเขียนอัลดีไฮด์เป็นผลิตภัณฑ์:

ลองพิจารณาการเกิดออกซิเดชันของแอลกอฮอล์ทุติยภูมิโดยใช้ตัวอย่างของ 2-โพรพานอล ดังที่ได้กล่าวไปแล้ว การเกิดออกซิเดชันสิ้นสุดลงในระยะที่สอง (การก่อตัวของสารประกอบคาร์บอนิล) เนื่องจากมีการสร้างคีโตนซึ่งไม่ออกซิไดซ์ สมการปฏิกิริยา:

ลองพิจารณาออกซิเดชันของอัลดีไฮด์โดยใช้เอธานอล มันยังออกซิไดซ์เป็นกรด:

สมการปฏิกิริยา:

มีทานอลและเมทานอลดังที่ได้กล่าวไว้ข้างต้นถูกออกซิไดซ์เป็นคาร์บอนไดออกไซด์:

โลหะ:

- ซึ่งประกอบด้วยพันธบัตรหลายตัว.
ในกรณีนี้ โซ่ขาดที่พันธะพหุคูณ และอะตอมที่ก่อตัวขึ้นจะเกิดปฏิกิริยาออกซิเดชัน (เกิดพันธะกับออกซิเจน) ออกซิไดซ์ให้มากที่สุด
เมื่อพันธะคู่ถูกทำลาย สารประกอบคาร์บอนิลจะถูกสร้างขึ้นจากชิ้นส่วนต่างๆ (ในแผนภาพด้านล่าง: จากชิ้นส่วนหนึ่ง - อัลดีไฮด์ และอีกชิ้นหนึ่ง - คีโตน)

![]()
ลองดูการออกซิเดชันของเพนทีน-2:

ออกซิเดชันของ "เศษ":

ปรากฎว่ามีกรดสองตัวเกิดขึ้น มาเขียนวัสดุและผลิตภัณฑ์เริ่มต้นกัน เรามาพิจารณาสถานะออกซิเดชันของอะตอมที่เปลี่ยนแปลง สร้างสมดุล และทำให้ปฏิกิริยาเท่ากัน: 
เมื่อรวบรวมเครื่องชั่งอิเล็กทรอนิกส์ เราหมายถึงว่ามีสารรีดิวซ์สองตัว - อะตอมของคาร์บอน 2 อะตอม และพวกมันถูกออกซิไดซ์แยกจากกัน:

กรดจะไม่ก่อตัวเสมอไป ให้เราตรวจสอบตัวอย่างการออกซิเดชันของ 2-methylbutene:

สมการปฏิกิริยา:

หลักการเดียวกันอย่างแน่นอนสำหรับการเกิดออกซิเดชันของสารประกอบที่มีพันธะสามชั้น (เฉพาะการเกิดออกซิเดชันเท่านั้นที่เกิดขึ้นทันทีเมื่อมีการก่อตัวของกรดโดยไม่มีการก่อตัวของอัลดีไฮด์ขั้นกลาง):

สมการปฏิกิริยา:

เมื่อพันธะพหุคูณอยู่ตรงกลางพอดี ผลลัพธ์จะไม่ใช่สองผลิตภัณฑ์ แต่เป็นหนึ่งเดียว เนื่องจาก "เศษ" เหมือนกันและถูกออกซิไดซ์เป็นผลิตภัณฑ์เดียวกัน:

สมการปฏิกิริยา:

- กรดมงกุฎคู่.
มีกรดอยู่ตัวหนึ่งซึ่งมีหมู่คาร์บอกซิล (ครอบฟัน) เชื่อมต่อกัน:
นี่คือกรดออกซาลิก ยากที่มงกุฎสองอันจะเข้ากันได้ มีความเสถียรอย่างแน่นอนภายใต้สภาวะปกติ แต่เนื่องจากมีกลุ่มคาร์บอกซิลิกสองกลุ่มเชื่อมต่อกัน จึงมีความเสถียรน้อยกว่ากรดคาร์บอกซิลิกอื่น ๆ
ดังนั้นภายใต้สภาวะที่ไม่เอื้ออำนวยเป็นพิเศษ จึงสามารถออกซิไดซ์ได้ การเชื่อมต่อระหว่าง "สองมงกุฎ" ขาดหายไป:

สมการปฏิกิริยา:

- ความคล้ายคลึงกันของเบนซีน (และอนุพันธ์ของพวกมัน).
เบนซีนเองก็ไม่ออกซิไดซ์ เนื่องจากอะโรมาติกซิตี้ทำให้โครงสร้างนี้มีความเสถียรมาก 
แต่ความคล้ายคลึงกันของมันถูกออกซิไดซ์ ในกรณีนี้วงจรก็ขาดเช่นกันสิ่งสำคัญคือต้องรู้ว่าอยู่ที่ไหน มีหลักการบางประการ:
- วงแหวนเบนซีนนั้นจะไม่ยุบตัวและยังคงสภาพเดิมไว้จนกระทั่งสิ้นสุดการแตกของพันธะจะเกิดขึ้นในอนุมูล
- อะตอมที่ถูกพันธะโดยตรงกับวงแหวนเบนซีนจะถูกออกซิไดซ์ หากหลังจากนั้นโซ่คาร์บอนในอนุมูลยังคงดำเนินต่อไป การแตกหักจะเกิดขึ้นหลังจากนั้น


ลองดูการออกซิเดชันของเมทิลเบนซีน ที่นั่นอะตอมของคาร์บอนหนึ่งอะตอมในอนุมูลถูกออกซิไดซ์: 
สมการปฏิกิริยา:

ลองดูการออกซิเดชันของไอโซบิวทิลเบนซีน:

สมการปฏิกิริยา:

ลองดูการออกซิเดชันของ sec-butylbenzene:

สมการปฏิกิริยา:

เมื่อเบนซีนคล้ายคลึงกัน (และอนุพันธ์ของคล้ายคลึงกัน) ถูกออกซิไดซ์ด้วยอนุมูลหลายตัว จะเกิดกรดอะโรมาติกพื้นฐานสอง, สามหรือมากกว่านั้นขึ้นมา ตัวอย่างเช่น ออกซิเดชันของ 1,2-dimethylbenzene:

อนุพันธ์ของสารที่คล้ายคลึงกันของเบนซีน (ซึ่งวงแหวนของเบนซีนมีอนุมูลที่ไม่ใช่ไฮโดรคาร์บอน) จะถูกออกซิไดซ์ในลักษณะเดียวกัน กลุ่มฟังก์ชันอื่นบนวงแหวนเบนซีนไม่รบกวน:


ผลรวมย่อย อัลกอริทึม "วิธีเขียนปฏิกิริยาออกซิเดชันอย่างหนักกับเปอร์แมงกาเนตในตัวกลางที่เป็นกรด":
- เขียนสารตั้งต้น (สารอินทรีย์ + KMnO 4 + H 2 SO 4)
- เขียนผลิตภัณฑ์ของออกซิเดชันอินทรีย์ (สารประกอบที่มีแอลกอฮอล์ หมู่อัลดีไฮด์ พันธะพหุคูณ และสารที่คล้ายคลึงกันของเบนซีนจะถูกออกซิไดซ์)
- เขียนผลคูณของรีดักชันเปอร์แมงกาเนต (MnSO 4 + K 2 SO 4 + H 2 O)
- กำหนดระดับของการเกิดออกซิเดชันในผู้เข้าร่วม OVR ทำงบดุล. ป้อนค่าสัมประสิทธิ์สำหรับตัวออกซิไดซ์และตัวรีดิวซ์รวมถึงสารที่เกิดขึ้นจากพวกมัน
- จากนั้นขอแนะนำให้คำนวณจำนวนซัลเฟตแอนไอออนที่อยู่ทางด้านขวาของสมการและใส่ค่าสัมประสิทธิ์ไว้หน้ากรดซัลฟิวริกทางด้านซ้ายตามลำดับ
- ในตอนท้ายให้ใส่ค่าสัมประสิทธิ์ไว้หน้าน้ำ
ออกซิเดชันอย่างรุนแรงในสภาพแวดล้อมที่เป็นด่างสูงและในสภาพแวดล้อมที่เป็นกลางหรือเป็นด่างเล็กน้อย (เมื่อได้รับความร้อน).
ปฏิกิริยาเหล่านี้พบได้น้อยกว่ามาก เราสามารถพูดได้ว่าปฏิกิริยาดังกล่าวเป็นเรื่องแปลกใหม่ และเพื่อให้เข้ากับปฏิกิริยาที่แปลกใหม่ สิ่งเหล่านี้กลับกลายเป็นข้อขัดแย้งกันมากที่สุด
การออกซิเดชันแบบแข็งก็ทำได้ยากในแอฟริกา ดังนั้นอินทรียวัตถุจึงออกซิไดซ์ในลักษณะเดียวกับในสภาพแวดล้อมที่เป็นกรด
เราจะไม่วิเคราะห์ปฏิกิริยาของแต่ละคลาสแยกกัน เนื่องจากหลักการทั่วไปได้กล่าวไว้ก่อนหน้านี้แล้ว เรามาดูความแตกต่างกันดีกว่า
สภาพแวดล้อมที่มีความเป็นด่างสูง :
ในสภาพแวดล้อมที่มีความเป็นด่างสูง เปอร์แมงกาเนตจะถูกรีดิวซ์เป็นสถานะออกซิเดชัน +6 (โพแทสเซียมแมงกาเนต):
KMnO 4 + KOH → K 2 MnO 4 .
ในสภาพแวดล้อมที่เป็นด่างอย่างรุนแรงจะมีอัลคาไลส่วนเกินอยู่เสมอดังนั้นการวางตัวเป็นกลางโดยสมบูรณ์จะเกิดขึ้น: หากเกิดคาร์บอนไดออกไซด์ก็จะมีคาร์บอเนตหากกรดเกิดขึ้นก็จะมีเกลือ (หากกรดเป็นโพลีเบสิกจะมี จะเป็นเกลือขนาดกลาง)
ตัวอย่างเช่น โพรพีนออกซิเดชัน:

ออกซิเดชันของเอทิลเบนซีน:

สภาพแวดล้อมที่เป็นด่างหรือเป็นกลางเล็กน้อยเมื่อถูกความร้อน :
จะต้องคำนึงถึงความเป็นไปได้ของการวางตัวเป็นกลางด้วย
ถ้าออกซิเดชันเกิดขึ้นในสภาพแวดล้อมที่เป็นกลางและมีสารประกอบที่เป็นกรด (กรดหรือคาร์บอนไดออกไซด์) เกิดขึ้น จากนั้นอัลคาไลที่เกิดขึ้นจะทำให้สารประกอบที่เป็นกรดนี้เป็นกลาง แต่มีอัลคาไลไม่เพียงพอที่จะทำให้กรดเป็นกลางได้อย่างสมบูรณ์เสมอไป
ตัวอย่างเช่นเมื่อออกซิไดซ์อัลดีไฮด์ยังไม่เพียงพอ (ออกซิเดชันจะเกิดขึ้นในลักษณะเดียวกับภายใต้สภาวะที่ไม่รุนแรง - อุณหภูมิจะเร่งปฏิกิริยาให้เร็วขึ้น) ดังนั้นจึงเกิดทั้งเกลือและกรด (ซึ่งพูดคร่าวๆ แล้วยังมีเหลืออยู่มาก)
เราได้พูดคุยเรื่องนี้เมื่อเราดูการออกซิเดชันเล็กน้อยของอัลดีไฮด์
ดังนั้น หากคุณเกิดกรดในสภาพแวดล้อมที่เป็นกลาง คุณต้องดูอย่างรอบคอบว่าเพียงพอที่จะทำให้กรดทั้งหมดเป็นกลางหรือไม่ ควรให้ความสนใจเป็นพิเศษกับกรดโพลีบาซิกที่เป็นกลาง
ในสภาพแวดล้อมที่เป็นด่างอ่อน เนื่องจากมีอัลคาไลในปริมาณที่เพียงพอ จึงเกิดเกลือขนาดกลางเท่านั้น เนื่องจากมีอัลคาไลมากเกินไป
ตามกฎแล้วอัลคาไลก็เพียงพอสำหรับการเกิดออกซิเดชันในสภาพแวดล้อมที่เป็นกลาง และสมการปฏิกิริยาในตัวกลางทั้งที่เป็นกลางและเป็นด่างอ่อนจะเหมือนกัน
ตัวอย่างเช่น ลองดูที่การเกิดออกซิเดชันของเอทิลเบนซีน:


อัลคาไลนั้นเพียงพอที่จะทำให้สารประกอบที่เป็นกรดเป็นกลางได้อย่างสมบูรณ์แม้จะเหลืออยู่:

ใช้อัลคาไลไป 3 โมล - เหลือ 1 โมล
สมการสุดท้าย:

ปฏิกิริยานี้ในสภาพแวดล้อมที่เป็นกลางและเป็นด่างอ่อนจะเกิดขึ้นในลักษณะเดียวกัน (ในสภาพแวดล้อมที่เป็นด่างอ่อนทางด้านซ้ายจะไม่มีด่าง แต่ไม่ได้หมายความว่าไม่มีอยู่ เพียงแต่ไม่ทำปฏิกิริยา)
ปฏิกิริยารีดอกซ์ที่เกี่ยวข้องกับโพแทสเซียมไดโครเมต (ไบโครเมต)
ไบโครเมตไม่มีปฏิกิริยาออกซิเดชันอินทรีย์ที่หลากหลายเช่นนี้ในการตรวจสอบสถานะแบบครบวงจร
การออกซิเดชันกับไดโครเมตมักเกิดขึ้นในสภาพแวดล้อมที่เป็นกรดเท่านั้น ในกรณีนี้ โครเมียมจะคืนค่าเป็น +3 ผลิตภัณฑ์เพื่อการฟื้นฟู:
ออกซิเดชันจะรุนแรง ปฏิกิริยาจะคล้ายกันมากกับการเกิดออกซิเดชันกับเปอร์แมงกาเนต สารชนิดเดียวกันที่ถูกออกซิไดซ์โดยเปอร์แมงกาเนตในสภาพแวดล้อมที่เป็นกรดจะถูกออกซิไดซ์ และผลิตภัณฑ์ชนิดเดียวกันจะถูกสร้างขึ้น
ลองดูปฏิกิริยาบางอย่าง
พิจารณาการเกิดออกซิเดชันของแอลกอฮอล์ หากเกิดออกซิเดชันที่จุดเดือดของอัลดีไฮด์ มันจะปล่อยให้ส่วนผสมของปฏิกิริยาไม่เกิดปฏิกิริยาออกซิเดชัน:

มิฉะนั้นแอลกอฮอล์อาจถูกออกซิไดซ์เป็นกรดโดยตรง
อัลดีไฮด์ที่ผลิตในปฏิกิริยาก่อนหน้านี้สามารถ "ดักจับ" และถูกบังคับให้ออกซิไดซ์เป็นกรด:

ออกซิเดชันของไซโคลเฮกซานอล ไซโคลเฮกซานอลเป็นแอลกอฮอล์รอง ดังนั้นจึงเกิดคีโตน:

หากเป็นการยากที่จะระบุสถานะออกซิเดชันของอะตอมคาร์บอนโดยใช้สูตรนี้ คุณสามารถเขียนลงในแบบร่างได้:

สมการปฏิกิริยา:

ลองพิจารณาออกซิเดชันของไซโคลเพนทีน
การแตกพันธะคู่ (วงจรเปิด) อะตอมที่ก่อตัวจะถูกออกซิไดซ์จนถึงระดับสูงสุด (ในกรณีนี้คือกลุ่มคาร์บอกซิล):


คุณลักษณะบางประการของการเกิดออกซิเดชันใน Unified State Examination ซึ่งเราไม่เห็นด้วยเลย
เราถือว่า “กฎ” หลักการ และปฏิกิริยาที่จะกล่าวถึงในส่วนนี้ว่าไม่ถูกต้องทั้งหมด พวกเขาขัดแย้งไม่เพียงแต่กับสถานการณ์ที่แท้จริงเท่านั้น (เคมีในฐานะวิทยาศาสตร์) แต่ยังขัดแย้งกับตรรกะภายในด้วย หลักสูตรของโรงเรียนและโดยเฉพาะการสอบ Unified State
อย่างไรก็ตาม เราถูกบังคับให้จัดเตรียมเอกสารนี้ให้ตรงตามแบบฟอร์มที่กำหนดในการสอบ Unified State
เรากำลังพูดถึงเกี่ยวกับการเกิดออกซิเดชันแบบ HARD โดยเฉพาะ
จำได้ไหมว่าน้ำมันเบนซินที่คล้ายคลึงกันและอนุพันธ์ของพวกมันถูกออกซิไดซ์ภายใต้สภาวะที่ไม่เอื้ออำนวยได้อย่างไร อนุมูลทั้งหมดถูกยุติและเกิดหมู่คาร์บอกซิล เศษเหล็กจะเกิดปฏิกิริยาออกซิเดชัน “ด้วยตัวมันเอง”:

ดังนั้น หากจู่ๆ หมู่ไฮดรอกซิลหรือพันธะหลายพันธะปรากฏขึ้นในอนุมูล คุณต้องลืมไปว่ามีวงแหวนเบนซีนอยู่ที่นั่น ปฏิกิริยาจะเป็นไปตามนี้เท่านั้น กลุ่มการทำงาน(หรือการเชื่อมต่อหลายรายการ)
หมู่ฟังก์ชันและพันธะพหุคูณมีความสำคัญมากกว่าวงแหวนเบนซีน

มาดูการออกซิเดชันของสารแต่ละชนิดกัน:
สารแรก:

คุณต้องเพิกเฉยต่อความจริงที่ว่ามีวงแหวนเบนซีน จากมุมมองของการตรวจสอบ Unified State นี่เป็นเพียงแอลกอฮอล์สำรอง แอลกอฮอล์ทุติยภูมิจะถูกออกซิไดซ์เป็นคีโตน แต่คีโตนจะไม่ถูกออกซิไดซ์อีกต่อไป:

ปล่อยให้สารนี้ถูกออกซิไดซ์ด้วยไดโครเมต:

สารที่สอง:

สารนี้ถูกออกซิไดซ์เพียงเป็นสารประกอบที่มีพันธะคู่ (เราไม่ใส่ใจกับวงแหวนเบนซีน):

ปล่อยให้มันออกซิไดซ์ในเปอร์แมงกาเนตที่เป็นกลางเมื่อถูกความร้อน:

อัลคาไลที่เกิดขึ้นนั้นเพียงพอที่จะทำให้คาร์บอนไดออกไซด์เป็นกลางได้อย่างสมบูรณ์:
2KOH + CO 2 → K 2 CO 3 + H 2 O
สมการสุดท้าย:

ออกซิเดชันของสารที่สาม:

ปล่อยให้ออกซิเดชันดำเนินการกับโพแทสเซียมเปอร์แมงกาเนตในสภาพแวดล้อมที่เป็นกรด:

ออกซิเดชันของสารที่สี่:

ปล่อยให้มันออกซิไดซ์ในสภาพแวดล้อมที่มีความเป็นด่างสูง สมการปฏิกิริยาจะเป็น:

และสุดท้าย นี่คือวิธีที่ไวนิลเบนซีนถูกออกซิไดซ์:

และมันจะออกซิไดซ์เป็นกรดเบนโซอิก คุณต้องจำไว้ว่าตามตรรกะของการตรวจสอบ Unified State มันจะออกซิไดซ์ด้วยวิธีนี้ ไม่ใช่เพราะมันเป็นอนุพันธ์ของเบนซีน แต่เพราะมันมีพันธะคู่
บทสรุป.
นั่นคือทั้งหมดที่คุณต้องรู้เกี่ยวกับปฏิกิริยารีดอกซ์ที่เกี่ยวข้องกับเปอร์แมงกาเนตและไดโครเมตในอินทรียวัตถุ
อย่าแปลกใจหากคุณได้ยินประเด็นบางประเด็นที่สรุปไว้ในบทความนี้เป็นครั้งแรก ดังที่ได้กล่าวไปแล้ว หัวข้อนี้กว้างมากและเป็นที่ถกเถียงกัน และถึงกระนั้นก็ตาม ด้วยเหตุผลบางอย่างมันจึงได้รับความสนใจน้อยมาก
ดังที่คุณคงเคยเห็นมาแล้ว ปฏิกิริยาสองหรือสามปฏิกิริยาไม่สามารถอธิบายรูปแบบของปฏิกิริยาเหล่านี้ได้ทั้งหมด ซึ่งต้องใช้แนวทางบูรณาการและคำอธิบายโดยละเอียดทุกประเด็น น่าเสียดายที่ในตำราเรียนและแหล่งข้อมูลทางอินเทอร์เน็ตหัวข้อนี้ยังไม่ครอบคลุมทั้งหมดหรือไม่ครอบคลุมเลย
ฉันพยายามกำจัดข้อบกพร่องและข้อบกพร่องเหล่านี้และพิจารณาหัวข้อนี้โดยรวมไม่ใช่บางส่วน ฉันหวังว่าฉันจะประสบความสำเร็จ
ขอบคุณสำหรับความสนใจ ขอให้โชคดี! ขอให้โชคดีในการเรียนรู้ วิทยาศาสตร์เคมีและสอบผ่าน!
ดังที่ได้กล่าวไปแล้ว การเกิดออกซิเดชันของสารอินทรีย์คือการนำออกซิเจนเข้าสู่องค์ประกอบของสารและ (หรือ) การกำจัดไฮโดรเจน การลดลงเป็นกระบวนการย้อนกลับ (การแนะนำไฮโดรเจนและการกำจัดออกซิเจน) เมื่อคำนึงถึงองค์ประกอบของอัลเคน (СnH2n+2) เราสามารถสรุปได้ว่าพวกมันไม่สามารถมีส่วนร่วมในปฏิกิริยารีดักชัน แต่สามารถมีส่วนร่วมในปฏิกิริยาออกซิเดชันได้
อัลเคนเป็นสารประกอบที่มีสถานะออกซิเดชันของคาร์บอนต่ำ และขึ้นอยู่กับสภาวะของปฏิกิริยา พวกมันสามารถออกซิไดซ์เพื่อสร้างสารประกอบต่างๆ
ที่อุณหภูมิปกติ อัลเคนจะไม่ทำปฏิกิริยาแม้แต่กับสารออกซิไดซ์อย่างแรง (H2Cr2O7, KMnO4 ฯลฯ) เมื่อนำเข้าไปในเปลวไฟ อัลเคนจะไหม้ ในกรณีนี้ เมื่อมีออกซิเจนมากเกินไป จะเกิดออกซิเดชันโดยสมบูรณ์กับ CO2 ซึ่งมีคาร์บอนอยู่ ระดับสูงสุดออกซิเดชัน +4 และน้ำ การเผาไหม้ของไฮโดรคาร์บอนนำไปสู่การแตกร้าวของทุกสิ่ง การเชื่อมต่อ C-Cและ C-H และมาพร้อมกับการปล่อยความร้อนจำนวนมาก (ปฏิกิริยาคายความร้อน)
เป็นที่ยอมรับกันโดยทั่วไปว่ากลไกการออกซิเดชันของอัลเคนเกี่ยวข้องกับกระบวนการลูกโซ่ที่รุนแรง เนื่องจากออกซิเจนนั้นมีปฏิกิริยาได้ไม่ดี เพื่อที่จะแยกอะตอมไฮโดรเจนออกจากอัลเคน จำเป็นต้องมีอนุภาคที่จะเริ่มต้นการก่อตัวของอัลคิลแรดิคัล ซึ่ง จะทำปฏิกิริยากับออกซิเจนทำให้เกิดอนุมูลเปอร์ออกซี เปอร์ออกไซด์เรดิคัลสามารถแยกอะตอมไฮโดรเจนออกจากโมเลกุลอัลเคนอื่นเพื่อสร้างอัลคิลไฮโดรเปอร์ออกไซด์และอนุมูลอิสระ

เป็นไปได้ที่จะออกซิไดซ์อัลเคนด้วยออกซิเจนในบรรยากาศที่อุณหภูมิ 100-150°C เมื่อมีตัวเร่งปฏิกิริยา - แมงกานีสอะซิเตต ปฏิกิริยานี้ใช้ในอุตสาหกรรม ออกซิเดชันเกิดขึ้นเมื่อกระแสอากาศถูกเป่าผ่านพาราฟินหลอมเหลวที่มีเกลือแมงกานีส
เพราะ จากผลของปฏิกิริยาจะเกิดส่วนผสมของกรดขึ้นพวกมันจะถูกแยกออกจากพาราฟินที่ไม่ทำปฏิกิริยาโดยการละลายในด่างที่เป็นน้ำแล้วทำให้เป็นกลางด้วยกรดแร่
ในอุตสาหกรรมโดยตรง วิธีนี้ใช้เพื่อให้ได้กรดอะซิติกจากเอ็น-บิวเทน:
ออกซิเดชันของอัลคีน
ปฏิกิริยาออกซิเดชันของอัลคีนแบ่งออกเป็นสองกลุ่ม: 1) ปฏิกิริยาที่โครงกระดูกคาร์บอนยังคงอยู่ 2) ปฏิกิริยาการทำลายออกซิเดชันของโครงกระดูกคาร์บอนของโมเลกุลที่พันธะคู่
ปฏิกิริยาออกซิเดชันของอัลคีนกับการเก็บรักษาโครงกระดูกคาร์บอน
1. อิพอกซิเดชัน (ปฏิกิริยา Prilezhaev)
อัลคีนแบบอะไซคลิกและไซคลิก เมื่อทำปฏิกิริยากับเพราซิดในสภาพแวดล้อมที่ไม่มีขั้ว จะเกิดเป็นอีพอกไซด์ (ออกซิเรน)
Oxiranes ยังสามารถได้รับโดยการออกซิเดชันของอัลคีนกับไฮโดรเปอร์ออกไซด์โดยมีตัวเร่งปฏิกิริยาที่ประกอบด้วยโมลิบดีนัม- ทังสเตน- และวานาเดียม:

เอทิลีนออกไซด์ที่ง่ายที่สุดนั้นผลิตขึ้นทางอุตสาหกรรมโดยการออกซิเดชันของเอทิลีนกับออกซิเจนโดยมีเงินหรือซิลเวอร์ออกไซด์เป็นตัวเร่งปฏิกิริยา

2. ต่อต้านไฮดรอกซิเลชัน (ไฮโดรไลซิสของอีพอกไซด์)
การไฮโดรไลซิสของกรด (หรืออัลคาไลน์) ของอีพอกไซด์นำไปสู่การเปิดของวงแหวนออกไซด์พร้อมกับการก่อตัวของทรานส์ไดออล

ในระยะแรก อะตอมออกซิเจนของอีพอกไซด์จะถูกโปรตอนเพื่อสร้างไอออนบวกแบบไซคลิกออกโซเนียม ซึ่งจะเปิดขึ้นอันเป็นผลมาจากการโจมตีของนิวคลีโอฟิลิกของโมเลกุลของน้ำ
การเปิดวงแหวนอีพอกซีที่เร่งปฏิกิริยาด้วยเบสยังทำให้เกิดการก่อตัวของทรานส์-ไกลคอลอีกด้วย

3. ซิน-ไฮดรอกซิเลชัน
หนึ่งในวิธีการที่เก่าแก่ที่สุดสำหรับการเกิดออกซิเดชันของอัลคีนคือปฏิกิริยาของวากเนอร์ (การเกิดออกซิเดชันกับโพแทสเซียมเปอร์แมงกาเนต) ขั้นแรก การออกซิเดชั่นจะทำให้เกิดไซคลิกเอสเตอร์ของกรดแมงกานีส ซึ่งไฮโดรไลซ์เป็นไดออลบริเวณแผล:

นอกจากปฏิกิริยาของวากเนอร์แล้ว ยังมีอีกวิธีหนึ่งในการซิงก์ไฮดรอกซิเลชันของอัลคีนภายใต้การกระทำของออสเมียม (VIII) ออกไซด์ซึ่งเสนอโดย Krige เมื่อออสเมียมเตตรอกไซด์ทำปฏิกิริยากับอัลคีนในอีเทอร์หรือไดออกเซน จะเกิดการตกตะกอนสีดำของเอสเทอร์ของกรดออสมิกไซคลิกหรือออสเมต อย่างไรก็ตาม การเติม OsO4 เข้าไปในพันธะพหุคูณจะถูกเร่งอย่างเห็นได้ชัดในไพริดีน ตะกอนออสเมตสีดำที่เกิดขึ้นจะถูกสลายตัวได้ง่ายโดยการกระทำของสารละลายโซเดียมไฮโดรซัลไฟต์ที่เป็นน้ำ:

โพแทสเซียมเปอร์แมงกาเนตหรือออสเมียม (VIII) ออกไซด์จะออกซิไดซ์อัลคีนเป็น cis-1,2-diol
ความแตกแยกออกซิเดชันของอัลคีน
ความแตกแยกออกซิเดชันของอัลคีนรวมถึงปฏิกิริยาของปฏิกิริยากับโพแทสเซียมเปอร์แมงกาเนตในกรดอัลคาไลน์หรือซัลฟิวริกรวมถึงการเกิดออกซิเดชันด้วยสารละลายโครเมียมไตรออกไซด์ในกรดอะซิติกหรือโพแทสเซียมไดโครเมตและกรดซัลฟูริก ผลลัพธ์สุดท้ายของการเปลี่ยนแปลงคือความแตกแยกของโครงกระดูกคาร์บอนบริเวณที่เกิดพันธะคู่และการก่อตัวของกรดคาร์บอกซิลิกหรือคีโตน
อัลคีนที่ถูกทดแทนเดี่ยวที่มีพันธะคู่ที่ปลายถูกตัดออกเป็นกรดคาร์บอกซิลิกและคาร์บอนไดออกไซด์:

หากอะตอมของคาร์บอนทั้งสองอะตอมที่มีพันธะคู่มีหมู่อัลคิลเพียงกลุ่มเดียว ก็จะเกิดส่วนผสมของกรดคาร์บอกซิลิก:

แต่ถ้าอัลคีนเตตร้าแทนที่ด้วยพันธะคู่เป็นคีโตน:

ปฏิกิริยาของโอโซโนไลซิสของอัลคีนมีความสำคัญในการเตรียมการมากกว่ามาก เป็นเวลาหลายทศวรรษแล้วที่ปฏิกิริยานี้เป็นวิธีการหลักในการกำหนดโครงสร้างของอัลคีนต้นกำเนิด ปฏิกิริยานี้ดำเนินการโดยการส่งกระแสของสารละลายโอโซนในออกซิเจนซึ่งเป็นสารละลายของอัลคีนในเมทิลีนคลอไรด์หรือเอทิลอะซิเตตที่ -80 ... -100 ° C กลไกของปฏิกิริยานี้กำหนดโดย Krige:


โอโซนเป็นสารประกอบที่ไม่เสถียรและสลายตัวแบบระเบิดได้ มีสองวิธีในการย่อยสลายโอโซน - ออกซิเดชั่นและรีดักทีฟ
ในระหว่างการไฮโดรไลซิส โอโซนจะถูกแบ่งออกเป็นสารประกอบคาร์บอนิลและไฮโดรเจนเปอร์ออกไซด์ ไฮโดรเจนเปอร์ออกไซด์ออกซิไดซ์อัลดีไฮด์เป็นกรดคาร์บอกซิลิก - นี่คือการสลายตัวแบบออกซิเดชั่น:

ที่สำคัญกว่านั้นมากคือการลดความแตกแยกของโอโซน ผลิตภัณฑ์ของโอโซโนไลซิสคืออัลดีไฮด์หรือคีโตน ขึ้นอยู่กับโครงสร้างของอัลคีนเริ่มต้น:
นอกจากวิธีการข้างต้นแล้ว ยังมีวิธีอื่นที่เสนอในปี 1955 โดย Lemieux:
ในวิธี Lemieux นั้นไม่มีขั้นตอนที่ต้องใช้แรงงานคนมากในการแยกแมงกานีสไดออกไซด์ เนื่องจาก ไดออกไซด์และแมงกาเนตจะถูกออกซิไดซ์อีกครั้งโดยคาเรียเดตไปเป็นไอออนเปอร์แมงกาเนต ซึ่งช่วยให้สามารถใช้โพแทสเซียมเปอร์แมงกาเนตในปริมาณตัวเร่งปฏิกิริยาเท่านั้น
4.5. ออกซิเดชันของอัลคีน
ขอแนะนำให้แบ่งปฏิกิริยาออกซิเดชันของอัลคีนออกเป็นสองกลุ่มใหญ่: ปฏิกิริยาที่โครงกระดูกคาร์บอนถูกเก็บรักษาไว้และปฏิกิริยาการทำลายออกซิเดชันของโครงกระดูกคาร์บอนของโมเลกุลที่พันธะคู่ ปฏิกิริยากลุ่มแรก ได้แก่ อิพอกซิเดชันและไฮดรอกซิเลชัน ซึ่งนำไปสู่การก่อตัวของไวซินัลไดออล (ไกลคอล) ในกรณีของไซคลิกแอลคีน ไฮดรอกซิเลชันจะก่อให้เกิดบริเวณใกล้เคียง ความมึนงง- หรือ ถูกต้อง-ไดออล อีกกลุ่มหนึ่งประกอบด้วยโอโซโนไลซิสและปฏิกิริยาออกซิเดชันแบบละเอียดของอัลคีน ซึ่งนำไปสู่การก่อตัวของสารประกอบคาร์บอนิลและกรดคาร์บอกซิลิกประเภทต่างๆ
4.5.ก. ปฏิกิริยาออกซิเดชันของอัลคีนกับการเก็บรักษาโครงกระดูกคาร์บอน
1. อิพอกซิเดชัน (ปฏิกิริยาโดย N.A. Prilezhaev, 1909)
อัลคีนแบบอะไซคลิกและไซคลิก เมื่อทำปฏิกิริยากับเพราซิด (peracids) RCOOOH ในสภาพแวดล้อมที่ไม่มีขั้วและไม่แยแส จะก่อตัวเป็นอีพอกไซด์ (ออกซีเรน) ดังนั้นปฏิกิริยาในตัวเองจึงเรียกว่าปฏิกิริยาอิพอกซิเดชัน
ตามระบบการตั้งชื่อสมัยใหม่ ไอยูแพค- วงแหวนสามสมาชิกที่มีอะตอมออกซิเจนหนึ่งอะตอมเรียกว่าออกซิเรน
อิพอกซิเดชันของอัลคีนควรได้รับการพิจารณาว่าเป็นกระบวนการซิงโครนัสและประสานงานกัน โดยที่ตัวกลางไอออนิก เช่น ไฮดรอกซิลไอออนบวก OH+ ไม่เข้าร่วม กล่าวอีกนัยหนึ่ง อิพอกซิเดชันของอัลคีนเป็นกระบวนการ ซิน- การยึดอะตอมออกซิเจนหนึ่งอะตอมเข้ากับพันธะคู่โดยคงโครงสร้างขององค์ประกอบทดแทนไว้ที่พันธะคู่ไว้อย่างสมบูรณ์

มีการเสนอลักษณะกลไกของกระบวนการที่ประสานกันสำหรับอิพอกซิเดชัน

เนื่องจากการโจมตีของพันธะคู่โดยอะตอมออกซิเจนของเพราซิดนั้นมีความเป็นไปได้เท่ากันบนทั้งสองด้านของระนาบพันธะคู่ ดังนั้นผลลัพธ์ของออกซิเรนจะเป็นอย่างใดอย่างหนึ่ง เมโส- รูปแบบหรือของผสมของอีแนนทิโอเมอร์ peracids ต่อไปนี้ถูกใช้เป็นสารอิพอกซิไดซ์: เปอร์เบนโซอิก, ม-คลอโรเปอร์เบนโซอิก, โมโนเพอร์ทาลิก, เปอร์อะซิติก, ไตรฟลูออโรเปติก และเพอร์ฟอร์มิก Peracids ของซีรีย์อะโรมาติกถูกใช้ในรูปแบบของรีเอเจนต์แต่ละตัว ในขณะที่ peracids ของซีรีย์อะลิฟาติก - CH 3 CO 3 H, CF 3 CO 3 H และ HCO 3 H จะไม่ถูกแยกแยกกัน แต่จะใช้หลังจากการก่อตัวใน 30 % หรือ 90% อันตรกิริยาระหว่างไฮโดรเจนเปอร์ออกไซด์กับกรดคาร์บอกซิลิกที่เกี่ยวข้อง เปอร์เบนโซอินและ ม-กรดคลอโรเปอร์เบนโซอิกได้มาจากปฏิกิริยาออกซิเดชันของเบนโซอิกและ ม- กรดคลอโรเบนโซอิกที่มีไฮโดรเจนเปอร์ออกไซด์ 70% ในสารละลายของกรดมีเทนซัลโฟนิกหรือจากกรดคลอไรด์ของกรดเหล่านี้และไฮโดรเจนเปอร์ออกไซด์


กรดโมโนเพอร์ทาลิกได้มาจากวิธีการที่คล้ายกันจากทาทาลิกแอนไฮไดรด์และไฮโดรเจนเปอร์ออกไซด์ 30%

เริ่มแรกใช้กรดเปอร์เบนโซอิกหรือโมโนเพอร์ทาลิกเพื่อให้ได้ออกซิเรน (อีพอกไซด์):

ปัจจุบันอีพอกซิเดชันที่ใช้กันมากที่สุดคือ ม-กรดคลอโรเปอร์เบนโซอิก ต่างจากเพราซิดชนิดอื่นๆ ตรงที่สามารถเก็บรักษาไว้ได้นาน (สูงสุด 1 ปี) และปลอดภัยอย่างยิ่งในการจัดการ อัตราผลตอบแทนของออกซิเรนที่ได้จากการออกซิเดชันของอัลคีนแบบอะไซคลิกและไซคลิก ม-กรดคลอโรเปอร์เบนโซอิกในสารละลายเมทิลีนคลอไรด์, คลอโรฟอร์มหรือไดออกเซนมักจะค่อนข้างสูง



เปอร์ซิดมักถูกสร้างขึ้นโดยตรงในส่วนผสมที่ทำปฏิกิริยาของไฮโดรเจนเปอร์ออกไซด์ 90% และกรดคาร์บอกซิลิกในเมทิลีนคลอไรด์


อัลคีนที่มีพันธะคู่คอนจูเกตกับหมู่คาร์บอนิลหรือสารทดแทนตัวรับอื่นๆ จะไม่ทำงาน และสำหรับการเกิดออกซิเดชัน จะดีกว่าถ้าใช้สารออกซิไดซ์ที่แรงกว่า เช่น กรดไตรฟลูออโรเพอร์อะซิติก ที่ได้จากไตรฟลูออโรอะซิติกแอนไฮไดรด์และไฮโดรเจนเปอร์ออกไซด์ 90% ในเมทิลีนคลอไรด์ เอทิลีนออกไซด์ที่ง่ายที่สุด ผลิตขึ้นทางอุตสาหกรรมโดยการออกซิเดชันของเอทิลีนกับออกซิเจนโดยมีเงินเป็นตัวเร่งปฏิกิริยา

2. ต่อต้าน-ไฮดรอกซิเลชัน
วงแหวนออกซีเรนที่มีสมาชิกสามส่วนเปิดออกได้ง่ายภายใต้อิทธิพลของรีเอเจนต์นิวคลีโอฟิลิกหลากหลายชนิด ปฏิกิริยาเหล่านี้จะกล่าวถึงโดยละเอียดในหัวข้อเกี่ยวกับอีเทอร์แบบอะไซคลิกและแบบไซคลิก ในที่นี้จะพิจารณาเฉพาะการไฮโดรไลซิสของออกซิเรนเท่านั้น การไฮโดรไลซิสของออกซิเรนถูกเร่งด้วยทั้งกรดและเบส ในทั้งสองกรณี vicinal diols เช่น glycols จะเกิดขึ้น ในการเร่งปฏิกิริยาด้วยกรด ในระยะแรก อะตอมของออกซิเจนออกซีเรนจะถูกโปรตอนเพื่อสร้างไอออนบวกออกโซเนียมแบบไซคลิก ซึ่งจะเปิดขึ้นอันเป็นผลมาจากการโจมตีของนิวคลีโอฟิลิกของโมเลกุลของน้ำ:

ขั้นตอนสำคัญในการเปิดวงแหวน ซึ่งเป็นตัวกำหนดอัตราของกระบวนการทั้งหมด คือการโจมตีของนิวคลีโอฟิลิกโดยน้ำบนรูปแบบของออกซีเรนที่ถูกโปรตอน ในทางกลไก กระบวนการนี้คล้ายกับการเปิดโบรโมเนียมไอออนจากการโจมตีของนิวคลีโอฟิลิกโดยโบรไมด์ไอออนหรือสารนิวคลีโอฟิลิกอื่นๆ จากตำแหน่งเหล่านี้ ผลลัพธ์ของสเตอริโอเคมีควรเป็นรูปแบบ ความมึนงง-ไกลคอลระหว่างการสลายตัวของไซคลิกอีพอกไซด์ แท้จริงแล้วในระหว่างการไฮโดรไลซิสที่เร่งปฏิกิริยาด้วยกรดของไซโคลเฮกซีนออกไซด์หรือไซโคลเพนทีนออกไซด์โดยเฉพาะ ความมึนงง-1,2-ไดออล

ดังนั้นกระบวนการสองขั้นตอนของอัลคีนอิพอกซิเดชันตามด้วยการไฮโดรไลซิสของกรดของอิพอกไซด์โดยรวมจึงสอดคล้องกับปฏิกิริยา ต่อต้าน- ไฮดรอกซิเลชันของอัลคีน
ทั้งสองขั้นตอน ต่อต้าน- ไฮดรอกซีเลชันของอัลคีนสามารถนำมารวมกันได้หากอัลคีนได้รับการบำบัดด้วยไฮโดรเจนเปอร์ออกไซด์ 30-70% ที่เป็นน้ำในกรดฟอร์มิกหรือกรดไตรฟลูออโรอะซิติก กรดทั้งสองชนิดนี้มีความแข็งแรงพอที่จะทำให้เกิดการเปิดของวงแหวนออกซีเรน

การเปิดวงแหวนออกซีเรนที่เป็นตัวเร่งปฏิกิริยายังทำให้เกิดการก่อตัวของไซคลิกด้วย ความมึนงง-ไกลคอล

ดังนั้นกระบวนการสองขั้นตอนของอิพอกซิเดชันของอัลคีนตามด้วยการไฮโดรไลซิสของอัลคาไลน์ของอีพอกไซด์ก็เป็นปฏิกิริยาเช่นกัน ต่อต้าน- ไฮดรอกซิเลชันของอัลคีน
3. ซิน-ไฮดรอกซิเลชัน
เกลือและออกไซด์บางชนิดของโลหะทรานซิชันในสถานะออกซิเดชันที่สูงกว่าคือรีเอเจนต์ที่มีประสิทธิภาพ ซิน- ไฮดรอกซิเลชันของพันธะคู่ของอัลคีน เมื่อเติมไฮดรอกซิลทั้งสองหมู่เข้าที่ด้านเดียวกันของพันธะคู่ การออกซิเดชันของอัลคีนกับโพแทสเซียมเปอร์แมงกาเนตเป็นหนึ่งในวิธีการที่เก่าแก่ที่สุด ซิน-ไฮดรอกซิเลชันของพันธะคู่ยังคงใช้กันอย่างแพร่หลายแม้ว่าจะมีข้อจำกัดโดยธรรมชาติก็ตาม ซิส-1,2-ไซโคลเฮกเซนไดออลได้รับครั้งแรกโดย V.V. Markovnikov ในปี พ.ศ. 2421 โดยไฮดรอกซิเลชันของไซโคลเฮกซีนด้วยสารละลายโพแทสเซียมเปอร์แมงกาเนตที่เป็นน้ำที่อุณหภูมิ 0 0 C

วิธีการนี้ได้รับการพัฒนาในภายหลังในผลงานของนักวิทยาศาสตร์ชาวรัสเซีย E.E. วากเนอร์ ดังนั้น ซิน-ไฮดรอกซิเลชันของอัลคีนภายใต้การกระทำของสารละลายน้ำของโพแทสเซียมเปอร์แมงกาเนตเรียกว่าปฏิกิริยาวากเนอร์ โพแทสเซียมเปอร์แมงกาเนตเป็นสารออกซิไดซ์ที่แรงซึ่งไม่เพียงแต่สามารถไฮดรอกซีเลตพันธะคู่เท่านั้น แต่ยังแยกไดออลที่เกิดขึ้นออกด้วย เพื่อหลีกเลี่ยงการเสื่อมสลายของไกลคอลเพิ่มเติมให้มากที่สุดเท่าที่จะเป็นไปได้ สภาวะของปฏิกิริยาจะต้องได้รับการควบคุมอย่างระมัดระวัง ผลผลิตของไกลคอลมักจะต่ำ (30-60%) ผลลัพธ์ที่ดีที่สุดเกิดขึ้นได้จากไฮดรอกซิเลชันของอัลคีนในสภาพแวดล้อมที่เป็นด่างเล็กน้อย (pH ~ 8 9) ที่ 0-5 0 C ด้วยสารละลายน้ำ 1% ของ KMnO 4 ที่เจือจาง


ในขั้นแรก การออกซิเดชันของอัลคีนกับโพแทสเซียมเปอร์แมงกาเนตจะทำให้เกิดไซคลิกเอสเตอร์ของกรดแมงกานีส ซึ่งจะถูกไฮโดรไลซ์ทันทีเป็นไดออลใกล้เคียง

ไม่ได้แยกไซคลิกเอสเตอร์ของกรดแมงกานีสเป็นตัวกลาง แต่การก่อตัวของมันตามมาจากการทดลองที่มีป้ายกำกับว่า 18 O โพแทสเซียมเปอร์แมงกาเนต: อะตอมออกซิเจนทั้งสองในไกลคอลจะถูกติดฉลากระหว่างการเกิดออกซิเดชันของอัลคีน KMn 18 O 4 ซึ่งหมายความว่าอะตอมออกซิเจนทั้งสองถูกถ่ายโอนจากตัวออกซิไดซ์และไม่ได้มาจากตัวทำละลาย - น้ำซึ่งสอดคล้องกับกลไกที่นำเสนอ
อีกวิธีหนึ่ง ซิน- ไฮดรอกซิเลชันของอัลคีนภายใต้อิทธิพลของออสเมียม (VIII) ออกไซด์ OsO 4 ถูกเสนอโดย R. Kriege ในปี 1936 ออสเมียมเตตรอกไซด์เป็นสารผลึกไม่มีสี ระเหยง่าย ละลายได้ดีในอีเทอร์ ไดออกเซน ไพริดีน และตัวทำละลายอินทรีย์อื่นๆ เมื่อออสเมียมเตตรอกไซด์ทำปฏิกิริยากับอัลคีนในอีเทอร์หรือไดออกเซน จะเกิดการตกตะกอนสีดำของเอสเทอร์ของกรดออสมิกแบบไซคลิก - ออสเมต ซึ่งสามารถแยกออกได้ง่ายในแต่ละรูปแบบ การเติม OsO 4 ลงในพันธะคู่จะถูกเร่งอย่างเห็นได้ชัดในสารละลายในไพริดีน การสลายตัวของออสเมตไปเป็นไกลคอลในบริเวณใกล้เคียงทำได้โดยการกระทำของสารละลายในน้ำของโซเดียมไฮโดรซัลไฟต์หรือไฮโดรเจนซัลไฟด์

ผลผลิตของผลิตภัณฑ์ ซิน- ไฮดรอกซิเลชันของอัลคีนในวิธีนี้สูงกว่าเมื่อใช้เปอร์แมงกาเนตเป็นสารออกซิไดซ์อย่างมีนัยสำคัญ ข้อได้เปรียบที่สำคัญของวิธี Krige คือการไม่มีผลิตภัณฑ์ที่มีความแตกแยกออกซิเดชันของอัลคีนซึ่งเป็นลักษณะของการเกิดออกซิเดชันของเปอร์แมงกาเนต


ออสเมียมเตตรอกไซด์เป็นสารเคมีที่มีราคาแพงมากและหาซื้อได้ยาก และยังเป็นพิษอีกด้วย ดังนั้นจึงใช้ออสเมียม (VIII) ออกไซด์ในการสังเคราะห์สารที่เข้าถึงยากในปริมาณเล็กน้อยเพื่อให้ได้ไดออลผลผลิตสูงสุด เพื่อให้ง่ายขึ้น ซิน-ไฮดรอกซิเลชันของอัลคีนภายใต้อิทธิพลของ OsO 4 ซึ่งเป็นเทคนิคที่ได้รับการพัฒนาที่ช่วยให้สามารถใช้ตัวเร่งปฏิกิริยาในปริมาณตัวเร่งปฏิกิริยาของรีเอเจนต์นี้เท่านั้น ไฮดรอกซิเลชันของอัลคีนดำเนินการโดยใช้ไฮโดรเจนเปอร์ออกไซด์ต่อหน้า OsO 4 ตัวอย่างเช่น:

เพื่อสรุปส่วนนี้ เราจะนำเสนอความสัมพันธ์เชิงสเตอริโอเคมีระหว่างแอลคีน ถูกต้อง- หรือ ความมึนงง-การกำหนดค่าและการกำหนดค่าของ vicinal diol ที่เป็นผลลัพธ์ซึ่งสามารถเป็นได้ ถูกต้อง- หรือ ความมึนงง-ไอโซเมอร์ เม็ดเลือดแดง- หรือ ทรีโอ-รูปร่าง, เมโส- หรือ ดี,แอล-รูปร่างขึ้นอยู่กับองค์ประกอบทดแทนในแอลคีน:

ความสัมพันธ์ทางสเตอริโอเคมีที่คล้ายกันจะสังเกตได้ในปฏิกิริยาอื่นๆ ซิน- หรือ ต่อต้าน- การเติมพันธะหลายพันธะของไฮโดรเจน ไฮโดรเจนเฮไลด์ น้ำ ฮาโลเจน โบรอนไฮไดรด์ และรีเอเจนต์อื่นๆ
วาดสมการปฏิกิริยารีดอกซ์ที่เกี่ยวข้องกับสารอินทรีย์
ในเนื่องจากการแนะนำเป็นเพียงรูปแบบเดียว การรับรองขั้นสุดท้ายผู้สำเร็จการศึกษา โรงเรียนมัธยมปลายเดี่ยว การสอบของรัฐ(ใช้) และการเปลี่ยนแปลง โรงเรียนมัธยมปลายสำหรับการฝึกอบรมเฉพาะทาง การเตรียมนักเรียนมัธยมปลายให้สำเร็จภารกิจที่ "แพง" ที่สุดในแง่ของคะแนนในส่วน "C" กำลังมีความสำคัญมากขึ้น การทดสอบการสอบแบบรวมรัฐในวิชาเคมี แม้ว่างานทั้งห้าในส่วน C จะถือว่าแตกต่างกัน: คุณสมบัติทางเคมี สารอนินทรีย์, สายโซ่ของการเปลี่ยนแปลงของสารประกอบอินทรีย์, ปัญหาการคำนวณ - ทั้งหมดมีความเกี่ยวข้องกับปฏิกิริยารีดอกซ์ (ORR) โดยเฉพาะ หากคุณเชี่ยวชาญความรู้พื้นฐานของทฤษฎี ODD คุณสามารถทำงานแรกและที่สองให้เสร็จสิ้นได้อย่างถูกต้องและงานที่สาม - บางส่วน
ในความเห็นของเรา ส่วนสำคัญของความสำเร็จในการทำส่วน "C" ให้สำเร็จนั้นอยู่ที่สิ่งนี้ ประสบการณ์แสดงให้เห็นว่าหากในขณะที่เรียนเคมีอนินทรีย์ นักเรียนรับมือกับงานเขียนสมการ OVR ได้ค่อนข้างดี งานที่คล้ายกันในเคมีอินทรีย์ก็จะทำให้เกิดความยากลำบากอย่างมาก ดังนั้นตลอดหลักสูตรเคมีอินทรีย์ในชั้นเรียนเฉพาะทางเราจึงพยายามพัฒนาทักษะในการเขียนสมการ ORR ในนักเรียนมัธยมปลายเมื่อเรียน
ลักษณะเปรียบเทียบ
ของสารประกอบอนินทรีย์และอินทรีย์ เราแนะนำให้นักเรียนรู้จักการใช้สถานะออกซิเดชัน (s.o.) (ในเคมีอินทรีย์ คาร์บอนเป็นหลัก) และวิธีการพิจารณา:
1) การคำนวณค่าเฉลี่ย s.o. คาร์บอนในโมเลกุลของอินทรียวัตถุ
2) คำจำกัดความของ s.o. คาร์บอนแต่ละอะตอม ให้เราชี้แจงว่าในกรณีใดควรใช้วิธีใดวิธีหนึ่งดีกว่าโดดเด่นด้วยการออกแบบที่ทันสมัยและถูกหลักสรีระศาสตร์ รวมถึงความทนทานต่อการสึกหรอ ความทนทาน และความสะดวกสบายสูง จากผลิตภัณฑ์ที่หลากหลายที่นำเสนอในแค็ตตาล็อกบนเว็บไซต์ profkresla.ru คุณสามารถเลือกรุ่นที่เหมาะสมกับสไตล์องค์กรที่นำมาใช้ในบริษัทของคุณมากที่สุด หากคุณยังคงประสบปัญหาในการตัดสินใจ ผู้เชี่ยวชาญของบริษัทพร้อมเสมอที่จะให้คำแนะนำ ช่วยคุณตัดสินใจเกี่ยวกับรุ่น จากนั้นเตรียมโครงการ และดำเนินการวัดผลและการติดตั้งที่จำเป็นทั้งหมด ณ สถานที่ปฏิบัติงาน
ปเมื่อศึกษาหัวข้อ “อัลเคน” เราแสดงให้เห็นว่ากระบวนการออกซิเดชัน การเผาไหม้ ฮาโลเจน ไนเตรชัน ดีไฮโดรจีเนชัน และการสลายตัวเป็นของกระบวนการรีดอกซ์ เมื่อเขียนสมการปฏิกิริยาการเผาไหม้และการสลายตัวของสารอินทรีย์ควรใช้ค่าเฉลี่ยของ so.o คาร์บอน. ตัวอย่างเช่น:
เราให้ความสนใจกับสมดุลของอิเล็กตรอนครึ่งแรก: อะตอมของคาร์บอนมี doo ที่เป็นเศษส่วน ตัวส่วนคือ 4 ดังนั้นเราจึงคำนวณการถ่ายโอนอิเล็กตรอนโดยใช้สัมประสิทธิ์นี้
ในกรณีอื่น เมื่อศึกษาหัวข้อ "อัลเคน" เราจะกำหนดค่าของ do.o อะตอมของคาร์บอนแต่ละอะตอมในสารประกอบ ในขณะที่ดึงความสนใจของนักเรียนไปที่ลำดับการแทนที่อะตอมไฮโดรเจนในอะตอมของคาร์บอนระดับปฐมภูมิ ทุติยภูมิ และตติยภูมิ:


ดังนั้นเราจึงนำนักเรียนไปสู่ข้อสรุปว่า ขั้นแรกกระบวนการทดแทนเกิดขึ้นที่อะตอมของคาร์บอนระดับตติยภูมิ จากนั้นจึงเกิดที่อะตอมของคาร์บอนทุติยภูมิ และสุดท้ายที่อะตอมของคาร์บอนปฐมภูมิ
ปเมื่อศึกษาหัวข้อ "แอลคีน" เราจะพิจารณากระบวนการออกซิเดชันโดยขึ้นอยู่กับโครงสร้างของแอลคีนและสภาพแวดล้อมของปฏิกิริยา
เมื่ออัลคีนถูกออกซิไดซ์ด้วยสารละลายเข้มข้นของโพแทสเซียมเปอร์แมงกาเนต KMnO 4 ในสภาพแวดล้อมที่เป็นกรด (ออกซิเดชันอย่างหนัก) - และ - พันธะจะถูกทำลายด้วยการก่อตัวของกรดคาร์บอกซิลิก คีโตน และคาร์บอนมอนอกไซด์ (IV)
ปฏิกิริยานี้ใช้เพื่อกำหนดตำแหน่งของพันธะคู่

หากพันธะคู่อยู่ที่ส่วนท้ายของโมเลกุล (เช่นในบิวทีน-1) ดังนั้นหนึ่งในผลิตภัณฑ์ออกซิเดชันคือกรดฟอร์มิก ซึ่งออกซิไดซ์ได้ง่ายเป็นคาร์บอนไดออกไซด์และน้ำ:

เราชี้แจงว่าหากโมเลกุลแอลคีนมีความสมมาตรและมีพันธะคู่อยู่ตรงกลางโมเลกุล จะมีกรดเพียงตัวเดียวเท่านั้นที่จะเกิดขึ้นในระหว่างการออกซิเดชัน:

เราขอแจ้งให้คุณทราบว่าคุณลักษณะหนึ่งของการเกิดออกซิเดชันของอัลคีน ซึ่งอะตอมของคาร์บอนที่พันธะคู่ประกอบด้วยอนุมูลคาร์บอน 2 ตัว คือการก่อตัวของคีโตน 2 ตัว:


เมื่อพิจารณาถึงการเกิดออกซิเดชันของอัลคีนในตัวกลางที่เป็นกลางหรือเป็นด่างเล็กน้อย เรามุ่งความสนใจของนักเรียนมัธยมปลายไปที่ความจริงที่ว่าภายใต้เงื่อนไขดังกล่าว การเกิดออกซิเดชันจะมาพร้อมกับการก่อตัวของไดออล (แอลกอฮอล์ไดไฮโดรริก) และหมู่ไฮดรอกซิลจะถูกเพิ่มเข้าไป อะตอมคาร์บอนซึ่งมีการเชื่อมต่อสองครั้ง:

ในในทำนองเดียวกัน เราจะพิจารณาการเกิดออกซิเดชันของอะเซทิลีนและความคล้ายคลึงกัน ขึ้นอยู่กับสภาพแวดล้อมที่กระบวนการเกิดขึ้น ดังนั้นเราจึงชี้แจงว่าในสภาพแวดล้อมที่เป็นกรดกระบวนการออกซิเดชั่นจะมาพร้อมกับการก่อตัวของกรดคาร์บอกซิลิก:

ปฏิกิริยานี้ใช้เพื่อกำหนดโครงสร้างของอัลคีนตามผลิตภัณฑ์ออกซิเดชัน:

ในสภาพแวดล้อมที่เป็นกลางและเป็นด่างเล็กน้อยการเกิดออกซิเดชันของอะเซทิลีนจะมาพร้อมกับการก่อตัวของออกซาเลตที่เกี่ยวข้อง (เกลือของกรดออกซาลิก) และการเกิดออกซิเดชันของความคล้ายคลึงจะมาพร้อมกับการแตกของพันธะสามและการก่อตัวของเกลือของกรดคาร์บอกซิลิก:

ในกฎทั้งหมดได้รับการฝึกฝนกับนักเรียนโดยใช้ตัวอย่างเฉพาะ ซึ่งนำไปสู่การดูดซับเนื้อหาทางทฤษฎีได้ดีขึ้น ดังนั้น เมื่อศึกษาการเกิดออกซิเดชันของ arenes ในสภาพแวดล้อมต่างๆ นักเรียนสามารถตั้งสมมติฐานได้อย่างอิสระว่าควรคาดหวังการก่อตัวของกรดในสภาพแวดล้อมที่เป็นกรด และเกลือในสภาพแวดล้อมที่เป็นด่าง ครูจะต้องชี้แจงเพียงว่าผลิตภัณฑ์ปฏิกิริยาใดที่เกิดขึ้นขึ้นอยู่กับโครงสร้างของเวทีที่เกี่ยวข้อง
เราแสดงตัวอย่างที่คล้ายคลึงกันของเบนซีนที่มีสายโซ่ด้านเดียว (โดยไม่คำนึงถึงความยาวของสายโซ่) ถูกออกซิไดซ์โดยตัวออกซิไดซ์ที่แรงกับกรดเบนโซอิกที่อะตอม -คาร์บอน เมื่อถูกความร้อน สารที่คล้ายคลึงกันของเบนซีนจะถูกออกซิไดซ์โดยโพแทสเซียมเปอร์แมงกาเนตในสภาพแวดล้อมที่เป็นกลางเพื่อสร้างเกลือโพแทสเซียมของกรดอะโรมาติก
5C 6 H 5 –CH 3 + 6KMnO 4 + 9H 2 SO 4 = 5C 6 H 5 COOH + 6MnSO 4 + 3K 2 SO 4 + 14H 2 O,
5C 6 H 5 –C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 = 5C 6 H 5 COOH + 5CO 2 + 12MnSO 4 + 6K 2 SO 4 + 28H 2 O,
C 6 H 5 –CH 3 + 2KMnO 4 = C 6 H 5 ปรุงอาหาร + 2MnO 2 + KOH + H 2 O
เราเน้นย้ำว่าหากมีสายโซ่ด้านข้างหลายสายในโมเลกุลอารีน จากนั้นในสภาพแวดล้อมที่เป็นกรด แต่ละสายจะถูกออกซิไดซ์ที่อะตอมเอคาร์บอนไปยังกลุ่มคาร์บอกซิล ส่งผลให้เกิดกรดอะโรมาติกโพลีเบสิก:

ปทักษะที่ได้รับในการเขียนสมการ ORR สำหรับไฮโดรคาร์บอนทำให้นำไปใช้ในการศึกษาหัวข้อ “สารประกอบที่มีออกซิเจน” ได้
ดังนั้นเมื่อศึกษาหัวข้อ "แอลกอฮอล์" นักเรียนจะเขียนสมการออกซิเดชันของแอลกอฮอล์อย่างอิสระโดยใช้กฎต่อไปนี้:
1) แอลกอฮอล์ปฐมภูมิถูกออกซิไดซ์เป็นอัลดีไฮด์
3CH 3 –CH 2 โอ้ + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 –CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O;
2) แอลกอฮอล์รองจะถูกออกซิไดซ์เป็นคีโตน

3) ปฏิกิริยาออกซิเดชันไม่ใช่เรื่องปกติสำหรับแอลกอฮอล์ระดับตติยภูมิ
เพื่อเป็นการเตรียมความพร้อม การสอบ Unified State สำหรับครูขอแนะนำให้ให้ข้อมูลเพิ่มเติมเกี่ยวกับคุณสมบัติเหล่านี้ซึ่งจะเป็นประโยชน์สำหรับนักเรียนอย่างไม่ต้องสงสัย
เมื่อเมทานอลถูกออกซิไดซ์ด้วยสารละลายที่เป็นกรดของโพแทสเซียมเปอร์แมงกาเนตหรือโพแทสเซียมไดโครเมต CO 2 จะเกิดขึ้น แอลกอฮอล์ปฐมภูมิในระหว่างการออกซิเดชันนั้นไม่เพียงแต่สามารถสร้างอัลดีไฮด์เท่านั้น แต่ยังรวมถึงกรดด้วย ตัวอย่างเช่นการออกซิเดชันของเอทานอลกับโพแทสเซียมไดโครเมตในเย็นจะจบลงด้วยการก่อตัวของกรดอะซิติกและเมื่อถูกความร้อนอะซีตัลดีไฮด์:
3CH 3 –CH 2 โอ้ + 2K 2 Cr 2 O 7 + 8H 2 SO 4 = 3CH 3 –COOH + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O,
3CH 3 –CH 2 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 3CH 3 –CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O.
ขอให้เราเตือนนักเรียนอีกครั้งถึงอิทธิพลของสิ่งแวดล้อมที่มีต่อผลิตภัณฑ์ของปฏิกิริยาออกซิเดชันของแอลกอฮอล์ กล่าวคือ: สารละลายเป็นกลางที่ร้อนของ KMnO 4 ออกซิไดซ์เมทานอลเป็นโพแทสเซียมคาร์บอเนตและแอลกอฮอล์ที่เหลือเป็นเกลือของกรดคาร์บอกซิลิกที่เกี่ยวข้อง:

เมื่อศึกษาหัวข้อ "อัลดีไฮด์และคีโตน" เรามุ่งความสนใจของนักเรียนไปที่ข้อเท็จจริงที่ว่าอัลดีไฮด์จะถูกออกซิไดซ์ได้ง่ายกว่าแอลกอฮอล์ในกรดคาร์บอกซิลิกที่เกี่ยวข้อง ไม่เพียงแต่ภายใต้อิทธิพลของสารออกซิไดซ์ที่แรง (ออกซิเจนในอากาศ สารละลายที่เป็นกรดของ KMnO 4 และ K 2 Cr 2 O 7) แต่และอยู่ภายใต้อิทธิพลของความอ่อนแอ (สารละลายแอมโมเนียของซิลเวอร์ออกไซด์หรือทองแดง (II) ไฮดรอกไซด์):
5CH 3 –CHO + 2KMnO 4 + 3H 2 SO 4 = 5CH 3 –COOH + 2MnSO 4 + K 2 SO 4 + 3H 2 O,
3CH 3 –CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 –COOH + Cr 2 (SO 4) 3 + K 2 SO 4 + 4H 2 O,
CH 3 –CHO + 2OH CH 3 –COONH 4 + 2Ag + 3NH 3 + H 2 O
เราให้ความสนใจเป็นพิเศษกับการเกิดออกซิเดชันของเมธานอลด้วยสารละลายแอมโมเนียของซิลเวอร์ออกไซด์เพราะว่า ในกรณีนี้ จะเกิดแอมโมเนียมคาร์บอเนต ไม่ใช่กรดฟอร์มิก:
HCHO + 4OH = (NH 4) 2 CO 3 + 4Ag + 6NH 3 + 2H 2 O
จากประสบการณ์หลายปีของเรา วิธีการที่เสนอสำหรับการสอนนักเรียนมัธยมปลายถึงวิธีการรวบรวมสมการ ORR ที่เกี่ยวข้องกับสารอินทรีย์ช่วยเพิ่มขั้นตอนสุดท้าย ผลการสอบ Unified Stateในวิชาเคมีไม่กี่จุด







