Permanganat alcan de potasiu în mediu acid. Oxidarea diferitelor clase de compuși organici
Institutul Tehnologic de Stat din Sankt Petersburg
(Universitatea Tehnica)
Departament chimie organică Facultatea 4
Grupa 476
Lucrări de curs
Oxidarea alchenelor
Student………………………………………………………Rytina A.I.
Profesor………………………………... Piterskaya Yu.L.
Sankt Petersburg
Introducere
1.Epoxidare (reacția lui N.A. Prilezhaev, 1909)
2.Hidroxilare
2.1anti-Hidroxilare
2.2sin-Hidroxilare
3. Scindarea oxidativă a alchenelor
4.Ozonoliza
5. Oxidarea alchenelor în prezența sărurilor de paladiu
Concluzie
Lista surselor utilizate
Introducere
Oxidarea este una dintre cele mai importante și comune transformări compuși organici.
În chimia organică, oxidarea se referă la procesele care duc la epuizarea unui compus în hidrogen sau la îmbogățirea acestuia în oxigen. În acest caz, electronii sunt luați din moleculă. Prin urmare, reducerea înseamnă separarea unei molecule de oxigen de o moleculă organică sau adăugarea de hidrogen la aceasta.
În reacțiile redox, agenții de oxidare sunt compuși care au o afinitate mare pentru electroni (electrofili), iar agenții reducători sunt compuși care tind să doneze electroni (nucleofili). Ușurința de oxidare a unui compus crește odată cu nucleofilitatea acestuia.
În timpul oxidării compușilor organici, de regulă, nu există un transfer complet de electroni și, în consecință, nicio schimbare a valenței atomilor de carbon. Prin urmare, conceptul de stare de oxidare - sarcina condiționată a unui atom dintr-o moleculă, calculată pe baza presupunerii că molecula constă numai din ioni - este doar condiționată, de natură formală.
Când se compun ecuații pentru reacțiile redox, este necesar să se determine agentul reducător, agentul de oxidare și numărul de electroni dați și primiți. De regulă, coeficienții sunt selectați folosind metoda echilibrului electron-ion (metoda semireacției).
Această metodă are în vedere transferul de electroni de la un atom sau ion la altul, ținând cont de natura mediului (acid, alcalin sau neutru) în care are loc reacția. Pentru a egaliza numărul de atomi de oxigen și hidrogen, se introduc fie molecule de apă și protoni (dacă mediul este acid), fie molecule de apă și ioni de hidroxid (dacă mediul este alcalin).
Astfel, la scrierea semireacțiilor de reducere și oxidare, trebuie să se procedeze de la compoziția ionilor prezenți efectiv în soluție. Substanțele care se disociază slab, sunt slab solubile sau sunt eliberate sub formă de gaz trebuie scrise în formă moleculară.
Ca exemplu, luați în considerare procesul de oxidare a etilenei cu o soluție apoasă diluată de permanganat de potasiu (reacția Wagner). În timpul acestei reacții, etilena este oxidată la etilenglicol, iar permanganatul de potasiu este redus la dioxid de mangan. Se adaugă doi hidroxili 1 la locul dublei legături:
3C 2 H 4 + 2KMnO 4 +4H 2 O→ 3C 2 H 6 O 2 + 2MnO 2 +2KOH
Semireacția de reducere: MnO 4 ¯ + 2H 2 O + 3 e → MnO 2 + 4OH ¯ 2
Semireacția de oxidare: C 2 H 4 + 2OH − − 2 e → C2H6O23
În sfârșit avem în formă ionică:
2MnO 4 ¯ + 4H 2 O + 3C 2 H 4 + 6OH ¯ → 2MnO 2 + 8OH ¯ + 3C 2 H 6 O 2
După ce facem reducerile necesare de termeni similari, scriem ecuația în formă moleculară:
3C 2 H 4 + 2KMnO 4 + 4 H 2 O = 3C 2 H 6 O 2 + 2MnO 2 + 2KOH.
Caracteristicile unor agenți oxidanți
Oxigen
Oxigenul aerului este utilizat pe scară largă în procesele tehnologice, deoarece este cel mai ieftin agent oxidant. Dar oxidarea de către oxigenul atmosferic este plină de dificultăți asociate cu controlul procesului, care are loc în diferite direcții. Oxidarea se efectuează de obicei la temperatură ridicatăîn prezenţa catalizatorilor.
Ozon
Ozonul O 3 este folosit pentru a produce aldehide și cetone dacă acestea sunt greu de obținut prin alte mijloace. Cel mai adesea, ozonul este folosit pentru a determina structura compușilor nesaturați. Ozonul este produs prin acțiunea unei descărcări electrice liniștite asupra oxigenului. Unul dintre avantajele semnificative ale ozonării, în comparație cu clorarea, este absența toxinelor după tratamentul 2.
Permanganat de potasiu
Permanganatul de potasiu este cel mai des folosit agent oxidant. Reactivul este solubil în apă (6,0% la 20ºС), precum și în metanol, acetonă și acid acetic. Pentru oxidare se folosesc soluții apoase (uneori acetonă) de KMnO 4 într-un mediu neutru, acid sau alcalin. La efectuarea procesului în mediu neutru La masa de reacție se adaugă săruri de magneziu și aluminiu sau se trece dioxid de carbon pentru a neutraliza hidroxidul de potasiu eliberat în timpul reacției. Reacția de oxidare a KMnO 4 într-un mediu acid se realizează cel mai adesea în prezența acidului sulfuric. Un mediu alcalin în timpul oxidării este creat de KOH format în timpul reacției sau este adăugat inițial la masa de reacție. În medii ușor alcaline și neutre, KMnO 4 se oxidează conform ecuației:
KMnO4+ 3 e+ 2H2O = K + + MnO2 + 4OH ¯
într-un mediu acid:
KMnO4+ 5 e+ 8H + = K + + Mn2+ + 4H2O3
Permanganatul de potasiu este utilizat pentru a obține 1,2-dioli din alchene, în oxidarea alcoolilor primari, aldehidelor și alchilarenelor la acizi carboxilici, precum și pentru scindarea oxidativă a scheletului de carbon la legături multiple.
În practică, se utilizează de obicei un exces destul de mare (mai mult de 100%) de KMnO4. Acest lucru se explică prin faptul că în condiții normale KMnO 4 se descompune parțial în dioxid de mangan odată cu eliberarea de O 2 . Se descompune exploziv cu H2SO4 concentrat atunci când este încălzit în prezența agenților reducători; amestecurile de permanganat de potasiu cu substanțe organice sunt de asemenea explozive 4.
Peracide
Acizii peracetic și performic se prepară prin reacția 25-90% peroxid de hidrogen cu acidul carboxilic corespunzător, conform următoarei reacții:
RCOOH + H2O2 = RCOOH + H2O
În cazul acidului acetic, acest echilibru se stabilește relativ lent, iar pentru a accelera formarea peracidului se adaugă de obicei acid sulfuric ca catalizator. Acidul formic este suficient de puternic singur pentru a asigura un echilibru rapid.
Acidul pertrifluoracetic, obținut în amestec cu acidul trifluoracetic prin reacția anhidridei trifluoracetice cu peroxid de hidrogen 90%, este un agent oxidant și mai puternic. Acidul peracetic poate fi preparat într-un mod similar din anhidridă acetică și peroxid de hidrogen.
Deosebit de popular este greu m-acidul cloroperbenzoic, deoarece este relativ sigur de manevrat, este destul de stabil și poate fi depozitat pentru o lungă perioadă de timp.
Oxidarea are loc datorită eliberării unui atom de oxigen:
RCOOH = RCOOH + [O]
Peracizii sunt utilizați pentru a obține epoxizi din alchene, precum și lactone din cetone aliciclice.
Peroxid de hidrogen
Peroxidul de hidrogen este un lichid incolor care se amestecă cu apă, etanol și dietil eter. O soluție 30% de H 2 O 2 se numește perhidrol. Medicamentul foarte concentrat poate reacționa exploziv cu substanțele organice. În timpul depozitării, se descompune în oxigen și apă. Stabilitatea peroxidului de hidrogen crește odată cu diluarea. Pentru oxidare se folosesc soluții apoase de diferite concentrații (de la 3 la 90%) în medii neutre, acide sau alcaline.
H2O2 = H2O + [O]
Prin acțiunea acestui reactiv asupra compușilor carbonilici α,β-nesaturați în mediu alcalin se obțin aldehidele epoxidice și cetonele corespunzătoare, iar peracizii sunt sintetizați prin oxidarea acizilor carboxilici în mediu acid. O soluție de 30% de H 2 O 2 în acid acetic oxidează alchenele în 1,2-dioli. Peroxidul de hidrogen este utilizat: pentru producerea de peroxizi organici și anorganici, perborat și percarbonat de Na; ca agent oxidant în combustibilii pentru rachete; în producerea de epoxizi, hidrochinonă, pirocatechină, etilen glicol, glicerină, acceleratori de vulcanizare ai grupării tioramului etc.; pentru albire uleiuri, grăsimi, blană, piele, materiale textile, hârtie; pentru purificarea materialelor semiconductoare cu germaniu și siliciu; ca dezinfectant pentru neutralizarea apelor uzate menajere si industriale; în medicină; ca sursă de O 2 în submarine; H 2 O 2 face parte din reactivul Fenton (Fe 2 + + H 2 O 2), care este folosit ca sursă de radicali liberi OH în sinteza organică 5 .
Tetroxizi de ruteniu și osmiu
Tetroxidul de osmiu OsO4 este o pulbere albă până la galben pal, cu un p.t. 40,6ºС; t. balot 131,2ºС. Sublimează deja la temperatura camerei, solubil în apă (7,47 g în 100 ml la 25ºС), CCl 4 (250 g în 100 g solvent la 20ºС). În prezența compușilor organici devine negru datorită reducerii la OsO 2 6 .
RuO 4 este o prismă galben-aurie cu un mp. 25,4ºС, sublimează vizibil la temperatura camerei. Moderat solubil în apă (2,03 g în 100 ml la 20ºС), foarte solubil în CCl 4. Un agent oxidant mai puternic decât OsO4. Peste 100ºС explodează. La fel ca tetroxidul de osmiu, este foarte toxic și scump.
Acești agenți oxidanți sunt utilizați pentru oxidarea alchenelor la α-glicoli în condiții blânde.
Dioxiranele
Cele mai utilizate sunt dimetildioxiranul și metil(trifluormetil)dioxiranul.

Cel mai adesea se prepară dioxiranele în situ din cetonele corespunzătoare și KHSO 5 (sau K 2 SO 4 KHSO 4 2KHSO 5 (oxonă)) într-un mediu ușor alcalin 7:
Dioxiranii se caracterizează printr-o reactivitate ridicată, combinată cu o bună selectivitate, și sunt utilizați pentru oxidarea legăturilor C–H neactivate în alcani, la prepararea epoxizilor din alchene, pentru oxidarea aminelor, oximelor, sulfurilor, sulfoxizilor etc. .
Oxidarea alchenelor poate avea loc în mai multe direcții:
1) cu conservarea scheletului de carbon al moleculei; Așa procedează epoxidarea și hidroxilarea dublei legături, ducând la formarea de glicoli trans- sau cis- vicinali.
2) cu ruperea dublei legături; Așa procedează ozonoliza și oxidarea exhaustivă a alchenelor, ducând la formarea diferitelor tipuri de compuși carbonilici și acizi carboxilici.
În funcție de tipul de oxidare, se folosesc diverși agenți de oxidare
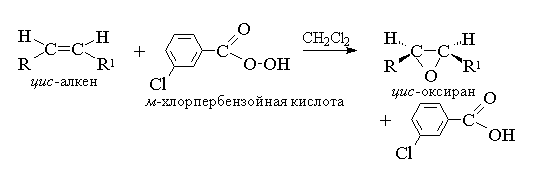
1. Epoxidarea(reacția lui N.A. Prilezhaev, 1909)
Alchenele aciclice și ciclice, atunci când reacţionează cu peracizii (peracizii) RCOOOH într-un mediu nepolar, indiferent, formează epoxizi (oxirani), prin urmare reacția în sine se numește reacție de epoxidare.

Conform nomenclaturii moderne IUPAC- un inel cu trei membri cu un atom de oxigen se numeste oxiran.
Epoxidarea alchenelor ar trebui să fie considerată ca un proces sincron, coordonat, în care intermediarii ionici, cum ar fi cationul hidroxil OH+, nu participă. Cu alte cuvinte, epoxidarea alchenelor este un proces sin- atașarea unui atom de oxigen la o legătură dublă cu păstrarea completă a configurației substituenților la legătura dublă. 8

Pentru epoxidare a fost propus un mecanism caracteristic proceselor concertate.

Deoarece atacul dublei legături de către atomul de oxigen al peracidului este la fel de probabil pe ambele părți ale planului dublei legături, oxiranii rezultați sunt fie mezo-forme, sau amestecuri de enantiomeri. Următorii peracizi sunt utilizați ca agenți de epoxidare: perbenzoic, m-cloroperbenzoic, monoperftalic, peracetic, trifluoroperacetic și performic. Peracizii din seria aromatică sunt utilizați sub formă de reactivi individuali, în timp ce peracizii din seria alifatică - CH 3 CO 3 H, CF 3 CO 3 H și HCO 3 H nu sunt izolați în formă individuală, și sunt utilizate după formarea lor prin interacțiunea dintre peroxid de hidrogen 30% sau 90% și acidul carboxilic corespunzător. Perbenzoina și m-acidul cloroperbenzoic se obţine prin oxidarea benzoicului şi m-acizi clorobenzoici cu peroxid de hidrogen 70% intr-o solutie de acid metansulfonic sau din clorurile acide ale acestor acizi si peroxid de hidrogen.


Acidul monoperftalic se obține printr-o metodă similară din anhidridă ftalică și peroxid de hidrogen 30%.

În prezent, acidul monoperoxiftalic sub formă de sare de Mg este utilizat pe scară largă. Acest reactiv poate fi utilizat în amestecuri de solvenți organici cu apă 9 .
Inițial, acizii perbenzoici sau monoperftalici 10 au fost utilizați pentru a obține oxirani (epoxizi):

În prezent, cel mai frecvent utilizat pentru epoxidare este m-acidul cloroperbenzoic. Spre deosebire de alți peracizi, este stabil la raft pentru o lungă perioadă de timp (până la 1 an) și este absolut sigur de manipulat. Randamentele de oxirani obținute din oxidarea alchenelor aciclice și ciclice m-acidul cloroperbenzoic într-o soluție de clorură de metilen, cloroform sau dioxan sunt de obicei destul de mari 11.



Peracizii sunt adesea generați direct într-un amestec de reacție de 90% peroxid de hidrogen și acid carboxilic în clorură de metilen.

Alchenele cu o legătură dublă conjugată cu o grupare carbonil sau alt substituent acceptor sunt inactive și pentru oxidarea lor este mai bine să se folosească agenți oxidanți mai puternici, precum acidul trifluoroperacetic, obținut din anhidrida trifluoracetică și peroxid de hidrogen 90% în clorură de metilen. Acizii peroxicarboximidici RC(NH)OOH sunt produși intermediari instabili formați în reacțiile nitrililor cu soluții alcaline de peroxid de hidrogen 12:
Cel mai simplu oxiran, oxidul de etilenă, este produs industrial prin oxidarea etilenei cu oxigen în prezența argintului ca catalizator 13.

2.Hidroxilare
Sunt cunoscuți o serie de reactivi oxidanți, cu ajutorul cărora, în condiții blânde, este posibilă adăugarea a două grupări hidroxil la alchene.
Reacția de hidroxilare a alchenelor, care are loc sub influența unei soluții reci de permanganat de potasiu și este însoțită de decolorarea acesteia, este cunoscută sub numele de reacția Wagner (1888). În prezent, are puțină utilizare sintetică, deoarece este însoțită de formarea unui număr semnificativ de produse secundare. Cu toate acestea, această reacție poate fi utilizată atunci când se studiază structura unui compus organic ca test calitativ pentru o legătură dublă. Hidroxilarea ciclohexenei prin acțiunea unei soluții apoase de permanganat de potasiu la rece a fost efectuată mai întâi de V.V. Markovnikov. În prezent, oxidul de osmiu (VIII) este cel mai des utilizat pentru hidroxilarea alchenelor (reacția Krige, 1936) 14.
Tetroxidul de osmiu OsO 4 este o substanță cristalină incoloră care se topește la 40 o C și este ușor solubilă în eter. Când ciclohexena este oxidată cu o soluție eterică a acestui reactiv, se eliberează un precipitat negru, care este un ester ciclic al acidului osmic I 15:
Un eter se formează prin deschiderea simultană a dublei legături carbon-carbon a unei alchene și a două legături duble de oxid de metal. Acest ester este apoi hidrolizat folosind sulfit de sodiu ca catalizator. Produsul de hidroliză este cis-ciclohexandiol-1,2(II), ai cărui hidroxili sunt localizați în regiunea β, adică. în față, iar hidrogenii în regiunea α, adică. din spatele.
2.1 anti-Hidroxilare
Inelul cu trei membri al oxiranilor se deschide cu ușurință sub influența unei game largi de reactivi nucleofili. Hidroliza oxiranilor este catalizată atât de acizi, cât și de baze. În ambele cazuri, se formează dioli vicinali, adică glicoli. În cataliza acidă, în prima etapă, atomul de oxigen oxiran este protonat pentru a forma un cation ciclic de oxoniu, care se deschide ca urmare a atacului nucleofil al moleculei de apă 16:

Etapa cheie în deschiderea inelului, care determină viteza întregului proces, este atacul nucleofil al apei asupra formei protonate a oxiranului. Din punct de vedere mecanic, acest proces este similar cu deschiderea unui ion de bromoniu la atacul nucleofil de către un ion de bromură sau alt agent nucleofil. Din aceste poziții, rezultatul stereochimic ar trebui să fie formarea transă-glicoli în timpul descompunerii epoxizilor ciclici. Într-adevăr, în timpul hidrolizei catalizate de acid a oxidului de ciclohexenă sau a oxidului de ciclopentenă, exclusiv transă-1,2-dioli.
Astfel, procesul în două etape de epoxidare alchenei urmat de hidroliza acidă a epoxidului corespunde reacției. anti-hidroxilarea alchenelor.
Ambele etape anti-hidroxilarea alchenelor poate fi combinată dacă alchena este tratată cu apă oxigenată 30-70% în acid formic sau trifluoracetic. Ambii acești acizi sunt suficient de puternici pentru a provoca deschiderea inelului oxiran.

Deschiderea catalizată de bază a inelului oxiran conduce, de asemenea, la formarea ciclicului transă-glicoli.
Prin urmare, procesul în două etape de epoxidare a alchenelor urmat de hidroliza alcalină a epoxizilor este, de asemenea, o reacție. anti-hidroxilarea alchenelor.
2.2 sin-Hidroxilare
Unele săruri și oxizi ai metalelor de tranziție în stări de oxidare superioare sunt reactivi eficienți sin-hidroxilarea dublei legături a unei alchene, când ambele grupări hidroxil sunt adăugate pe aceeași parte a dublei legături. Oxidarea alchenelor cu permanganat de potasiu este una dintre cele mai vechi metode sin-hidroxilarea unei duble legături continuă să fie utilizată pe scară largă în ciuda limitărilor sale inerente. Cis-1,2-ciclohexandiolul a fost obținut pentru prima dată de V.V. Markovnikov în 1878 prin hidroxilarea ciclohexenei cu o soluție apoasă de permanganat de potasiu la 0 0 C.

Această metodă a fost dezvoltată ulterior în lucrările savantului rus E.E. Wagner, deci sin-hidroxilarea alchenelor sub actiunea unei solutii apoase de permanganat de potasiu se numeste reactie Wagner. Permanganatul de potasiu este un agent oxidant puternic care poate nu numai hidroxila legătura dublă, ci și scinda diolul vicinal rezultat. Pentru a evita pe cât posibil degradarea ulterioară a glicolilor, condițiile de reacție trebuie controlate cu atenție. Randamentele de glicoli sunt de obicei scăzute (30-60%). Cele mai bune rezultate se realizează prin hidroxilarea alchenelor într-un mediu ușor alcalin (pH ~ 8 9) la 0-5 0 C cu o soluție apoasă diluată 1% de KMnO 4 17.


Inițial, oxidarea alchenelor cu permanganat de potasiu produce un ester ciclic al acidului mangan, care este imediat hidrolizat la un diol vicinal.

Esterul ciclic al acidului mangan ca intermediar nu a fost izolat, dar formarea sa rezultă din experimente cu permanganat de potasiu marcat 18 O: ambii atomi de oxigen din glicol se dovedesc a fi marcați în timpul oxidării alchenei KMn 18 O 4. Aceasta înseamnă că ambii atomi de oxigen sunt transferați de la agentul de oxidare, și nu de la solvent - apă, ceea ce este în acord cu mecanismul propus.
O altă metodă sin-hidroxilarea alchenelor sub influența oxidului de osmiu (VIII) OsO 4 a fost propusă de R. Kriege în 1936. Tetroxidul de osmiu este o substanță incoloră, volatilă, cristalină, foarte solubilă în eter, dioxan, piridină și alți solvenți organici. Când tetroxidul de osmiu reacționează cu alchenele din eter sau dioxan, se formează un precipitat negru de ester ciclic al acidului osmic - osmat, care poate fi izolat cu ușurință sub formă individuală. Adăugarea de OsO4 la legătura dublă este vizibil accelerată în soluție în piridină. Descompunerea osmaților în glicoli vicinali se realizează prin acțiunea unei soluții apoase de hidrosulfit de sodiu sau hidrogen sulfurat.

Randamentele produsului sin-hidroxilarea alchenelor în această metodă este semnificativ mai mare decât atunci când se utilizează permanganat ca agent de oxidare. Un avantaj important al metodei Krige este absența produselor de scindare oxidativă a alchenelor, care este caracteristică oxidării permanganatului 18.
 19
19

Tetroxidul de osmiu este un reactiv foarte scump și greu de obținut și este, de asemenea, toxic. Prin urmare, oxidul de osmiu (VIII) este utilizat în sinteza unor cantități mici de substanțe greu accesibile pentru a obține cel mai mare randament de diol. Pentru a simplifica sin-hidroxilarea alchenelor sub influența OsO 4, s-a dezvoltat o tehnică care permite utilizarea doar a cantităților catalitice din acest reactiv. Hidroxilarea alchenelor se realizează folosind peroxid de hidrogen în prezența OsO4, de exemplu:

În concluzie, putem da relațiile stereochimice dintre alchenă cis- sau transă-configuraţia şi configuraţia diolului vicinal rezultat, care poate fi cis- sau transă-izomer, eritro- sau trio-formă, mezo- sau D,L-formă în funcție de substituenții din alchena 20:

Relații stereochimice similare sunt observate în alte reacții sin- sau anti- adăugarea la legături multiple de hidrogen, halogenuri de hidrogen, apă, halogeni, hidruri de bor și alți reactivi.
3. Clivaj oxidativ alchene
În timpul oxidării alchenelor cu o soluție apoasă alcalină de permanganat de potasiu la încălzire sau cu o soluție de KMnO 4 în acid sulfuric apos, precum și în timpul oxidării alchenelor cu o soluție de oxid de crom (VI) CrO 3 în acid acetic sau dicromat de potasiu și acid sulfuric, glicolul format inițial suferă distrugere oxidativă. Rezultatul final este scindarea scheletului de carbon la locul dublei legături și formarea de cetone și/sau acizi carboxilici ca produse finali, în funcție de substituenții de pe legătura dublă. Dacă ambii atomi de carbon de la legătura dublă conțin doar o grupă alchil, produsul final al oxidării exhaustive va fi un amestec de acizi carboxilici, alchena tetrasubstituită la legătura dublă este oxidată la două cetone. Alchenele monosubstituite cu o legătură dublă terminală sunt scindate la acid carboxilic și dioxid de carbon 21.

 22
22
Datorită randamentelor scăzute de acizi carboxilici și cetone, reacțiile de oxidare exhaustivă a alchenelor în versiunea clasică nu și-au găsit aplicație largă și au fost utilizate anterior în principal pentru a determina structura alchenei inițiale din produsele oxidării distructive. În prezent, oxidarea alchenelor (R-CH=CH-R și R-CH=CH2) la acizi carboxilici (RCOOH) folosind permanganat sau dicromat de potasiu se realizează sub cataliza de transfer de fază. Randamentele de acizi carboxilici depășesc 90%.

4. Ozonoliza alchenelor
Reacția alchenelor cu ozonul este cea mai importantă metodă de scindare oxidativă a alchenelor la dubla legătură. Timp de multe decenii, această reacție a servit ca metodă principală pentru determinarea structurii hidrocarburii inițiale și a găsit, de asemenea, utilizarea în sinteza diferiților compuși carbonilici. Reacția unei alchene cu ozonul se realizează prin trecerea unui curent de ~5% amestec de ozon și oxigen într-o soluție de alchenă în clorură de metilen sau acetat de etil la -80 0 -100 0 C. Finalizarea reacției este controlat printr-un test pentru ozon liber cu iodură de potasiu. Mecanismul acestei reacții ciudate și complexe a fost stabilit în principal datorită muncii lui Krige. Primul produs al cicloadiției 1,3-dipolare la o legătură dublă este așa-numita moliozonidă (1,2,3-trioxolan). Acest produs este instabil și se descompune în continuare spontan cu deschiderea inelului și formarea de ozonidă normală (1,2,4-trioxolan) 23 ca produs final.
 24
24
Acum este general acceptat că transformarea molozonidei în ozonidă obișnuită are loc prin mecanismul de scindare - recombinare. Molozonida suferă deschiderea spontană a inelului instabil 1,2,3-trioxolan pentru a forma un compus carbonil și un ion bipolar, care reacţionează apoi unul cu celălalt, de asemenea, conform schemei de cicloadiție 1,3-dipolară.

Schema de mai sus pentru rearanjarea molozonidei într-o ozonidă normală este confirmată de faptul că, dacă, înainte de formarea completă a ozonidei, un alt compus carbonil este prezent în amestecul de reacție ca „interceptor” al ionului bipolar, atunci -se formează numita „ozonidă mixtă”. De exemplu, cu ozonilizare cis-stilben în prezența benzaldehidei marcate cu izotopul 18 O, eticheta face parte mai degrabă din eter decât din puntea de peroxid a ozonidei:
Acest rezultat este în acord cu formarea unei ozonide mixte la recombinarea unui ion bipolar cu benzaldehida marcată:

Ozonidele sunt compuși foarte instabili care se descompun exploziv. Ele nu sunt izolate individual, ci sunt defalcate prin acțiunea unei largi varietati de regenți. Este necesar să se facă distincția între clivajul reductiv și oxidativ. În timpul hidrolizei, ozonidele se descompun încet în compuși carbonilici și peroxid de hidrogen. Peroxidul de hidrogen oxidează aldehidele în acizi carboxilici. Aceasta este așa-numita descompunere oxidativă a ozonidelor:

Astfel, în timpul descompunerii oxidative a ozonidelor, acizi carboxiliciși (sau) cetone, în funcție de structura alchenei inițiale. Ca agenți oxidanți pot fi utilizați oxigenul aerului, peroxidul de hidrogen, peracizii sau hidroxidul de argint. Cel mai adesea în practica sintetică, în acest scop sunt utilizate peroxid de hidrogen în acid acetic sau formic, precum și peroxid de hidrogen într-un mediu alcalin.


În practică, metoda de descompunere oxidativă a ozonidelor este utilizată în principal pentru obținerea acizilor carboxilici.
Scindarea reductivă a ozonidelor este mai importantă. Cei mai des utilizați agenți reducători sunt zincul și acidul acetic, trifenilfosfina sau sulfura de dimetil. În acest caz, produșii finali ai ozonolizei sunt aldehide sau cetone, în funcție de structura alchenei originale.


 25
25
Din exemplele de mai sus este clar că o alchenă tetrasubstituită la legătura dublă în timpul ozonolizei și descompunere reductivă ulterioară a ozonidei formează două cetone, în timp ce o alchenă trisubstituită dă o cetonă și o aldehidă. O alchenă simetrică disubstituită produce două aldehide în timpul ozonolizei, iar alchenele cu o legătură terminală formează o aldehidă și o formaldehidă.
O modificare interesantă a ozonolizei este o metodă în care borohidrură de sodiu este utilizată ca agent de reducere a ozonidei. În acest caz, produșii finali de reacție sunt alcooli primari sau secundari formați în timpul reducerii aldehidelor și, respectiv, a xtonelor 26 .


Ozonoliza alchenelor este un proces complex, care necesită forță de muncă și exploziv, care necesită utilizarea unor echipamente speciale. Din acest motiv, au fost dezvoltate și alte metode pentru scindarea oxidativă a alchenelor în compuși carbonilici și acizi carboxilici, care înlocuiesc cu succes reacția de ozonoliză în practica sintetică.
Una dintre metodele moderne de preparare pentru distrugerea oxidativă a alchenelor a fost propusă în 1955 de R. Lemieux. Această metodă se bazează pe hidroxilarea alchenelor cu permanganat de potasiu, urmată de scindarea glicolului vicinal cu periodat de sodiu NaIO 4 la pH ~ 7 8. Periodatul în sine nu reacționează cu alchena. Produșii acestui clivaj oxidativ în două etape sunt cetone sau acizi carboxilici, deoarece aldehidele sunt, de asemenea, oxidate la acizi carboxilici în aceste condiții. În metoda lui Lemieux, problema lungă a separării unuia dintre produșii de reacție, dioxidul de mangan, nu se pune, deoarece atât dioxidul, cât și manganatul sunt din nou oxidați de periodat la ionul permanganat. Acest lucru permite utilizarea numai a cantităților catalitice de permanganat de potasiu. Mai jos sunt câteva exemple tipice de scindare oxidativă a alchenelor folosind metoda Lemieux.

Citronelolul, un alcool care se găsește în uleiul de trandafir, uleiul de mușcate și uleiul de lămâie, este oxidat printr-un amestec de permanganat de potasiu și periodat de sodiu în acetonă apoasă la 5–10 0 C până la acid 6-hidroxi-4-metilhexancarboxilic cu un randament cantitativ.

Într-o altă variantă a acestei metode, sunt utilizate cantități catalitice de tetroxid de osmiu în loc de permanganat de potasiu (Lemieux și Johnson 1956). Un avantaj special al combinației de OsO4 și NaIO4 este că vă permite să opriți oxidarea în stadiul de aldehidă. Tetroxidul de osmiu se adaugă la dubla legătură a unei alchene pentru a forma osmatul, care este oxidat de periodatul de sodiu în compuși carbonilici pentru a regenera tetroxidul de osmiu.

În loc de tetroxid de osmiu, se poate folosi și tetroxid de ruteniu RuO4. Distrugerea oxidativă a alchenelor conform lui Lemieux-Johnson duce la aceiași produși ca și ozonoliza cu scindare reductivă a ozonidelor.

În termeni caracteristici chimiei organice moderne, aceasta înseamnă că combinația OsO 4 -NaIO 4 este echivalent sintetic reacții de ozonoliză a alchenelor urmate de scindare reductivă. De asemenea, oxidarea alchenelor cu un amestec de permanganat și periodat este echivalentul sintetic al ozonolizei cu descompunerea oxidativă a ozonidelor.
Astfel, oxidarea alchenelor nu este doar un set de metode de preparare pentru prepararea alcoolilor, epoxizilor, diolilor, aldehidelor, cetonelor și acizilor carboxilici, este și una dintre modalitățile posibile de determinare a structurii alchenei originale. Astfel, în funcție de rezultatul distrugerii oxidative a unei alchene, se poate determina poziția dublei legături în moleculă, în timp ce rezultatul stereochimic sin- sau anti- hidroxilarea unei alchene ne permite să tragem concluzii despre geometria acesteia.
5. Oxidarea alchenelor în prezența sărurilor de paladiu
O cantitate semnificativă de cercetări a fost dedicată oxidării alchenelor în compuși carbonilici folosind clorură de paladiu, în principal datorită importanței industriale a reacției de producere a acetaldehidei din etilenă (procesul Wacker). În timpul oxidării, clorura de paladiu este redusă la paladiu, proces care ar fi de interes limitat dacă nu ar fi faptul că clorura de paladiu scumpă poate fi utilizată în cantități catalitice în prezența unui al doilea agent oxidant, cel mai adesea clorura de cupru(II). , care oxidează paladiu în paladiu (II), el însuși fiind redus la cupru (I) Reoxidarea cuprului (I) în cupru (II) poate fi efectuată cu oxigen atmosferic, astfel că procesul general este foarte atractiv ca metodă de oxidare industrială. 27 .
Etilena este ușor oxidată la acetaldehidă 28:
Mecanismul propus 29:
Reacția are loc într-un mediu acid, nu este însoțită de o modificare a numărului de atomi de carbon din molecula de etilenă și este în prezent principala sursă de acetaldehidă în industrie.
Oxidarea omologilor de etilenă în aceleași condiții are loc la cel mai puțin atom de carbon hidrogenat al dublei legături cu formarea cetonelor. În special, oxidarea propenei produce acetonă, iar oxidarea ciclohexenei produce ciclohexanona.
Concluzie
Reacția de oxidare este un grup important de reacții cu duble legătură. În general, reacțiile de oxidare ocupă un loc special în chimia organică. Atunci când se iau în considerare aceste reacții, este necesar să se țină seama nu numai de natura compusului organic care se oxidează, ci și de natura agentului de oxidare, de prezența sau absența unui catalizator, de mediul în care are loc reacția etc.
Prin urmare, trebuie să vă amintiți foarte des de agenții oxidanți și condițiile de utilizare a acestora pentru a obține produsul de oxidare dorit. De exemplu, reacția de oxidare a alchenelor cu o soluție diluată de permanganat de potasiu duce la formarea de dioli (glicoli), în timp ce o soluție concentrată de permanganat de potasiu rupe molecula de alchenă la dubla legătură cu formarea de produse care conțin oxigen. Astfel, același agent oxidant în medii diferite dă produși de oxidare diferiți.
Dintre reacțiile de oxidare, reacția de ozonare pe care am considerat-o este considerată cea mai importantă, ceea ce ne permite să determinăm structura alchenei originale din produsele finite. În această lucrare au fost trecute în revistă principalele reacții de oxidare ale alchenelor și catalizatorii care sunt utilizați în timpul proceselor de oxidare.
Lista surselor folosite:
1) Reutov O. A. Chimie organică În 4 părți. 1.-M.:BINOM. Laboratorul de cunoștințe, 2004.-567 p.
2) Remy G. Curs de chimie anorganică. T. 1. M.: Editura Literatură străină, 1963. – 920 p.
3) Kazakov D.V., Voloshin A.I., Kazakov V.P., Shereshchovets V.V., Kabalnova N.N. Chimia și chemiluminiscența dioxiranilor. M.: Nauka, 1999
4) Traven V.F . Chimie organică: Manual pentru universități: 2 volume / V.F. Traven. - M.: ICC „Akademkniga”, 2004. - T. 1
5) Haynes A. Metode de oxidare a compuşilor organici. Alcani, alchene, alchine și arene. M.: Mir, 1988.
6) Morrison R., Boyd R. „Chimie organică” M.: Mir, 1974
7) Shabarov Yu.S. „Chimie organică” partea 1 M.: Chimie 1994
8) Petrov A.A., Balyan H.V., Troshchenko A.T. Chimie organică: Manual pentru universități.-ed. a 5-a, revizuită. Și suplimentar - Sankt Petersburg: „Ivan Fedorov”, 2002.-624 p.
9) L. Fizer, M. Fizer Chimie organică, Volumul 1-M., „Chimie”, 1969, 688 p.
10) Plotnikov V.F., Piterskaya Yu.L. Alkenes Ghid de studiu - Sankt Petersburg: SPbGTI (TU) - 2003. - 20 p.
11) Neyland O. Ya. Capitolul II. Alchene // Chimie organică: Manual. pentru chimie. universități - M.: „Școala superioară”, 1990.
12) Martie D. Chimie organică: În 4 volume/Trans. din engleză – M.: Mir, 1987. – T. 4. 470 p.
13) Terney A. Modern organic chemistry: In 2 volumes - M.: Mir, 1981.
14) Hauptmann Z., Graefe Y., Remane H. „Chimie organică” M.: Chimie, 1979
15) Dryuk V.G., Malinovsky M.S. „Curs de chimie organică” Kiev: Școala Vishcha 1987
16) http://www.chemistry.ssu.samara.ru/chem2/u442.htm
17) http://www.xumuk.ru/
1 Petrov A.A., Balyan H.V., Troshchenko A.T.
Chimie organică: Manual pentru universități, p.85 26 26 Traven
Rezumat >> Chimie CH2 + 3O2 2CO2 + 2H2O b) Când oxidare alchene CH2 + 3O2 2CO2 + 2H2O b) Când oxidare se formează soluţie diluată de permanganat de potasiu... pe o legătură dublă. c) Când este greu
soluție de fierbere de permanganat de potasiu în acid...
Teoria chimiei generale cu elemente ale metodelor de predareCheat sheet >> Chimie Metoda de producere a compușilor carbonilici - oxidare alcooli Ca agent de oxidare... randament ~ 90%) 5. oxidare Oxidare . Se obțin aldehide și cetone oxidare hidrocarburi din seria etilenei... nu se hidrateaza. 7. Reacții oxidare
. Aldehide și cetone...
26 26 TravenOxirani (epoxizi) alcooli Ca agent de oxidare... randament ~ 90%) 5. oxidare peracizi Cea mai utilizată metodă... acid 1,2-epoxiciclo-m-clorobenzoic acid hexan alcooli Ca agent de oxidare... randament ~ 90%) 5. oxidare peracizii organici sunt însoțiți de adaos de oxigen...
Informații generale despre alcool. Polioli
26 26 Traven...) pot fi obținute . Se obțin aldehide și cetone oxidare permanganat de potasiu sau tetrooxid... . Descrieți mecanismul de reacție alcooli Ca agent de oxidare... randament ~ 90%) 5. polioli alcooli Ca agent de oxidare... randament ~ 90%) 5. etilenglicolul procedează diferit, ... mecanisme: (m 21) Periodat Metoda de producere a compușilor carbonilici - glicerolul duce la formarea de formaldehidă...
Acest material poate fi dificil de stăpânit pe cont propriu din cauza cantității mari de informații, a multor nuanțe și a tot felul de DAR și IF-uri. Citiți cu atenție!
Despre ce anume vom vorbi?
Pe lângă oxidarea completă (combustie), unele clase de compuși organici se caracterizează prin reacții de oxidare incomplete, în care sunt transformați în alte clase.
Există agenți oxidanți specifici pentru fiecare clasă: CuO (pentru alcooli), Cu(OH) 2 și OH (pentru aldehide) și altele.
Dar există doi agenți oxidanți clasici care, ca să spunem așa, sunt universali pentru multe clase.
Acesta este permanganat de potasiu - KMnO 4. Și bicromat (dicromat) de potasiu – K 2 Cr 2 O 7 . Aceste substanțe sunt agenți oxidanți puternici datorită manganului în starea de oxidare +7 și, respectiv, cromului în starea de oxidare +6.
Reacțiile cu acești agenți oxidanți apar destul de des, dar nicăieri nu există un ghid cuprinzător despre ce principiu să alegeți produsele unor astfel de reacții.
În practică, există mulți factori care influențează cursul reacției (temperatura, mediul, concentrația de reactivi etc.). Adesea, rezultatul este un amestec de produse. Prin urmare, este aproape imposibil să preziceți produsul care se va forma.
Dar acest lucru nu este potrivit pentru examenul de stat unificat: nu puteți scrie acolo „poate asta, sau asta, sau asta, sau un amestec de produse”. Trebuie să existe precizări.
Scriitorii sarcinilor pun într-o anumită logică, un anumit principiu conform căruia ar trebui scris un anumit produs. Din păcate, nu l-au împărtășit cu nimeni.
Această problemă este mai degrabă evitată în majoritatea manualelor: două sau trei reacții sunt date ca exemplu.
În acest articol vă prezint ceea ce se poate numi rezultatele unei cercetări-analize a sarcinilor de examinare unificată de stat. Logica și principiile compunerii reacțiilor de oxidare cu permanganat și dicromat au fost rezolvate destul de precis (în conformitate cu standardele Unified State Examination). Primele lucruri mai întâi.
Determinarea stării de oxidare.
În primul rând, atunci când avem de-a face cu reacții redox, există întotdeauna un agent oxidant și un agent reducător.
Agentul de oxidare este manganul în permanganat sau cromul în dicromat, agentul reducător este atomii din materia organică (și anume, atomi de carbon).
Nu este suficient să se determine produsele; reacția trebuie egalată. Pentru egalizare se folosește în mod tradițional metoda balanței electronice. Pentru aplicarea acestei metode, este necesar să se determine stările de oxidare ale agenților reducători și oxidanților înainte și după reacție.
nu am materie organică Cunoaștem stările de oxidare din clasa a IX-a:
Dar probabil că nu au luat cursul organic în clasa a IX-a. Prin urmare, înainte de a învăța cum să scrieți OVR în chimie organică, trebuie să învățați cum să determinați starea de oxidare a carbonului în substanțele organice. Acest lucru se face puțin diferit, diferit decât în chimia anorganică.
Carbonul are o stare de oxidare maximă de +4 și un minim de -4. Și poate prezenta orice grad de oxidare a acestui gol: -4, -3, -2, -1, 0, +1, +2, +3, +4.
Mai întâi trebuie să vă amintiți ce este o stare de oxidare.
Starea de oxidare este sarcina convențională care apare pe un atom, presupunând că perechile de electroni sunt deplasate în întregime către atomul mai electronegativ.
Prin urmare, gradul de oxidare este determinat de numărul de perechi de electroni deplasați: dacă este deplasat către un anumit atom, atunci capătă o sarcină în exces minus (-), dacă de la atom, atunci capătă un exces plus (+) încărca. În principiu, aceasta este toată teoria pe care trebuie să o cunoști pentru a determina starea de oxidare a unui atom de carbon.
Pentru a determina starea de oxidare a unui anumit atom de carbon dintr-un compus, trebuie să luăm în considerare fiecare dintre legăturile sale și să vedem în ce direcție se va deplasa perechea de electroni și ce sarcină în exces (+ sau -) va apărea din aceasta asupra atomului de carbon.
Să ne uităm la exemple specifice:
La carbon trei legături cu hidrogenul. Carbon și hidrogen - care este mai electronegativ? Carbon, ceea ce înseamnă că de-a lungul acestor trei legături perechea de electroni se va deplasa spre carbon. Carbonul ia o sarcină negativă de la fiecare hidrogen: rezultă -3
A patra conexiune este cu clorul. Carbon și clor - care este mai electronegativ? Clorul, ceea ce înseamnă că de-a lungul acestei legături perechea de electroni se va deplasa către clor. Carbonul câștigă o sarcină pozitivă +1.
Apoi, trebuie doar să adăugați: -3 + 1 = -2. Starea de oxidare a acestui atom de carbon este -2.

Să determinăm starea de oxidare a fiecărui atom de carbon:

Carbonul are trei legături cu hidrogenul. Carbon și hidrogen - care este mai electronegativ? Carbon, ceea ce înseamnă că de-a lungul acestor trei legături perechea de electroni se va deplasa spre carbon. Carbonul ia o sarcină negativă de la fiecare hidrogen: rezultă -3
Și încă o conexiune cu un alt carbon. Carbon și alt carbon - electronegativitatea lor este egală, deci nu există o deplasare a perechii de electroni (legatura nu este polară). 

Acest atom are două legături cu un atom de oxigen și o altă legătură cu un alt atom de oxigen (ca parte a grupului OH). Mai mulți atomi de oxigen electronegativi din trei legături atrag o pereche de electroni din carbon, iar carbonul capătă o sarcină de +3.
Prin a patra legătură, carbonul este conectat la un alt carbon, așa cum am spus deja, de-a lungul acestei legături perechea de electroni nu se deplasează.


Carbonul este legat de atomii de hidrogen prin două legături. Carbonul, fiind mai electronegativ, ia o pereche de electroni pentru fiecare legătură cu hidrogenul și capătă o sarcină de -2.
O legătură dublă de carbon este legată de un atom de oxigen. Oxigenul mai electronegativ atrage o pereche de electroni la sine de-a lungul fiecărei legături. Împreună, se dovedește că carbonul are două perechi de electroni. Carbonul câștigă o taxă de +2.
Împreună obținem +2 -2 = 0.

Să determinăm starea de oxidare a acestui atom de carbon:
O legătură triplă cu un azot mai electronegativ dă carbonului o sarcină de +3, legătura cu carbonul nu schimbă perechea de electroni.

Oxidare cu permanganat.
Ce se va întâmpla cu permanganatul?
Reacția redox cu permanganatul poate avea loc în diferite medii (neutru, alcalin, acid). Și depinde de mediu exact cum va decurge reacția și ce produse se vor forma.
Prin urmare, poate merge în trei direcții:

Permanganatul, fiind un agent oxidant, este redus. Iată produsele restaurării sale:
- Mediu acid.
Mediul este acidulat cu acid sulfuric (H2SO4). Manganul este redus la starea de oxidare +2. Iar produsele de recuperare vor fi:
KMnO 4 + H 2 SO 4 → MnSO 4 + K 2 SO 4 + H 2 O
- Mediu alcalin.
Pentru a crea un mediu alcalin, se adaugă un alcali destul de concentrat (KOH). Manganul este redus la starea de oxidare +6. Produse de recuperare
KMnO 4 + KOH → K 2 MnO 4 + H 2 O
- Mediu neutru(și ușor alcalin).
Într-un mediu neutru, pe lângă permanganat, reacționează și apa (pe care scriem în partea stângă a ecuației), manganul se va reduce la +4 (MnO 2), produsele de reducere vor fi:
KMnO4 + H2O → MnO2 + KOH
Și într-un mediu ușor alcalin (în prezența unei soluții de KOH cu concentrație scăzută):
KMnO4 + KOH → MnO2 + H2O

Ce se va întâmpla cu materia organică?
Primul lucru pe care trebuie să-l înțelegi este că totul începe cu alcool! Aceasta este etapa inițială a oxidării. Carbonul de care este atașată gruparea hidroxil suferă oxidare.
În timpul oxidării, un atom de carbon „dobândește” o legătură cu oxigenul. Prin urmare, atunci când scrieți o schemă de reacție de oxidare, scrieți [O] deasupra săgeții:
Alcool primar se oxidează mai întâi la o aldehidă, apoi la un acid carboxilic:

Oxidare alcool secundar se întrerupe în a doua etapă. Deoarece carbonul se află în mijloc, se formează o cetonă, nu o aldehidă (atomul de carbon din gruparea cetonă nu mai poate forma fizic o legătură cu gruparea hidroxil):

Cetone, alcooli terțiariŞi acizi carboxilici nu se mai oxideaza:

Procesul de oxidare este treptat - atâta timp cât există loc pentru oxidare și există toate condițiile pentru aceasta, reacția continuă. Totul se termină cu un produs care nu se oxidează în condițiile date: un alcool terțiar, o cetonă sau un acid.
Este demn de remarcat etapele oxidării metanolului. Mai întâi, este oxidat la aldehida corespunzătoare, apoi la acidul corespunzător:

Particularitatea acestui produs (acid formic) este că carbonul din grupa carboxil este legat de hidrogen și, dacă te uiți cu atenție, vei observa că acesta nu este altceva decât o grupare aldehidă:

Și gruparea aldehidă, așa cum am descoperit mai devreme, este oxidată în continuare la o grupare carboxil:

Ați recunoscut substanța rezultată? Formula sa brută este H2CO3. Acest acid carbonic, care se descompune în dioxid de carbon și apă:
H2CO3 → H2O + CO2
Prin urmare, metanol, formicaldehidă și acid formic(datorită grupării aldehide) sunt oxidate la dioxid de carbon.
Oxidare ușoară.
Oxidarea ușoară este oxidare fără încălzire puternică într-un mediu neutru sau ușor alcalin (scrieți 0 deasupra reacției ° sau 20 °) .
Este important de reținut că alcoolii nu se oxidează în condiții blânde. Prin urmare, dacă se formează, oxidarea se oprește asupra lor. Ce substanțe vor suferi o reacție ușoară de oxidare?
- Conținând o legătură dublă C=C (reacția Wagner).
În acest caz, legătura π este ruptă și gruparea hidroxil „se așează” pe legăturile eliberate. Rezultatul este un alcool dihidric:

Să scriem reacția de oxidare ușoară a etilenei (etenei). Să notăm substanțele inițiale și să prezicem produsele. În același timp, nu scriem încă H 2 O și KOH: ele pot apărea fie în partea dreaptă a ecuației, fie în stânga. Și determinăm imediat gradele de oxidare ale substanțelor implicate în reacția redox:

Să facem o balanță electronică (ne referim la faptul că există doi agenți reducători - doi atomi de carbon, se oxidează separat):

Să setăm coeficienții:

La sfârșit trebuie să adăugați produsele care lipsesc (H 2 O și KOH). Nu este suficient potasiu în dreapta, ceea ce înseamnă că va fi alcali în dreapta. Îi punem un coeficient în față. Nu este suficient hidrogen în stânga, așa că este apă în stânga. Îi punem un coeficient în față:

Să facem același lucru cu propilena (propenă):


Cicloalchena este adesea strecurată. Nu lăsa să te deranjeze. Este o hidrocarbură obișnuită cu o legătură dublă:

Oriunde se află această dublă legătură, oxidarea se va desfășura în același mod:

- Conținând o grupare aldehidă.
Gruparea aldehidă este mai reactivă (reacționează mai ușor) decât grupul alcool. Prin urmare, aldehida se va oxida. Înainte de acid:

Să ne uităm la exemplul acetaldehidei (etanal). Să notăm reactanții și produșii și să aranjam stările de oxidare. Să întocmim un bilanț și să punem coeficienți în fața agentului reducător și agentului oxidant:

Într-un mediu neutru și un mediu ușor alcalin, cursul reacției va fi ușor diferit.
Într-un mediu neutru, după cum ne amintim, scriem apă în partea stângă a ecuației și alcalii în partea dreaptă a ecuației (formate în timpul reacției):

În acest caz, un acid și un alcali apar unul lângă altul într-un amestec. Are loc neutralizarea.

Ele nu pot exista una lângă alta și să reacționeze, se formează sarea:
Mai mult, dacă ne uităm la coeficienții din ecuație, vom înțelege că există 3 moli de acid și 2 moli de alcali. 2 moli de alcali pot neutraliza doar 2 moli de acid (se formează 2 moli de sare). Și rămâne un mol de acid. Prin urmare, ecuația finală va fi:

Într-un mediu ușor alcalin, alcaliul este în exces - se adaugă înainte de reacție, astfel încât tot acidul este neutralizat:

O situație similară apare în timpul oxidării metanalului. După cum ne amintim, este oxidat la dioxid de carbon:

Trebuie avut în vedere că monoxidul de carbon (IV) CO 2 este acid. Și va reacționa cu alcalii. Și deoarece acidul carbonic este dibazic, se pot forma atât o sare acidă, cât și o sare medie. Depinde de raportul dintre alcalii și dioxid de carbon:
Dacă alcalii au un raport de 2:1 față de dioxidul de carbon, atunci sarea medie va fi:
Sau poate exista semnificativ mai multe alcaline (de mai mult de două ori). Dacă este mai mult decât dublu, atunci restul de alcali va rămâne:
3KOH + CO2 → K2CO3 + H2O + KOH
Acest lucru se va întâmpla într-un mediu alcalin (unde există un exces de alcali, deoarece este adăugat la amestecul de reacție înainte de reacție) sau într-un mediu neutru, când se formează o mulțime de alcali.
Dar dacă alcalii se referă la dioxidul de carbon ca 1:1, atunci va fi o sare acidă:
KOH + CO2 → KHCO3
Dacă există mai mult dioxid de carbon decât este necesar, atunci acesta rămâne în exces:
KOH + 2CO 2 → KHCO 3 + CO 2
Acest lucru se va întâmpla într-un mediu neutru dacă se formează puține alcali.
Să notăm substanțele inițiale, produsele, să întocmim un echilibru, să punem stările de oxidare în fața agentului oxidant, agentului reducător și a produselor care se formează din acestea:

Într-un mediu neutru, se va forma un alcali (4KOH) în partea dreaptă:

Acum trebuie să înțelegem ce se va forma în timpul interacțiunii dintre trei moli de CO 2 și patru moli de alcali.
3CO 2 + 4KOH → 3KHCO 3 + KOH
KHCO3 + KOH → K2CO3 + H2O
Deci se dovedește așa:
3CO 2 + 4KOH → 2KHCO 3 + K 2 CO 3 + H 2 O
Prin urmare, în partea dreaptă a ecuației scriem doi moli de bicarbonat și un mol de carbonat:

Dar într-un mediu slab alcalin nu există astfel de probleme: datorită faptului că există un exces de alcali, se va forma o sare medie:

Același lucru se va întâmpla în timpul oxidării aldehidei acidului oxalic:

Ca și în exemplul anterior, se formează un acid dibazic și, conform ecuației, ar trebui să se obțină 4 moli de alcali (deoarece 4 moli de permanganat).
Într-un mediu neutru, din nou, toate alcaliile nu sunt suficiente pentru a neutraliza complet tot acidul.
Trei moli de alcali intră în formarea unei sări acide, rămâne un mol de alcali:
3HOOC–COOH + 4KOH → 3KOOC–COOH + KOH
Și acest mol de alcali intră în interacțiune cu un mol de sare acidă:
KOOC–COOH + KOH → KOOC–COOK + H2O
Se dovedește așa:
3HOOC–COOH + 4KOH → 2KOOC–COOH + KOOC–COOK + H 2 O
Ecuația finală:

Într-un mediu ușor alcalin, se formează sare medie din cauza excesului de alcali:

- Conținând o legătură triplăC≡ C.
Vă amintiți ce s-a întâmplat în timpul oxidării ușoare a compușilor cu dublă legătură? Dacă nu vă amintiți, derulați înapoi și amintiți-vă.
Legătura π se rupe și gruparea hidroxil este atașată de atomii de carbon. Aici este același principiu. Nu uitați că o legătură triplă are două legături π. Mai întâi, aceasta se întâmplă de-a lungul primei legături π:
Apoi printr-o altă legătură π:

O structură în care un atom de carbon are două grupări hidroxil este extrem de instabilă. Când ceva este instabil în chimie, tinde să facă ceva „să cadă”. Apa cade astfel:

Aceasta are ca rezultat o grupare carbonil.
Să ne uităm la exemple:
Etină (acetilenă). Să luăm în considerare etapele oxidării acestei substanțe:

Eliminarea apei:




Ca și în exemplul anterior, există un acid și un alcali într-un amestec de reacție. Are loc neutralizarea și se formează sare. După cum puteți vedea din coeficientul de permanganat alcalin, vor fi 8 moli, adică este suficient pentru a neutraliza acidul. Ecuația finală:

Luați în considerare oxidarea butinei-2:

Eliminarea apei:

Aici nu se formează acid, așa că nu este nevoie să vă deranjați cu neutralizarea.
Ecuația reacției:

Aceste diferențe (între oxidarea carbonului la marginea și la mijlocul lanțului) sunt demonstrate clar de exemplul pentinei:

Eliminarea apei:

Rezultatul este o substanță cu o structură interesantă:

Gruparea aldehidă continuă să se oxideze:
Să notăm substanțele inițiale, produsele, să determinăm stările de oxidare, să facem o bilanţ, să punem coeficienţii în faţa agentului de oxidare și a agentului reducător:

Ar trebui formați 2 moli de alcali (deoarece coeficientul în fața permanganatului este 2), prin urmare, tot acidul este neutralizat:

Oxidare severă.
Oxidarea dură este oxidarea în acru, foarte alcalin mediu. Și, de asemenea, în neutru (sau ușor alcalin), dar când este încălzit.
Într-un mediu acid, acestea sunt, de asemenea, uneori încălzite. Dar pentru ca oxidarea severă să apară într-un mediu non-acid, încălzirea este o condiție prealabilă.
Ce substanțe vor suferi o oxidare severă? (În primul rând, vom analiza doar într-un mediu acid - și apoi vom adăuga nuanțe care apar în timpul oxidării într-un mediu puternic alcalin și neutru sau slab alcalin (când este încălzit).
Cu oxidare severă, procesul ajunge la maxim. Atâta timp cât există ceva de oxidat, oxidarea continuă.
- Alcoolii. Aldehide.
Să luăm în considerare oxidarea etanolului. Se oxidează treptat la acid:

Să scriem ecuația. Notăm substanțele inițiale, produsele reacției redox, intrăm în stările de oxidare și întocmim un echilibru. Să egalăm reacția:

Dacă reacția este efectuată la punctul de fierbere al aldehidei, atunci când se formează, aceasta se va evapora (zbura departe) din amestecul de reacție fără a avea timp să se oxideze în continuare. Același efect poate fi obținut în condiții foarte blânde (încălzire scăzută). În acest caz, scriem aldehida ca produs:

Să luăm în considerare oxidarea alcoolului secundar folosind exemplul 2-propanolului. După cum sa menționat deja, oxidarea se termină în a doua etapă (formarea unui compus carbonil). Deoarece se formează o cetonă, care nu se oxidează. Ecuația reacției:

Să luăm în considerare oxidarea aldehidelor folosind etanal. De asemenea, se oxidează la acid:

Ecuația reacției:

Metanalul și metanolul, așa cum am menționat mai devreme, sunt oxidați la dioxid de carbon:

Metanal:

- Conținând mai multe legături.
În acest caz, lanțul se rupe la legătura multiplă. Iar atomii care l-au format sunt supuși oxidării (aceștia dobândesc o legătură cu oxigenul). Se oxidează pe cât posibil.
Când legătura dublă este ruptă, din fragmente se formează compuși carbonilici (în diagrama de mai jos: dintr-un fragment - o aldehidă, din celălalt - o cetonă)

![]()
Să ne uităm la oxidarea pentenei-2:

Oxidarea „restelor”:

Se pare că se formează doi acizi. Să notăm materiile prime și produsele. Să determinăm starea de oxidare a atomilor care o modifică, să facem un echilibru și să egalizăm reacția: 
La compilarea unei balanțe electronice, ne referim la faptul că există doi agenți reducători - doi atomi de carbon și sunt oxidați separat:

Acidul nu se va forma întotdeauna. Să examinăm, de exemplu, oxidarea 2-metilbutenei:

Ecuația reacției:

Absolut același principiu pentru oxidarea compușilor cu o legătură triplă (doar oxidarea are loc imediat cu formarea unui acid, fără formarea intermediară a unei aldehide):

Ecuația reacției:

Când legătura multiplă este situată exact în mijloc, rezultatul nu sunt două produse, ci unul. Deoarece „resturile” sunt aceleași și sunt oxidate la aceleași produse:

Ecuația reacției:

- Acid cu dublă coroană.
Există un acid în care grupările carboxil (coroanele) sunt conectate între ele:
Acesta este acid oxalic. Este dificil pentru două coroane să se înțeleagă una lângă alta. Cu siguranță este stabil în condiții normale. Dar datorită faptului că are două grupări carboxilice legate între ele, este mai puțin stabil decât alți acizi carboxilici.
Și, prin urmare, în condiții deosebit de dure, poate fi oxidat. Există o pauză în legătura dintre „două coroane”:

Ecuația reacției:

- Omologi ai benzenului (și derivații acestora).
Benzenul în sine nu se oxidează, datorită aromaticității care face această structură foarte stabilă 
Dar omologii săi sunt oxidați. În acest caz, circuitul se întrerupe, principalul lucru este să știi unde exact. Se aplică câteva principii:
- Inelul benzenic în sine nu se prăbușește și rămâne intact până la sfârșit, ruperea legăturii are loc în radical.
- Atomul legat direct de inelul benzenic este oxidat. Dacă după el lanțul de carbon din radical continuă, atunci va avea loc ruptura după el.


Să ne uităm la oxidarea metilbenzenului. Acolo, un atom de carbon din radical este oxidat: 
Ecuația reacției:

Să ne uităm la oxidarea izobutilbenzenului:

Ecuația reacției:

Să ne uităm la oxidarea sec-butilbenzenului:

Ecuația reacției:

Când omologii benzenului (și derivații omologilor) sunt oxidați cu mai mulți radicali, se formează doi, trei sau mai mulți acizi aromatici bazici. De exemplu, oxidarea 1,2-dimetilbenzenului:

Derivații omologilor benzenului (în care inelul benzenic are radicali non-hidrocarburi) sunt oxidați în același mod. O altă grupare funcțională de pe inelul benzenic nu interferează:


Subtotal. Algoritmul „cum se scrie reacția de oxidare dură cu permanganat într-un mediu acid”:
- Notați substanțele inițiale (organice + KMnO 4 + H 2 SO 4).
- Notați produsele de oxidare organică (compușii care conțin alcool, grupări aldehidice, legături multiple, precum și omologii benzenului vor fi oxidați).
- Notați produsul reducerii permanganatului (MnSO 4 + K 2 SO 4 + H 2 O).
- Determinați gradul de oxidare la participanții la OVR. Faceți un bilanț. Introduceți coeficienții pentru agentul oxidant și agentul reducător, precum și pentru substanțele care se formează din acestea.
- Apoi se recomandă să calculați câți anioni sulfat sunt în partea dreaptă a ecuației și, în consecință, să puneți un coeficient în fața acidului sulfuric în stânga.
- La final pune coeficientul in fata apei.
Oxidare severă într-un mediu puternic alcalin și un mediu neutru sau ușor alcalin (când este încălzit).
Aceste reacții sunt mult mai puțin frecvente. Putem spune că astfel de reacții sunt exotice. Și așa cum se cuvine oricăror reacții exotice, acestea s-au dovedit a fi cele mai controversate.
Oxidarea dură este, de asemenea, grea în Africa, așa că materia organică se oxidează în același mod ca într-un mediu acid.
Nu vom analiza separat reacțiile pentru fiecare clasă, deoarece principiul general a fost deja enunțat mai devreme. Să ne uităm doar la nuanțe.
Mediu foarte alcalin :
Într-un mediu puternic alcalin, permanganatul este redus la starea de oxidare +6 (manganat de potasiu):
KMnO 4 + KOH → K 2 MnO 4 .
Într-un mediu puternic alcalin, există întotdeauna un exces de alcali, deci va avea loc neutralizarea completă: dacă se formează dioxid de carbon, va fi carbonat, dacă se formează un acid, va fi sare (dacă acidul este polibazic, există va fi o sare medie).
De exemplu, oxidarea propenei:

Oxidarea etilbenzenului:

Mediu ușor alcalin sau neutru când este încălzit :
Și aici trebuie luată întotdeauna în considerare posibilitatea neutralizării.
Dacă oxidarea are loc într-un mediu neutru și se formează un compus acid (acid sau dioxid de carbon), atunci alcaliul rezultat va neutraliza acest compus acid. Dar nu există întotdeauna suficientă alcalie pentru a neutraliza complet acidul.
La oxidarea aldehidelor, de exemplu, nu este suficient (oxidarea se va desfășura în același mod ca în condiții blânde - temperatura pur și simplu va accelera reacția). Prin urmare, se formează atât sare, cât și acid (care, aproximativ vorbind, rămâne în exces).
Am discutat despre asta când ne-am uitat la oxidarea ușoară a aldehidelor.
Prin urmare, dacă formați acid într-un mediu neutru, trebuie să vedeți cu atenție dacă este suficient pentru a neutraliza tot acidul. O atenție deosebită trebuie acordată neutralizării acizilor polibazici.
Într-un mediu slab alcalin, datorită cantității suficiente de alcali, se formează doar săruri medii, deoarece există un exces de alcali.
De regulă, alcalii sunt suficiente pentru oxidare într-un mediu neutru. Și ecuația de reacție atât în medii neutre, cât și în medii slab alcaline va fi aceeași.
De exemplu, să ne uităm la oxidarea etilbenzenului:


Alcaliul este suficient pentru a neutraliza complet compușii acizi rezultați, chiar și excesul va rămâne:

Se consumă 3 moli de alcali - 1 rămâne.
Ecuația finală:

Această reacție într-un mediu neutru și slab alcalin va proceda în același mod (în mediul slab alcalin din stânga nu există alcali, dar asta nu înseamnă că nu există, pur și simplu nu reacționează).
Reacții redox care implică dicromat de potasiu (bicromat).
Bicromat nu are o varietate atât de mare de reacții de oxidare organică în cadrul examenului de stat unificat.
Oxidarea cu dicromat se realizează de obicei numai într-un mediu acid. În acest caz, cromul este restabilit la +3. Produse de recuperare:
Oxidarea va fi severă. Reacția va fi foarte asemănătoare cu oxidarea cu permanganat. Aceleași substanțe care sunt oxidate de permanganat într-un mediu acid vor fi oxidate și se vor forma aceleași produse.
Să ne uităm la câteva reacții.
Să luăm în considerare oxidarea alcoolului. Dacă oxidarea se efectuează la punctul de fierbere al aldehidei, atunci va părăsi amestecul de reacție fără a suferi oxidare:

În caz contrar, alcoolul poate fi oxidat direct la acid.
Aldehida produsă în reacția anterioară poate fi „prinsă” și forțată să se oxideze la un acid:

Oxidarea ciclohexanolului. Ciclohexanolul este un alcool secundar, deci se formează o cetonă:

Dacă este dificil să determinați stările de oxidare ale atomilor de carbon folosind această formulă, puteți scrie pe schiță:

Ecuația reacției:

Să luăm în considerare oxidarea ciclopentenei.
Legătura dublă se rupe (ciclul se deschide), atomii care au format-o sunt oxidați la maxim (în acest caz, la gruparea carboxil):


Câteva caracteristici ale oxidării în examenul de stat unificat, cu care nu suntem în totalitate de acord.
Considerăm că acele „reguli”, principii și reacții care vor fi discutate în această secțiune nu sunt în întregime corecte. Ele contrazic nu numai starea reală a lucrurilor (chimia ca știință), ci și logica internă programa școlarăși examenul de stat unificat în special.
Dar, cu toate acestea, suntem obligați să furnizăm acest material exact în forma cerută de Examenul Unificat de Stat.
Vorbim în special despre oxidarea HARD.
Vă amintiți cum omologii benzenului și derivații lor sunt oxidați în condiții dure? Toți radicalii sunt terminați și se formează grupări carboxil. Resturile sunt supuse oxidarii „pe cont propriu”:

Deci, dacă dintr-o dată apare o grupare hidroxil sau o legătură multiplă în radical, trebuie să uitați că acolo există un inel benzenic. Reacția va urma DOAR asta grupa functionala(sau conexiune multiplă).
Gruparea funcțională și legătura multiplă sunt mai importante decât inelul benzenic.

Să ne uităm la oxidarea fiecărei substanțe:
Prima substanță:

Trebuie să ignorați faptul că există un inel de benzen. Din punctul de vedere al examenului unificat de stat, acesta este doar alcool secundar. Alcoolii secundari sunt oxidați la cetone, dar cetonele nu sunt oxidate în continuare:

Lăsați această substanță să fie oxidată cu dicromat:

A doua substanță:

Această substanță este oxidată pur și simplu ca un compus cu o legătură dublă (nu acordăm atenție inelului benzenic):

Lasă-l să se oxideze în permanganat neutru când este încălzit:

Alcaliul rezultat este suficient pentru a neutraliza complet dioxidul de carbon:
2KOH + CO 2 → K 2 CO 3 + H 2 O
Ecuația finală:

Oxidarea celei de-a treia substanțe:

Lăsați oxidarea să continue cu permanganat de potasiu într-un mediu acid:

Oxidarea celei de-a patra substanțe:

Lăsați-l să se oxideze într-un mediu foarte alcalin. Ecuația reacției va fi:

Și, în sfârșit, așa se oxidează vinilbenzenul:

Și se oxidează la acid benzoic, trebuie să rețineți că, conform logicii examenului unificat de stat, se oxidează astfel nu pentru că este un derivat al benzenului. Dar pentru că conține o legătură dublă.
Concluzie.
Acesta este tot ce trebuie să știți despre reacțiile redox care implică permanganat și dicromat în materia organică.
Nu fi surprins dacă auzi pentru prima dată unele dintre punctele prezentate în acest articol. După cum am menționat deja, acest subiect este foarte larg și controversat. Și, în ciuda acestui fapt, din anumite motive, primește foarte puțină atenție.
După cum probabil ați văzut, două sau trei reacții nu pot explica toate tiparele acestor reacții. Acest lucru necesită o abordare integrată și explicații detaliate ale tuturor punctelor. Din păcate, în manuale și pe resursele de pe Internet subiectul nu este acoperit în totalitate sau deloc.
Am încercat să elimin aceste neajunsuri și neajunsuri și să consider acest subiect ca un întreg, și nu parțial. Sper ca am reusit.
Vă mulțumim pentru atenție, toate cele bune! Mult succes la mastering stiinta chimica si trecerea la examene!
După cum sa menționat deja, oxidarea unei substanțe organice este introducerea oxigenului în compoziția sa și (sau) eliminarea hidrogenului. Reducerea este procesul invers (introducerea hidrogenului și eliminarea oxigenului). Luând în considerare compoziția alcanilor (СnH2n+2), putem concluziona că aceștia sunt incapabili să participe la reacțiile de reducere, dar pot participa la reacțiile de oxidare.
Alcanii sunt compuși cu stări scăzute de oxidare ale carbonului și, în funcție de condițiile de reacție, pot fi oxidați pentru a forma diferiți compuși.
La temperaturi obișnuite, alcanii nu reacționează nici măcar cu agenți oxidanți puternici (H2Cr2O7, KMnO4 etc.). Când sunt introduși într-o flacără deschisă, alcanii ard. În acest caz, în exces de oxigen, oxidarea lor completă are loc la CO2, unde are carbonul cel mai înalt grad oxidare +4 și apă. Arderea hidrocarburilor duce la ruperea tuturor Conexiuni C-Cși C-H și este însoțită de eliberarea unei cantități mari de căldură (reacție exotermă).
Este în general acceptat că mecanismul de oxidare al alcanilor implică un proces de lanț radical, deoarece oxigenul în sine este slab reactiv pentru a extrage un atom de hidrogen dintr-un alcan, este necesară o particulă care va iniția formarea unui radical alchil; va reacționa cu oxigenul, dând un radical peroxi. Radicalul peroxi poate apoi extrage un atom de hidrogen dintr-o altă moleculă de alcan pentru a forma un hidroperoxid de alchil și un radical.

Este posibilă oxidarea alcanilor cu oxigenul atmosferic la 100-150°C în prezența unui catalizator - acetat de mangan această reacție este utilizată în industrie; Oxidarea are loc atunci când un curent de aer este suflat prin parafina topită care conține o sare de mangan.
Deoarece Ca rezultat al reacției, se formează un amestec de acizi, aceștia sunt separați de parafina nereacționată prin dizolvare în alcalii apoase și apoi neutralizați cu acid mineral.
Direct în industrie, această metodă este utilizată pentru a obține acid acetic din n-butan:
Oxidarea alchenelor
Reacțiile de oxidare ale alchenelor se împart în două grupe: 1) reacții în care se păstrează scheletul de carbon, 2) reacții de distrugere oxidativă a scheletului de carbon al moleculei la dubla legătură.
Reacții de oxidare a alchenelor cu conservarea scheletului de carbon
1. Epoxidare (reacția Prilezhaev)
Alchenele aciclice și ciclice, când reacţionează cu peracizii într-un mediu nepolar, formează epoxizi (oxirani).
Oxiranii pot fi obținuți și prin oxidarea alchenelor cu hidroperoxizi în prezența catalizatorilor care conțin molibden, wolfram și vanadiu:

Cel mai simplu oxiran, oxidul de etilenă, este produs industrial prin oxidarea etilenei cu oxigen în prezența argintului sau oxidului de argint ca catalizator.

2. anti-hidroxilare (hidroliza epoxizilor)
Hidroliza acidă (sau alcalină) a epoxizilor duce la deschiderea inelului de oxid cu formarea de transdioli.

În prima etapă, atomul de oxigen al epoxidului este protonat pentru a forma un cation ciclic de oxoniu, care se deschide ca urmare a atacului nucleofil al moleculei de apă.
Deschiderea inelului epoxidic catalizat de bază duce, de asemenea, la formarea de trans-glicoli.

3. sin-Hidroxilare
Una dintre cele mai vechi metode de oxidare a alchenelor este reacția Wagner (oxidare cu permanganat de potasiu). Inițial, oxidarea produce un ester ciclic al acidului mangan, care se hidrolizează într-un diol vicinal:

Pe lângă reacția Wagner, există o altă metodă de sin-hidroxilare a alchenelor sub acțiunea oxidului de osmiu (VIII), care a fost propusă de Krige. Când tetroxidul de osmiu reacţionează cu o alchenă în eter sau dioxan, se formează un precipitat negru de ester ciclic al acidului osmic, osmat. Cu toate acestea, adăugarea de OsO4 la legătura multiplă este vizibil accelerată în piridină. Precipitatul de osmat negru rezultat este ușor descompus prin acțiunea unei soluții apoase de hidrosulfit de sodiu:

Permanganatul de potasiu sau oxidul de osmiu (VIII) oxidează alchena la cis-1,2-diol.
Scindarea oxidativă a alchenelor
Scindarea oxidativă a alchenelor include reacții de interacțiune a acestora cu permanganatul de potasiu în acid alcalin sau sulfuric, precum și oxidarea cu o soluție de trioxid de crom în acid acetic sau dicromat de potasiu și acid sulfuric. Rezultatul final al unor astfel de transformări este scindarea scheletului de carbon la locul dublei legături și formarea de acizi carboxilici sau cetone.
Alchenele monosubstituite cu o legătură dublă terminală sunt scindate la acid carboxilic și dioxid de carbon:

Dacă ambii atomi de carbon de la o legătură dublă conțin doar o grupare alchil, atunci se formează un amestec de acizi carboxilici:

Dar dacă alchena tetrasubstituită la legătura dublă este o cetonă:

Reacția de ozonoliză a alchenelor are o semnificație preparativă mult mai mare. Timp de multe decenii, această reacție a servit ca metodă principală pentru determinarea structurii alchenei părinte. Această reacție este efectuată prin trecerea unui curent dintr-o soluție de ozon în oxigen, o soluție de alchenă în clorură de metilen sau acetat de etil la -80 ... -100 ° C. Mecanismul acestei reacții a fost stabilit de Krige:


Ozonidele sunt compuși instabili care se descompun exploziv. Există două moduri de descompunere a ozonidelor - oxidativă și reductivă.
În timpul hidrolizei, ozonidele sunt descompuse în compuși carbonilici și peroxid de hidrogen. Peroxidul de hidrogen oxidează aldehidele în acizi carboxilici - aceasta este descompunerea oxidativă:

Mult mai importantă este scindarea reductivă a ozonidelor. Produșii ozonolizei sunt aldehide sau cetone, în funcție de structura alchenei inițiale:
Pe lângă metodele de mai sus, există o altă metodă propusă în 1955 de Lemieux:
În metoda Lemieux, nu există proceduri intensive de muncă pentru separarea dioxidului de mangan, deoarece dioxidul și manganatul sunt din nou oxidați de periodat în ion permanganat. Acest lucru permite utilizarea numai a cantităților catalitice de permanganat de potasiu.
4.5. Oxidarea alchenelor
Este recomandabil să se împartă reacțiile de oxidare ale alchenelor în două mari grupe: reacții în care se păstrează scheletul de carbon și reacții de distrugere oxidativă a scheletului de carbon al moleculei la dubla legătură. Primul grup de reacții include epoxidarea, precum și hidroxilarea, ducând la formarea de dioli vicinali (glicoli). În cazul alchenelor ciclice, hidroxilarea produce vicinal transă- sau cis-diole. Un alt grup include ozonoliza și reacțiile de oxidare exhaustive ale alchenelor, ducând la formarea diferitelor tipuri de compuși carbonilici și acizi carboxilici.
4.5.a. Reacții de oxidare a alchenelor cu conservarea scheletului de carbon
1. Epoxidare (reacție de N.A. Prilezhaev, 1909)
Alchenele aciclice și ciclice, atunci când reacţionează cu peracizii (peracizii) RCOOOH într-un mediu nepolar, indiferent, formează epoxizi (oxirani), prin urmare reacția în sine se numește reacție de epoxidare.
Conform nomenclaturii moderne IUPAC- un inel cu trei membri cu un atom de oxigen se numeste oxiran.
Epoxidarea alchenelor ar trebui să fie considerată ca un proces sincron, coordonat, în care intermediarii ionici, cum ar fi cationul hidroxil OH+, nu participă. Cu alte cuvinte, epoxidarea alchenelor este un proces sin- atașarea unui atom de oxigen la o legătură dublă cu păstrarea completă a configurației substituenților la legătura dublă.

Pentru epoxidare a fost propus un mecanism caracteristic proceselor concertate.

Deoarece atacul dublei legături de către atomul de oxigen al peracidului este la fel de probabil pe ambele părți ale planului dublei legături, oxiranii rezultați sunt fie mezo-forme, sau amestecuri de enantiomeri. Următorii peracizi sunt utilizați ca agenți de epoxidare: perbenzoic, m-cloroperbenzoic, monoperftalic, peracetic, trifluoroperacetic și performic. Peracizii din seria aromatică sunt utilizați sub formă de reactivi individuali, în timp ce peracizii din seria alifatică - CH 3 CO 3 H, CF 3 CO 3 H și HCO 3 H nu sunt izolați individual, ci sunt utilizați după formarea lor într-un 30. % sau 90% interacțiune peroxid de hidrogen și acidul carboxilic corespunzător. Perbenzoina și m-acidul cloroperbenzoic se obţine prin oxidarea benzoicului şi m-acizi clorobenzoici cu peroxid de hidrogen 70% intr-o solutie de acid metansulfonic sau din clorurile acide ale acestor acizi si peroxid de hidrogen.


Acidul monoperftalic se obține printr-o metodă similară din anhidridă ftalică și peroxid de hidrogen 30%.

Inițial, acizii perbenzoici sau monoperftalici au fost utilizați pentru a obține oxirani (epoxizi):

În prezent, cel mai frecvent utilizat pentru epoxidare este m-acidul cloroperbenzoic. Spre deosebire de alți peracizi, este stabil la raft pentru o lungă perioadă de timp (până la 1 an) și este absolut sigur de manipulat. Randamentele de oxirani obținute din oxidarea alchenelor aciclice și ciclice m-acidul cloroperbenzoic într-o soluție de clorură de metilen, cloroform sau dioxan sunt de obicei destul de mari.



Peracizii sunt adesea generați direct într-un amestec de reacție de 90% peroxid de hidrogen și acid carboxilic în clorură de metilen.


Alchenele cu o legătură dublă conjugată cu o grupare carbonil sau alt substituent acceptor sunt inactive și pentru oxidarea lor este mai bine să se folosească agenți oxidanți mai puternici, precum acidul trifluoroperacetic, obținut din anhidrida trifluoracetică și peroxid de hidrogen 90% în clorură de metilen. Cel mai simplu oxiran, oxidul de etilenă, este produs industrial prin oxidarea etilenei cu oxigen în prezența argintului ca catalizator.

2. anti-Hidroxilare
Inelul cu trei membri al oxiranilor se deschide cu ușurință sub influența unei game largi de reactivi nucleofili. Aceste reacții vor fi discutate în detaliu în secțiunea despre eteri aciclici și ciclici. Aici se va lua în considerare doar hidroliza oxiranilor. Hidroliza oxiranilor este catalizată atât de acizi, cât și de baze. În ambele cazuri, se formează dioli vicinali, adică glicoli. În cataliza acidă, în prima etapă, atomul de oxigen oxiran este protonat pentru a forma un cation ciclic de oxoniu, care se deschide ca urmare a atacului nucleofil al unei molecule de apă:

Etapa cheie în deschiderea inelului, care determină viteza întregului proces, este atacul nucleofil al apei asupra formei protonate a oxiranului. Din punct de vedere mecanic, acest proces este similar cu deschiderea unui ion de bromoniu la atacul nucleofil de către un ion de bromură sau alt agent nucleofil. Din aceste poziții, rezultatul stereochimic ar trebui să fie formarea transă-glicoli în timpul descompunerii epoxizilor ciclici. Într-adevăr, în timpul hidrolizei catalizate de acid a oxidului de ciclohexenă sau a oxidului de ciclopentenă, exclusiv transă-1,2-dioli.

Astfel, procesul în două etape de epoxidare alchenei urmat de hidroliza acidă a epoxidului corespunde reacției. anti-hidroxilarea alchenelor.
Ambele etape anti-hidroxilarea alchenelor poate fi combinată dacă alchena este tratată cu apă oxigenată 30-70% în acid formic sau trifluoracetic. Ambii acești acizi sunt suficient de puternici pentru a provoca deschiderea inelului oxiran.

Deschiderea catalizată de bază a inelului oxiran conduce, de asemenea, la formarea ciclicului transă-glicoli.

Prin urmare, procesul în două etape de epoxidare a alchenelor urmat de hidroliza alcalină a epoxizilor este, de asemenea, o reacție. anti-hidroxilarea alchenelor.
3. sin-Hidroxilare
Unele săruri și oxizi ai metalelor de tranziție în stări de oxidare superioare sunt reactivi eficienți sin-hidroxilarea dublei legături a unei alchene, când ambele grupări hidroxil sunt adăugate pe aceeași parte a dublei legături. Oxidarea alchenelor cu permanganat de potasiu este una dintre cele mai vechi metode sin-hidroxilarea unei duble legături continuă să fie utilizată pe scară largă în ciuda limitărilor sale inerente. Cis-1,2-ciclohexandiolul a fost obținut pentru prima dată de V.V. Markovnikov în 1878 prin hidroxilarea ciclohexenei cu o soluție apoasă de permanganat de potasiu la 0 0 C.

Această metodă a fost dezvoltată ulterior în lucrările savantului rus E.E. Wagner, deci sin-hidroxilarea alchenelor sub actiunea unei solutii apoase de permanganat de potasiu se numeste reactie Wagner. Permanganatul de potasiu este un agent oxidant puternic care poate nu numai hidroxila legătura dublă, ci și scinda diolul vicinal rezultat. Pentru a evita pe cât posibil degradarea ulterioară a glicolilor, condițiile de reacție trebuie controlate cu atenție. Randamentele de glicoli sunt de obicei scăzute (30-60%). Cele mai bune rezultate se obțin prin hidroxilarea alchenelor într-un mediu ușor alcalin (pH ~ 8 9) la 0-5 0 C cu o soluție apoasă diluată 1% de KMnO 4.


Inițial, oxidarea alchenelor cu permanganat de potasiu produce un ester ciclic al acidului mangan, care este imediat hidrolizat la un diol vicinal.

Esterul ciclic al acidului mangan ca intermediar nu a fost izolat, dar formarea sa rezultă din experimente cu permanganat de potasiu marcat 18 O: ambii atomi de oxigen din glicol se dovedesc a fi marcați în timpul oxidării alchenei KMn 18 O 4. Aceasta înseamnă că ambii atomi de oxigen sunt transferați de la agentul de oxidare, și nu de la solvent - apă, ceea ce este în acord cu mecanismul propus.
O altă metodă sin-hidroxilarea alchenelor sub influența oxidului de osmiu (VIII) OsO 4 a fost propusă de R. Kriege în 1936. Tetroxidul de osmiu este o substanță incoloră, volatilă, cristalină, foarte solubilă în eter, dioxan, piridină și alți solvenți organici. Când tetroxidul de osmiu reacționează cu alchenele din eter sau dioxan, se formează un precipitat negru de ester ciclic al acidului osmic - osmat, care poate fi izolat cu ușurință sub formă individuală. Adăugarea de OsO4 la legătura dublă este vizibil accelerată în soluție în piridină. Descompunerea osmaților în glicoli vicinali se realizează prin acțiunea unei soluții apoase de hidrosulfit de sodiu sau hidrogen sulfurat.

Randamentele produsului sin-hidroxilarea alchenelor în această metodă este semnificativ mai mare decât atunci când se utilizează permanganat ca agent de oxidare. Un avantaj important al metodei Krige este absența produselor de scindare oxidativă a alchenelor, care este caracteristică oxidării permanganatului.


Tetroxidul de osmiu este un reactiv foarte scump și greu de obținut și este, de asemenea, toxic. Prin urmare, oxidul de osmiu (VIII) este utilizat în sinteza unor cantități mici de substanțe greu accesibile pentru a obține cel mai mare randament de diol. Pentru a simplifica sin-hidroxilarea alchenelor sub influența OsO 4, s-a dezvoltat o tehnică care permite utilizarea doar a cantităților catalitice din acest reactiv. Hidroxilarea alchenelor se realizează folosind peroxid de hidrogen în prezența OsO4, de exemplu:

Pentru a încheia această secțiune, prezentăm relațiile stereochimice dintre alchenă cis- sau transă-configuraţia şi configuraţia diolului vicinal rezultat, care poate fi cis- sau transă-izomer, eritro- sau trio-formă, mezo- sau D,L-forma în funcție de substituenții din alchenă:

Relații stereochimice similare sunt observate în alte reacții sin- sau anti- adăugarea la legături multiple de hidrogen, halogenuri de hidrogen, apă, halogeni, hidruri de bor și alți reactivi.
Întocmirea ecuațiilor reacțiilor redox care implică substanțe organice
ÎN datorită introducerii ca unică formă certificare finală absolvenți liceu singur examen de stat(UTILIZARE) și tranziție liceu Pentru pregătirea de specialitate, pregătirea elevilor de liceu pentru a finaliza sarcinile cele mai „costisitoare” din punct de vedere al punctelor din partea „C” devine din ce în ce mai importantă. Test de examen de stat unificatîn chimie. Deși cele cinci sarcini din partea C sunt considerate diferite: proprietăți chimice substanțe anorganice, lanțuri de transformări ale compușilor organici, probleme de calcul - toate sunt, într-o măsură sau alta, legate în mod specific de reacțiile redox (ORR). Dacă ați stăpânit cunoștințele de bază ale teoriei ODD, atunci puteți finaliza corect prima și a doua sarcină în întregime, iar a treia - parțial.
În opinia noastră, o parte semnificativă a succesului finalizării părții „C” constă tocmai în aceasta. Experiența arată că, dacă, în timp ce studiază chimia anorganică, studenții fac față destul de bine sarcinilor de scriere a ecuațiilor OVR, atunci sarcini similare din chimia organică le provoacă mari dificultăți. Prin urmare, pe tot parcursul cursului de chimie organică la clase de specialitate, încercăm să dezvoltăm la elevii de liceu abilitățile de compunere a ecuațiilor ORR. Când studiezi
caracteristici comparative
a compușilor anorganici și organici, introducem studenților utilizarea stării de oxidare (s.o.) (în chimia organică, în primul rând carbonul) și metodele de determinare a acesteia:
1) calculul mediei s.o. carbon într-o moleculă de materie organică;
2) definiția s.o. fiecare atom de carbon. Să clarificăm în ce cazuri este mai bine să folosim o metodă sau alta., se disting printr-un design modern si ergonomic, precum si prin rezistenta ridicata la uzura, durabilitate si confort. Din gama uriașă de produse prezentate în catalogul de pe site-ul profkresla.ru, puteți alege oricând modelele care se potrivesc cel mai bine stilului corporativ adoptat în compania dumneavoastră. Dacă încă întâmpinați dificultăți în a alege, specialiștii companiei sunt întotdeauna gata să dea sfaturi, să vă ajute să vă decideți asupra unui model, apoi să pregătiți un proiect și să efectueze toate măsurătorile și instalarea necesare la fața locului.
P Când studiem subiectul „Alcani”, arătăm că procesele de oxidare, ardere, halogenare, nitrare, dehidrogenare și descompunere aparțin proceselor redox. Atunci când scrieți ecuații pentru reacțiile de ardere și descompunere a substanțelor organice, este mai bine să folosiți valoarea medie a s.o. carbon. De exemplu:
Acordăm atenție primei jumătate a balanței electronice: atomul de carbon are un d.o fracționat. numitorul este 4, deci calculăm transferul de electroni folosind acest coeficient.
În alte cazuri, atunci când studiem subiectul „Alcani”, determinăm valorile d.o. fiecare atom de carbon din compus, în timp ce atrage atenția elevilor asupra secvenței de substituție a atomilor de hidrogen la atomii de carbon primari, secundari și terțiari:


Astfel, conducem elevii la concluzia că mai întâi procesul de substituție are loc la atomi de carbon terțiari, apoi la atomi de carbon secundari și, în sfârșit, la atomi de carbon primari.
P Când studiem subiectul „Alchene”, luăm în considerare procesele de oxidare în funcție de structura alchenei și de mediul de reacție.
Când alchenele sunt oxidate cu o soluție concentrată de permanganat de potasiu KMnO 4 într-un mediu acid (oxidare dură), legăturile - și - sunt rupte cu formarea de acizi carboxilici, cetone și monoxid de carbon (IV).
Această reacție este utilizată pentru a determina poziția dublei legături.

Dacă legătura dublă este la sfârșitul moleculei (de exemplu, în buten-1), atunci unul dintre produșii de oxidare este acidul formic, care se oxidează ușor la dioxid de carbon și apă:

Clarificăm că dacă molecula de alchenă este simetrică și legătura dublă este conținută în mijlocul moleculei, atunci se formează un singur acid în timpul oxidării:

Vă informăm că o caracteristică a oxidării alchenelor, în care atomii de carbon de la legătura dublă conțin doi radicali de carbon, este formarea a două cetone:


Având în vedere oxidarea alchenelor în medii neutre sau ușor alcaline, concentrăm atenția elevilor de liceu asupra faptului că în astfel de condiții oxidarea este însoțită de formarea de dioli (alcooli dihidroxilici), iar la acestea se adaugă grupări hidroxil. atomi de carbon, între care a existat o legătură dublă:

ÎNÎn mod similar, luăm în considerare oxidarea acetilenei și a omologilor ei, în funcție de mediul în care are loc procesul. Deci, clarificăm că într-un mediu acid procesul de oxidare este însoțit de formarea acizilor carboxilici:

Reacția este utilizată pentru a determina structura alchinelor pe baza produselor lor de oxidare:

În medii neutre și ușor alcaline, oxidarea acetilenei este însoțită de formarea oxalaților corespunzători (săruri de acid oxalic), iar oxidarea omologilor este însoțită de ruperea triplei legături și formarea de săruri de acid carboxilic:

ÎN Toate regulile sunt practicate cu elevii folosind exemple specifice, ceea ce duce la o mai bună asimilare a acestora a materialului teoretic. Prin urmare, atunci când studiază oxidarea arenelor în diferite medii, elevii pot face în mod independent presupuneri că formarea acizilor ar trebui să fie de așteptat într-un mediu acid și a sărurilor într-un mediu alcalin. Profesorul va trebui doar să clarifice ce produse de reacție se formează în funcție de structura arenei corespunzătoare.
Arătăm prin exemple că omologii benzenului cu un lanț lateral (indiferent de lungimea sa) sunt oxidați de un agent oxidant puternic la acid benzoic la atomul de carbon. Omologii de benzen, atunci când sunt încălziți, sunt oxidați de permanganat de potasiu într-un mediu neutru pentru a forma săruri de potasiu ale acizilor aromatici.
5C 6 H 5 –CH 3 + 6KMnO 4 + 9H 2 SO 4 = 5C 6 H 5 COOH + 6MnSO 4 + 3K 2 SO 4 + 14H 2 O,
5C 6 H 5 –C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 = 5C 6 H 5 COOH + 5CO 2 + 12MnSO 4 + 6K 2 SO 4 + 28H 2 O,
C 6 H 5 –CH 3 + 2KMnO 4 = C 6 H 5 COOK + 2MnO 2 + KOH + H 2 O.
Subliniem că, dacă există mai multe lanțuri laterale într-o moleculă de arenă, atunci într-un mediu acid fiecare dintre ele este oxidată la atomul de carbon a într-o grupare carboxil, rezultând formarea acizilor aromatici polibazici:

P Abilitățile dobândite în elaborarea ecuațiilor ORR pentru hidrocarburi permit utilizarea acestora la studierea secțiunii „Compuși care conțin oxigen”.
Astfel, când studiază subiectul „Alcooli”, elevii compun independent ecuații pentru oxidarea alcoolilor folosind următoarele reguli:
1) alcoolii primari sunt oxidați la aldehide
3CH 3 –CH 2 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 –CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O;
2) alcoolii secundari sunt oxidați la cetone

3) reacția de oxidare nu este tipică pentru alcoolii terțiari.
Pentru a se pregăti pentru Examenul de stat unificat pentru profesor Este recomandabil să oferiți informații suplimentare despre aceste proprietăți, care, fără îndoială, vor fi utile studenților.
Când metanolul este oxidat cu o soluție acidificată de permanganat de potasiu sau dicromat de potasiu, în timpul oxidării se formează alcooli primari, în funcție de condițiile de reacție, nu numai aldehide, ci și acizi. De exemplu, oxidarea etanolului cu dicromat de potasiu la rece se termină cu formarea acidului acetic, iar când este încălzit, acetaldehida:
3CH 3 –CH 2 OH + 2K 2 Cr 2 O 7 + 8H 2 SO 4 = 3CH 3 –COOH + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O,
3CH 3 –CH 2 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 3CH 3 –CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O.
Să reamintim din nou studenților influența mediului asupra produșilor reacțiilor de oxidare a alcoolului, și anume: o soluție fierbinte neutră de KMnO 4 oxidează metanolul la carbonat de potasiu, iar alcoolii rămași la săruri ale acizilor carboxilici corespunzători:

Când studiem subiectul „Aldehide și cetone”, concentrăm atenția elevilor asupra faptului că aldehidele sunt mai ușor oxidate decât alcoolii în acizii carboxilici corespunzători nu numai sub influența agenților oxidanți puternici (oxigenul aerului, soluțiile acidulate de KMnO 4 și K 2 Cr 2 O 7), dar și sub influența slabei (soluție de amoniac de oxid de argint sau hidroxid de cupru (II):):
5CH 3 –CHO + 2KMnO 4 + 3H 2 SO 4 = 5CH 3 –COOH + 2MnSO 4 + K 2 SO 4 + 3H 2 O,
3CH 3 –CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 –COOH + Cr 2 (SO 4) 3 + K 2 SO 4 + 4H 2 O,
CH3 –CHO + 2OH CH3 –COONH4 + 2Ag + 3NH3 + H2O.
Acordăm o atenție deosebită oxidării metanalului cu o soluție de amoniac de oxid de argint, deoarece în acest caz, se formează carbonat de amoniu, nu acid formic:
HCHO + 4OH = (NH4)2CO3 + 4Ag + 6NH3 + 2H2O.
După cum arată mulți ani de experiență, metodologia propusă pentru predarea elevilor de liceu cum să alcătuiască ecuații ORR care implică substanțe organice le crește finalul Rezultatul examenului de stat unificatîn chimie pentru câteva puncte.







