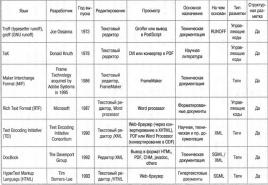
Bromidbutyl erhalten.
I. G. Bolesov, G. S. Zaitseva
Nucleophile Substitution und Eliminierung.
Methodische Entwicklung
Steuerung N4
1. Schreiben Sie eine Gleichung für jede der folgenden Substitutionsreaktionen:
2. Geben Sie die Halogenalkane und nukleophilen Reagenzien an, die für die Synthese der folgenden Produkte benötigt werden:

3. Zeichnen Sie jede der folgenden Gleichungen mit Formeln, die die Stereochemie der Reaktanten und Produkte klar angeben:
3.1(S)-2-Brombutan + MeONa (in Methanol) 2-Methoxybutan (S N 2),
3.2(R)-3-Brom-3-methylhexan + Methanol 3-Methoxy-3-methylhexan (S N 1),
3.3cis- 2-Brom-1-methylcyclopentan + NaSH 2-Methylcyclopentanthiol.
4. Bestimmen Sie die Reihenfolge der Reaktivität für 1-Brom-2-methylpropan, Bromid tert-Butyl, 2-Brombutan in Reaktionen mit:
4.1. NaN 3 in Dimethylformamid,
4.2. 10 % wässriges Dioxan.
5. Erklären Sie den allmählichen Verlust der optischen Aktivität von (R)-2-Iodoctan, wenn seine Lösung in Aceton mit Natriumiodid behandelt wird.
6. Erklären Sie die Bildung von etwa der gleichen Menge Butylen (20 %) und tert-Butylalkohol (80 %) bei der Hydrolyse von (CH 3 ) 3 C-X (X = Cl, Br, I).
7. Notieren Sie alle Produkte, die in den folgenden Reaktionen zu erwarten sind. Schlagen Sie Schemata der Mechanismen ihrer Bildung vor:
7.1. 1-Chlor-1-methylcyclohexan + Ethanol
7.2. 1-Chlor-1-methylcyclohexan + Natriumethoxid (in Ethanol)
8. Führen Sie (in zwei Schritten) die folgenden Transformationen durch:
8.1. Buten-2 methyl- zweite- Butylether,
8.2. 2-Methylbuten-2 2-methoxy-2-methylbutan,
8.3. Styrol-1-phenyl-1-cyanoethan.
9. Führen Sie basierend auf dem entsprechenden Alken (in zwei Stufen) die Synthese durch:
9.1. 1-Phenyl-1-aminoethan,
9.2. (CH 3 CH 2) 2 CHSH.
10. Unter Verwendung der Reaktion der elektrophilen 1,4-Addition an konjugierte Diene und der Reaktion der nukleophilen Substitution werden (in zwei Stufen) die folgenden Umwandlungen durchgeführt:
10.1. 1,3-Butadien CH 3 CH \u003d CHCH 2 CN,
10.2. 1,3-Butadien N CCH 2 CH=CHCH 2 CN
11. Geben Sie die am meisten bevorzugten Syntheseverfahren an:
11.1. n- Dibutylether,
11.2. Ethoxybenzol (Phenetol),
11.3. ethyl- tert-Butylether (industrielles Verfahren).
11.4. Methylbenzylether.
12. Erklären Sie, warum die Williamson-Synthese nicht zur Gewinnung von Diphenylether verwendet werden kann. Wie wird dieser Äther empfangen?
13. Anders als Alkane lösen sich Ether in kalter konzentrierter Schwefelsäure. Diese Reaktion ist ein einfacher chemischer Test, um den Unterschied zwischen diesen Verbindungsklassen festzustellen. Welche Chemie liegt diesem Unterschied zugrunde (Gleichungen schreiben).
14. Schreiben Sie eine Gleichung für jede der folgenden Reaktionen. Beachten Sie die Fälle, in denen die Reaktionen nicht ablaufen.
14.1. Di- n-Butylether + siedendes wässriges NaOH
14.2. Methyl- n-Propylether + überschüssiges heißes HBr
14.3. Di- n-Propylether + Na
14.5. Diethylether + kalte konzentrierte H 2 SO 4
14.6. Ethylphenylether + BBr 3 (1. Erhitzen, 2. H 2 O).
15. Beim Erhitzen mit überschüssigem HBr ergibt der cyclische Ether 1,4-Dibrombutan. Schreiben Sie die Struktur des Äthers und die Reaktionsgleichung auf.
16. Holen Sie sich 1,2-Butandiol aus n-Butylalkohol. Schreiben Sie Bedingungen und Schemata von Reaktionsmechanismen auf.
17. Schreiben Sie die Reaktionsgleichungen für Ethylenoxid auf mit:
17.1. 1 HBr-Äquivalent,
17.2. mit einem Überschuss an HBr,
17.3. Phenol und weiter mit verdünnter Säure.
18. 2-Phenylethanol, das nach Rosenöl riecht, wird in der Parfümerie verwendet. Schreiben Sie, wie dieser Stoff ausgehend von Brombenzol synthetisiert werden kann.
19. Wenn 1,1-Dimethyloxiran in einem Überschuss Methanol gelöst und die Reaktionsmischung mit einer kleinen Menge Säure behandelt wird, wird 2-Methoxy-2-methylpropanol-1 gebildet. Geben Sie ein Diagramm des Mechanismus an, der dieses Ergebnis erklärt. Erklären Sie, warum bei dieser Reaktion kein 1-Methoxy-2-methylpropanol-2 erhalten wird.
20. Das erste industrielle Verfahren zur Synthese von Ethylenoxid basierte auf der Behandlung von Ethylen mit hypochloriger Säure und der anschließenden Umsetzung des Produkts mit einer verdünnten Base. Schreiben Sie die Gleichungen für diese Reaktionen auf und beschreiben Sie ihre Mechanismusdiagramme.
21. Schreiben Sie die Bedingungen des Schemas der Empfangsmechanismen:
21.1. 2-Methoxyethanol aus Ethylenoxid und Methylalkohol,
21.2. Diethylenglycol aus Ethylenoxid und Ethylenglycol.
22. Welche chemischen Tests sollten verwendet werden, um die Verbindungen in jedem der folgenden Paare zu unterscheiden? Geben Sie an, was bei jedem Reaktionstest visuell beobachtet werden kann:
22.1. Di- n- Propylether und n-Hexan,
22.2. Ethylphenylether und Allylphenylether,
22.3. 2-Butanol und Methyl- n- Propylether,
22.4. Phenol und Anisol,
22.5. Phenol und 1-Hexanol.
23. Wie lautet die Struktur der Verbindung C 4 H 10 O 3 , wenn bei Behandlung mit einem Überschuss an HBr eine einzelne organische Verbindung, 1,2-Dibromethan, erhalten wird?
24. Schreiben Sie die Struktur der Destillatverbindung auf, die durch langsames Erhitzen einer Mischung von Ethylenglykol mit verdünnter Schwefelsäure bei gleichzeitigem Abdestillieren des Reaktionsprodukts erhalten wird. Geben Sie eine Reihe von Gleichungen an, die den Mechanismus dieser Reaktion beschreiben.
25. Vergleichen Sie die Reaktionen von Cyclohexanol und Phenol mit:
25.1. hbr,
25.2. H 2 SO 4 (Heizung),
25.3. PCl3
Formel R-OH, an ein Atom gebundene funktionelle OH-Gruppe
Kohlenstoff in der sp3-Hybridisierung
wobei R eine Alkyl- oder substituierte Alkylgruppe ist.
Klassifizierung nach der Anzahl der OH-Gruppen
einatomig
Methanol
Zweiatomig
Ethylenglykol
Dreiatomig
Glycerin
1Klassifizierung nach Art des Kohlenstoffatoms,
an die eine OH-Gruppe gebunden ist
Primär
Sekundär
Tertiär
Äthanol
Isopropanol
Tert-Butanol
2
Einteilung nach der Struktur des Kohlenwasserstoffrestes: gesättigte, ungesättigte und aromatische Alkohole.
CH3H3C
CH2C
Gesättigt
2-Methyl-2-butanol
Oh
CH3
CH3
H2C
CH
C
Oh
CH3
CH3
C
Oh
ungesättigt
2-Methyl-2-buten-2-ol
Aromatisch
2-Phenyl-2-propanol
CH3
3Nomenklatur
Gemäß der IUPAC-Nomenklatur werden gesättigte Alkohole genannt
Alkanole. Der Name enthält den Zusatz „OL“.
5
H3C
Br
4
AUS
3
CH
CH3 CH2
2
CH
1
CH3
5
CH3
4
CH
ER
3
CH
2
CH
1
CH3
ER
CH3
4-Brom-4-methyl-3-ethyl-2-pentanol
3-Penten-2-ol
Nach der radikalfunktionellen Nomenklatur
Der Name von Alkoholen setzt sich aus dem Namen des Radikals und dem Wort zusammen
Alkohol.
CH3OH
Methyl
Alkohol
CH3CHCH3
ER
Isopropyl
Alkohol
CH2OH
Benzyl
Alkohol
ER
Cyclohexyl
Alkohol
4Wie kommt man
Hydratation von Alkenen
H2C
CHCH3
+HO
H+
2
H3C
CH
CH3
Oh
AdE-Mechanismus,
pr.Markovnikova
Umordnung möglich
Hydrolyse von Halogenalkanen
Br
H3C
CHCH3
NaOH, H2O, T
-NaBr
Oh
H3C
CHCH3
Mechanismus SN1, SN2
Wenn SN1, möglich
Neuordnung.
Konkurrierende Reaktion:
Abspaltung (E1,E2)
5Oxymercuration-Demercuration (AdE)
Regionsspezifische Herstellung von Alkoholen nach Vorschrift
Markownikow. Konjugierte Verbindung. Fehlen
Umordnungen
1) Hg(OAc)2; THF-H2O; 20OC
CH3
2) NaBH4; H2O
H3C CH CH3
H3C CHCH2
CH3
+
H3COH
3,3-Dimethyl-2-butanol
(97%)
CH3
1) Hg(OAc)2; THF-H2O; 20OC
2) NaBH4; H2O
H3CCH2CHCH2
H3CCH2CHCH3
3
1-Hexen
3
Oh
2-Hexanol
(99,5%)
CH3
H3CC CH2 CH2 OH
CH3
3,3-Dimethyl-1-butanol
+
H3CCH2CH2CH2OH
3
1-Hexanol
(0,5%)
6Reaktionsmechanismus
RHCCH2+
+
HgOAc
RHC
H2O
+
CH2
Oh
+
R CH CH2 Hg OAc + H
hg
OAC
zyklisch
Quecksilberion
NaBH4
R CH CH2 HgH
Oh
R CH CH3 + Hg
Oh
Hydroxyalkylquecksilber
Konjugierte Verbindung. Die Rolle des externen Nucleophils wird von wahrgenommen
das Lösungsmittel ist Wasser.
7Synthese mit dem Grignard-Reagenz
Reaktion mit Aldehyden und Ketonen. AdN
(H)R1
+
AUS
(H)R2
Ö
R3
(abs. ef.) (H) R1
+
MgBr
(H)R2
H2O, HCl
AUS
Ö
R3
MgBr
-MgBrCl
(H)R1
(H)R2
AUS
Oh
R3
Formaldehyd → primärer Alkohol
Aldehyde→sekundärer Alkohol
Ketone→tertiärer Alkohol
Abs.
H
H2O, HCl
Äther
CH3CH2CH2OMgBr
CO+CH3CH2MgBr
CH3CH2CH2OH
H
Propoxymagnesium-1-propanol
Bromid
Abs.
CH3
CH3
H3C
Äther
H2O, HCl
CO+CH3CH2MgBr
H3C H2C HC OMgBr
H3C H2C HC OH MgClBr
H
2-Butoxymagnesium-2-butanol
Bromid
Abs.
CH3
CH3
H3C
H2O, HCl
Äther
CO+CH3CH2MgBr
H3C H2C C OMgBr
H3C H2C C OH
H3C
CH3
CH3
2-Methyl-2-butoxymagnesium-2-methyl-2-butanol
Bromid
8Reaktion mit Ethylenoxid
CH2
Ö
+
CH2
(abs. ef.)
CH2
CH2
R1
R1
H2CCH2
Ö
+
MgBr
H2O, HCl
Ö
-MgBrCl
R1
CH2CH2OH
MgBr
Ein Alkoholmolekül ist zwei Kohlenstoffatome größer
als in der Mg-organischen Verbindung.
(abs. ef.)
MgBr
H
C
H
C
+ 3 2
Ethylmagnesiumbromid
H2O, HCl
H3C CH2 CH2 CH2 O MgBr
-MgBrCl
Butoxymagnesiumbromid
H3CCH2CH2CH2OH
1-Butanol
9Reaktion mit Estern
Ö
C6H5
+
AUS
C6H5
OS2H5
Ethylbenzoat
(abs. ef.)
C6H5
+
(abs. ef.)
MgBr
C6H5
- С2Н5ОMgBr
Ö
+
AUS
C6H5
+
MgBr
C6H5
Ö
MgBr
AUS
C6H5
C6H5
ER
H2O, NH4Cl
-MgBrCl,
-NH4OH
C6H5
AUS
C6H5
C6H5
Triphenylmethanol
Gärung von Zucker
Enzym
C6H12O6
2 C2H5OH + 2 CO2
10Hydroborierung-Oxidation von Alkenen
1) BH3
2) H2O2,NaOH-H2O
Oh
CH3CH2CHCH2OH
CH3CH2CCH2
+
CH3CH2CCH3
CH3 (99%)
CH3
(1%) CH3
Reaktionsmechanismus
CH3 CH CH2
CH
CH3
H B H
H
CH2
CH3 CH2 CH2
CH3 CH CH2
BH3
H B H
H
H
CH3 CH CH2
H
CH3 CH2 CH2 B
3
2 CH3 CH CH2
CH3 CH CH2
B
H
H
H
H
H
CH3 CH2 CH2 B
BH2
H2O2, OH
B
CH2 CH2 CH3
CH2 CH2 CH3
Tripropylbor
3CH3CH2CH2OH
+ B(OH)3
11Reaktionsmechanismus
q-Ladungen an Atomen
q = - 0,2260
q = - 0,1619
CH3
CH3
CHCH2
H BH2
Elektronegativität
Wasserstoff 2,1 > Bor 1,9
Sterischer Faktor
CH3
CH3
CH2
H
BH2
CH3
CH
H
CH2
H
PS1
BH2
CH
+
CH2
H2B
RBor > RWasserstoff
+
CH
+
CH
Lokalisierung des Positiven
Ladung am Sekundäratom
Kohlenstoff (PS1) ist rentabler,
als auf der primären (PS2)
CH2
BH2
H
CH3
PS2
CH
CH2
H
BH2
12Rückgewinnung von Carbonylverbindungen
Aldehyd → primärer Alkohol
Keton→sekundärer Alkohol
Rückgewinnung von Aldehyden und Ketonen
Ö
H2, Ni
CH3CHCHC
CH3CH2CH2OH + C4H10
2
H
Selektive Reduktion der Carbonylgruppe
H
Ö
CH3CHCHC
+
+
H
Al
H
Li
H
Ö
CH3CHCHCHCH2O
H
Al
Ö
CH2 CHCH CH3
Ö
CH2 CHCH CH3
+
Li
10 % H2SO4
CH2 CHCH CH3
3+
4CH3CHCHCH2OH + Al + Li
+
13Rückgewinnung von Aldehyden und Ketonen
Ö
CH2CHCH2CH2C
H
NaBH4
C2H5OH
CH2CHCH2CH2CH2OH
4-n zehn -1-o l
4-p en ten al
Ö
(85%)
1) LiAlH4, ýô ðr, 0-10 Î Ñ
Oh
2) H2O, H+, 0OC
(94%)
2-Cyclohexen-1-o l
2-Cyclohexan-1-o n
LiAlH4-Reduktionsmechanismus
R1
CO
+
+ LiAlH4
R2
R1
+
HCOAlLi
R2
4
R1
+
HCO AlH3 Li
R2
H2O
R1
4HCOOH
R2
+ Al(OH)3 + LiOH
14Ö
1) NaBH4, C2H5OH
2) H2O, H+
Oh
Oh
+
H
Cyclohex-2-en-1-on
(59%)
DIBAL-N,
Benzol, 10 OS
Ö
Tricyclodec-4-en-3-on
H
(41%)
(90%)
Oh
Tricyclodec-4-en-3-ol
CH3
CH3
CH3 CH CH2
CH2 CH CH3
AlH
DIBAL-N
15Rückgewinnung von Carbonsäuren
Ö
CH3
CH2
C
1) LiAlH4
2) 10 % H2SO4
14
palmitisch
Säure
CH3
CH2
14
CH2
Oh
Oh
1-Hexadecanol
Rückgewinnung von Estern zu primären Alkoholen. Bouveau-Blanc-Reaktion
Na+C2H5OH
Ö
CH3 CH2
C
14
Ö
CH3
1) LiAlH4
2) 10 % H2SO4
CH3 CH2
CH2OH
14
+CH3OH
Methylpalmat
Rückgewinnung von Kohlenmonoxid. industrielle Methode
CO + 2H2
Cu-ZnO-Cr2O3 , T
CH3OH
16Physikalische Eigenschaften
Vergleich der physikalischen Eigenschaften von Alkoholen und Kohlenwasserstoffen
Alkohol
Kohlenwasserstoff
Molekulares Tm. Betriebssystem
Masse
Tbp. Betriebssystem
Löslichkeit in
100 ml Wasser, ml
CH3OH
CH3 CH3
32
30
-98,0
-172,0
65,0
-89,0
Unbegrenzt
4,7
CH3CH2OH
CH3CH2CH3
45
44
-117,3
-189,9
78,5
-42,2
Unbegrenzt
6,5
CH3CH2CH2OH
CH3CH2CH2CH3
60
58
-127,0
-135,0
97,2
-0,6
Unbegrenzt
15,0
17Die Struktur des Alkoholmoleküls
H
Attacke
Nukleophil
Nucleophilie
Basischkeit
+
C
....
Ö
Säure
H+
H
H
OH-Gruppen-Substitution
für Nukleophil (SN)
Spaltung der OH-Gruppe (E)
ÖKO=82 kcal/mol
EOH = 111 kcal/Mol
COH=107-109O
18Wasserstoffbrücken
E=3-6 kcal/mol
19Chemische Eigenschaften
1. Acidität von Alkoholen
CH2
CH3
CH2
Oh
CH2
CH3
Oh
CH3
+ Na
Ö
CH2
CH3
+
Auf einen
H
+
+ 1/2 H2
Na-Ethoxid
Na-Ethylat
CH2
CH3
Auf einen
+
H2O
Stärker
Säure als
Äthanol
CH2
CH3
OH + NaOH
weniger stark
Säure als
Wasser
20Acidität von Alkoholen in wässrigen Lösungen
ROH
R
Ö
+
H
+
pKa
tert-Butanol
18,0
Äthanol
15,9
Methanol
15,5
Wasser
15,7
FCH2CH2OH
13,9
CF3CH2OH
12,4
(CF3)3COH
5,0
Ka
pKa = –lgKa
+I-Effekt
Alkylgruppen
-M-Effekt F
212. Basizität von Alkoholen
Basizität von Alkoholen - die Fähigkeit, ein Proton zu binden
....
H
R O H + H
..
+
+
R O H
...
H
Nu
+
R+
OH
Wasser ist gut
Abgangsgruppe
Die Nucleophilie von Alkoholen ist die Fähigkeit zur Bildung
Bindungen mit anderen Atomen durch einsame Elektronenpaare.
....
....
RO Na
+
Stark
Nukleophil
R O H + H
H
+
Schwach
Nukleophil
..
+
R O H
Alkylhydroxoniumion
Stark
elektrophil
H
+
R+
...
OH
Wasser ist gut
Abgangsgruppe
22Basisalkohole.
Sie bilden Salze mit Bronsted- und Lewis-Säuren
H
CH3OH + HBr
+
CH3O
HBr
Methylhydroxonium
Bromid
H
CH3OH + AlCl3
+
CH3O
AlCl3
Einfluß der Struktur von Alkoholen auf das Säure-Base-Verhalten
CH3
CH3OH
CH3CH2OH
Erhöhung der Basizität
Anstieg der Säure
CH3CHOH
CH3
CH3 C
Oh
CH3
+I-Effekt von Alkylgruppen
233. Alkohole-nukleophile Mittel
Äther bekommen
CH3CH2OH + HOCH2CH3
H
SN2ac-Reaktionsmechanismus
H
CH3CH2O:
CH3
C
H
Nucleophil
+
CH3CH2O
H
H
H
H
+
CH3CH2
Ö
CH2CH3 + H2O
Diethylether
Konkurrenzreaktion E
Die Reaktion ist reversibel
CH3
+
OH2
H
Substrat
CH3
C
+
+
CH3CH2OH2
+
CH3CH2OH +
primäre Alkohole.
Intermolekulare Dehydratation
H2O
"
CH3CH2O
C
"
OH2
-H2O
H
H
H
Übergangszustand
CH3CH2O
CH2CH3
+
+
H3O
24Äther erhalten. Synthese von A. Williamson.
Symmetrische und nichtsymmetrische Ether
SN2
+
С2Н5О Na + CH3I
C2H5OCH3+
Methylethyl
Stark
Äther
Nukleophil
NaI
Konkurrierende Reaktionen
E2
H
CH3O
+
N / A
Stark
Base
Stark
Nukleophil
CH2
CH I
CH3
CH3CH = CH2 + CH3OH
SN2
CH3CH
OCH3 + NaI
CH3
Keine konkurrierende Reaktion
CH3
CH O
+
CH Na
3
ich
+
CH3
SN2
CH3CH
OCH3 + NaI
CH3
Stark
Nukleophil
Stark
Base
25Äther erhalten. Reaktion von Alkoholen mit Alkenen.
CH3
H3C
C
CH3
+
+
CH2HO
H
-H2O
CH3
H3C
C
Ö
CH3
CH3
Additiv mit hoher Oktanzahl
SN1ac-Reaktionsmechanismus
H3C
C
CH3
H3C
C
....
CH3
CH3
+H
CH2
+
H3C
C
+
H
CH3
+
Ö
CH3
CH3
+
HO
CH3
Nucleophil
CH3
H3C
C
Ö
CH3
+H
+
CH3
26Ester erhalten. Veresterungsreaktion.
CH3 C
Ö
X
X=
+
H
Kl
Ö
OK
CH3
Oh
..
Ö
..
H
Ö
+
CH3
CH3 C
Methanol-Nukleophil
+
HX
Ö
CH3
Methylacetat
Carbonsäurechloride
Anhydride von Carbonsäuren
Carbonsäuren
Optisch aktive Alkohole reagieren ohne Bindungsbruch am chiralen Atom,
daher hat das Produkt die Konfiguration des ursprünglichen Alkohols
CH3 C
Ö
+
H
Oh
..
Ö
..
CH3
*
CH
H
Ö
+
CH2 CH3
(S)-2-Butanol
Nucleophil
CH3 + H2O
CH3 C
Ö
*
CH
CH2 CH3
(S)-2-Butylacetat
27Ester von Mineralsäuren
Ö
2CH3OH
+
H2SO4
H3COSOCH3
+
2H2O
Ö
Ö
2CH3OH
+
ClSO2OH
H3COSOCH3
Õëî ðñóëüô î í î âàÿ
êèñëî òà
Ö
+
H2O
+ HCl
Äèì åòèëñóëüô àòàëêèëèðóþ ù èé àãåí ò
Ö
CH3OH
+
ClSO2OH
Õëî ðñóëüô î í î âàÿ
êèñëî òà
CH3OH
+ HNO3
H3C O S OH
+
H2O
+ HCl
Ö
Methylsulfat
H3CO NO2 + H2O
Ì åòèëí èòðàòâçðû â÷àòî å
âåù åñòâî
284. Nucleophile Substitution der OH-Gruppe
Die Umwandlung von Alkoholen in Halogenderivate
Reagenzien:
Halogenwasserstoffe (HCl, HBr, Na(K)Br+H2SO4, Na(K)I+H2SO4)
Phosphorchloride, -bromide (PCl3 PBr3)
Thionylchlorid (SOCl2)
Eine Mischung aus Phosphor und Jod
Phosphoroxychlorid (POCl3)
CH3CH2CH2CH2OH
CH3CH2CH CH3
Oh
CH3
CH3 COH
2h
NaBr+H2SO4, 60OC
HCl, H2O, 20OC
CH3
CH3
Oh
48 % HBr+H2SO4, 120OC
10 Minuten
HCl (Gas), 0 OC
Äther
CH3CH2CH2CH2Br + H2O
(95%)
CH3CH2CHCH3 + NaHSO4 + H2O
(60%)Br
CH3
CH3CCl + H2O
CH3
CH3
(90%) + H2O
Kl
29Substitution einer OH-Gruppe durch ein Halogen unter Einwirkung von Halogenwasserstoffen
C
Nu
ROH
+
HX
SNac
Oh
Empfang
HI > HBr > HCl
+ H2O
X= Cl, Br, I
die Reaktivität nimmt ab.
SN2ac-Mechanismus. primäre Alkohole.
H
CH2. .
+
+H
Oh
CH3
.
Kl
.
CH3
CH2
Kl
+ H2O
H
H
C. + langsam
+H
Kl
C
Ö
.
Ö.
CH3
.
H
H H H
H
Angriff von hinten
Bei optischen
aktive Alkoholinversionskonfiguration
30SN1ac-Mechanismus. Sekundäre, tertiäre Alkohole.
H
C2H5
*CHOH
+
Optisch
CH3
aktiv
Alkohol
langsam
-H2O
H
+
+
C2H5 *CHOH
CH3
H
C
Kl
+
C2H5*CH
C2H5
Kl
CH3
Racemat
CH3
Kohlensäure,
nukleophiler Angriff
auf beiden Seiten
Umgruppierung
CH3
CH3CH CH CH3
H
+
CH3C
H
1,2-H-Schaltung
CHCH3
+
CH3CH CH CH3
H
Oh
CH3
CH3
+
Ö
langsam
-H2O
LUMO-Carbokation
H
CH3
CH3
+
+
H3C CH2 CH3 Br
stabiler
tertiäre Carbokation
H3C
C
CH2CH3
Br
31Reaktivität von Alkoholen gegenüber Halogenwasserstoffen
Benzyl, Allyl > tertiär > sekundär > primär > Methanol
SN1
Die Stabilität des Carbokations steigt, das reaktive
Fähigkeit steigt
SN2
Räumlich
Angriffshindernisse
von hinten abnehmend
reaktionär
Fähigkeit
steigt
32Reaktion mit Phosphorhalogeniden PCl5, PCl3, PBr3, PI3,
Thionylchlorid SOCl2.
CH3
Br
CH
PBr3
CH3
Oh
CH
CH3
CH
CH3
CH3
PCI5
+
P(OH)3
CH3
Kl
CH
CH
CH
CH3
SOCl2
CH3
CH3
3-Methyl-2-butanol
CH3
Kl
CH
CH3
+ POCl3 + HCl
CH
+
SO2
+ HCl
CH3
33Reaktion von optisch aktiven Alkoholen mit Thionylchlorid.
Benzol, Ether
H5C2
H
H3C
Oh
R-2-Butanol
H5C2
Kl
H
H3C
R-2-Chlorbutan
SOCl2
Erhaltung
Aufbau
H5C2
Pyridin
Kl
H
CH3
Appellieren
Aufbau
S-2-Chlorbutan
34Der Mechanismus der Reaktion von Alkoholen mit Thionylchlorid.
Reaktion ohne Grund. SNI-Mechanismus.
(i-intern)
CH2
CH3
CH2
CH3
+
CH
-HCl
Thionylchlorid
Oh
H
+
CH2O
CH3
Ö
Kl
S
CH3
Kl
C
CH
Ö
2-Pentylchlorsulfit
2-Pentanol
H3C
CH3
SOCl2
CH3
H
S
Ö
Ionenpaar schließen.
Angriff von vorne.
-SO2
C
Kl
CH2
CH3
Erhaltung
Aufbau
35.
+
Ö
Ö
R O S
SN2
Cl 1,4-Dioxan
Ö
+
O R + Cl
+SO2
appellieren
Aufbau
Kl
+
RO
+
Angriff von hinten
Ö
SN2
RCl
+
Ö
Ö
appellieren
Aufbau
Siehe Foliennotizen
36Reaktion in Gegenwart einer Base. SN2-Mechanismus.
C2H5
H
C
Oh
CH3
+
H5C2
N
SOCl2
HN
Kl
Thionylchlorid
R-2-Butanol
+
+
H
CO
Kl
HN
S
CH3
+
Ö
Angriff von hinten
Ö
C2H5
Kl
C
H
+
+
+
S
HN
Ö
Kl
Appellieren
Salzsäure
Aufbau
Pyridin
CH3
37Reaktion von Alkoholen mit PCl3 und PBr3.
CH3
PCl3
CH3
3
CH3
CH3
H
CH
C*
CH3
CH3
*
C
CH
Kl
H
+
CH3
CH
CH3
Oh
PBr3
H
C*
CH3
POH
2
CH3
CH3
3
C*
CH
Br
+
P(OH)3
H
CH3
Konfigurationsumkehrung
38Der Mechanismus der Reaktion von Alkoholen mit PBr3.
H3C
3
H3C
C
+
Oh
H
C3H7-ich
PBr3
C
-3HBr
R-3-Methyl-2-butanol
CH3
Br
C
H
O P
C3H7-ich
H
C3H7-ich
H3C
+
O P
H Br 3 Br
SN2
3
Tri(1,3-dimethylpropyl)phosphit
H
C3H7-ich
3
CH3
C
Übergangszustand
P
Konsequent
dreimal greift Branion von hinten an
CH3
H
C3H7-ich
CO
3Br
2
C
H
C3H7-ich
+
P(OH)3
Konfigurationsumkehrung
Das BrΘ-Anion ist ein aktiveres Nucleophil als das ClΘ-Anion
395. Abspaltung der OH-Gruppe
Alkene erhalten. intramolekulare Dehydratation
H2SO4, T
CH3
CH
CH2 CH3
E1ac
Oh
2-Butanol
ER
CH3
C
H2SO4, T
CH2
CH3
E1ac
CH3
2-Methyl-2-butanol
(tert-Pentylalkohol)
CH3CH = CH2CH3 + H2O
trans-2-Buten
(Hauptprodukt)
CH3
C=CH
CH3 + H2O
CH3
2-Methyl-2-buten
Zaitsevs Regel
40primäre Alkohole.
CH2
CH3
Oh
CH2
96 % H2SO4, 180OC
H3C
KW CH2
-H2O
E2ac-Reaktionsmechanismus
..
..
1) CH3CH2OH + H
+
CH2 CH2
H
..H
..OH
+
H2C
CH2 + H2O + H2SO4
OSO2OH
Synchronisiert: Wasserabscheidung
und Proton
Ö
2) RCH2CH2OH + H2SO4
Ö
RCH2CH2
HSO4-
O SOH + H2O
Ö
RCH CH2 + H2SO4 + HSO4R CH CH2 O S OH
170 - 190 OC
Ö
H
41Sekundäre, tertiäre Alkohole.
E1ac-Mechanismus. Mögliche Neuordnung
CH3
C
CH3
CH3
CH3
CH3
H2SO4, 80 OS
CH
Oh
3-Methyl-2-butanol
CH3
CH3
CH
CH
CH3
+OH
C
+
CH
CH3
Nachhaltiger
tertiäre Carbokation CH3
C
CH3
+
1,2-CH3-Verschiebung
CH3
H
2
CH3
CH3
CH3
CH3
-H+
C
CH3
CH
CH3
stabiler, mehr
alkyliertes Alken
Zaitsevs Regel
Das Hauptprodukt der Spaltungsreaktion von Halogenalkanen mit
zwei nicht äquivalente C-Atome ist am meisten
stabil (höchst alkyliert, thermodynamisch
stabil) Alken.
42Reaktionsrichtung der katalytischen Dehydratisierung von Alkoholen
H3C
CH2 CH2
5
CHCH3
Oh
300-400OC
ThO2
Al2O3
H3C
CH2CH
5
nach Zaitsev
CHCH3
H3C
CH2 CH2 CH
5
CH2
nach Hoffmann
43Alkoholoxidation
Primäre Alkohole werden zu Aldehyden und dann zu Säuren oxidiert
H3C
OHO]
CH2
Ö
CH3 C
[Ö]
H
Acetaldehyd
Äthanol
Ö
CH3 C
Oh
Essigsäure
Sekundäre Alkohole werden zu Ketonen oxidiert
H3C
Ö
[Ö]
CH
Oh
H3C
Isopropanol
CH3 C
CH3
Aceton
Tertiäre Alkohole werden unter Zerstörung des Skeletts oxidiert
44Beispiele für die Oxidation von primären Alkoholen zu Aldehyden
Oxidationsmittel: Komplex von Chrom(IV)oxid mit Pyridin (Sarett-Collins-Reagenz)
.
Ö
N
+
CH2
Oh
Ö
4-Nitrophenylmethanol
4-Nitrobenzylalkohol
CH2Cl2 ;
Ö
Ö
CrO3 2C5H5N
N
25OC
+
(97%)
C
Ö
H
4-Nitrobenzaldehyd
Oxidationsmittel: Sarettas Reagenz (Pyridiniumchlorchromat,
sehr gut löslich in organischen Lösungsmitteln)
H3C
CH2C
4
C
CH2OH
3-Octin-1-ol
.
.
CrO3 C5H5N HCl
CH2Cl2 ; 25
OK
Ö
H3C
CH2C
C
4
2-oktal
(84%)
C
H
Oxidationsmittel: Mangan(IV)oxid.
Ö
CH2OH
CH3 CH2
C
H
C
H
Z-2-Buten-1-ol
MnO2 20OC
CH2Cl2 oder C6H14
C
CH3 CH2
C
H
C
H
H
Z-2-Butenal
45Beispiele für die Oxidation von primären Alkoholen zu Carbonsäuren
Jones-Reagenz (Lösung von CrO3 in wässriger H2SO4).
Ö
CH2OH
C
CrO3-H2O-H2SO4
Aceton, 20 OS
C6H5
(1-Phenylcyclopentyl)methanol
Oh
C6H5
1-Phenylcyclopentansäure
Beispiele zur Oxidation sekundärer Alkohole zu Ketonen
Oh
CrO3-H2O-H2SO4
Ö
Aceton, 20 OS
Cyclooctanol
Cyclooctanon
46Oxidation tertiärer Alkohole unter Zerstörung des Skeletts im sauren Medium
CH3
CH3 C
Oh
CH3
H
+
-H2O
CH3 C
CH2
[Ö]
CH3 C CH3
+ CO2 + H2O
Ö
CH3
Katalytische Dehydrierung von Alkoholen
Ö
Cu oder Ag, 600 OS
H3C
Oh
Industriell
Prozess.
Reaktionsbeispiel
α-Eliminierung.
HC
-H2
Methanol
H
Formaldehyd
Oh
Cu, 600OC
Ö
-H2
Cyclohexanol
Cyclohexanon
47Alkylierung von SEArenen
..
CH.OH
. +BF
3
3
+
H3C
H
Ö
+
CH3 (BF3OH)
bf3
CH3
+
CH3 (BF3OH)
+
Anbraten
+ H2O + BF3
Vertreter der Klasse der Alkohole:
Methanol - Gift, Lösungsmittel, Reagenz in Synthesen
Ethanol - ein Gift in großen Mengen, ein Lösungsmittel, ein Reagenz in Synthesen
Iso-Propanol - Lösungsmittel, Reagenz in Synthesen
48Die Hauptrichtungen der chemischen Umwandlungen von Alkoholen
Austrocknung
Anbraten
Nucleophil
Auswechslung
Alkohol
Dehydrierung
Oxidation
Alkene, Ether
Alkylaromat
Verbindungen
Halogenderivate,
Äther,
Ester,
Aldehyde, Ketone
Aldehyde, Ketone,
Carbonsäuren
49Diole (zweiwertige Alkohole)
CH2
HO
Oh
CH2 CH2
OH OH
H3CCHCH2
OH OH
Methandiol - existiert nicht in freier Form
1,2-Ethandiol (Ethylenglykol)
1,2-Proandiol (Propylenglykol)
Oh
trans-1,2-Cyclohexandiol
Oh
50Wie kommt man
Hydroxylierung von Alkenen mit Mylas-Reagenz, Wasserstoffperoxid,
nach der Wagner-Reaktion die Krieg-Reaktion
Oh
H2O2, OsO4, 0OC
H
Oh
(Mylas-Reagenz)
H
cis-1,2-Cyclohexandiol
H2O2, CH3COOH, H2SO4
Oh
KMnO4, H2O, 20OC, pH=7
H
(Wagner-Reaktion)
Oh
1) OsO4, 25OC
H
2) NaHSO3/H2O
trans-1,2-Cyclohexandiol
(Krige-Reaktion)
51Herstellung von Ethylenglykol aus Ethylen.
Ca(OH)2
Cl2, H2O
CH2 CH2
H2C
CH2 CH2
H2O, H+
CH2
CH2 CH2
ClOH
Ö
OH OH
Ethylenchlorhydrin Ethylenoxid
H2O, NaOH
Gewinnung von Glycerin aus Propylen.
NaOH, H2O
Cl2, 400
CH2 CH CH3
OK
CH2 CHCH2
Kl
H2O2, H2O
CH2 CHCH2
Oh
Cl2, H2O
NaOH, H2O
CH2 CHCH2
OH OH OH
CH2 CHCH2
ClOHCl
52Klassische reduktive Dimerisierung von Ketonen
(Pinacon-Restaurierung).
CH3 C
CH3
1) Mg, Benzol
2) H2O
CH3
CH3 C
CH3
CCH3
OH OH
(43-50%).
Pinakon
2,3-Dimethyl-2,3-butandiol
Ö
Mängel:
niedriger Ausgang,
eine Reaktion eingehen
nur Ketone.
Moderne reduktive Dimerisierung von Ketonen
in Gegenwart von TiCl4 in THF (I. Kori).
O Zn, TiCl4 THF, C6H5
25 OS, 2 Stunden
C
H3C
CH3
Ö
n-C7H15C
H
Mg(Hg), TiCl4, THF,
0 OS, 13 Std
C6H5
C
C
OH OH
(91%)
CH3
Nutzen: hoch
Ausgang, reagieren kann
geben nicht nur Ketone,
sondern auch aromatisch
aliphatische Aldehyde
n-C7H15CHCH n-C7H15 (80%)
OH OH
8,9-Hexadecanol
53Herstellung von 1,3-Diolen durch Reduktion von Aldolen.
Ö
R1CHCH2C
Oh
NaBH4, DME
R2
R1 CH CH2 CH R2
Oh
Oh
DME-Dimethoxyethan
1,3-Diol
Chemische Eigenschaften
Für mehrwertige Alkohole sind die gleichen Reaktionen charakteristisch wie für
einwertige Alkohole.
Dehydratisierung von 1,2-Diolen.
Dehydratisierung von 1,2-Diolen zu 1,3-Dienen.
CH3
CH3
C
CH3
C
OH OH
CH3
Al2O3, 450-470OC
H2C
C
C
CH2
(70-85%)
CH3 CH3
54Dehydratisierung von 1,2-Diolen mit Umlagerung
(Pinakolin-Umlagerung von 1,2-Diolen).
CH3 CH3
CH3 C
C
CH3
H2SO4, tOC
CH3
CH3 C
OH OH
C
CH3 + H2O
R. Fittigs Reaktion.
OCH3
Pinakolin
Pinakon
35 % H2SO4, tOC
CH3 CHCH CH3
CH3 C
OH OH
CH2 CH3
(81%)
Ö
Butanon
Der Mechanismus der Pinacol-Umlagerung.
R1
RC
R1
C
H
+
R
R
OH OH
R1
R1
C
C
R
R
R
C
C
+
+OH
R1
R
H
C
+
C
..OH
OH OH2
R1
R1
-H2O
R
R1
R1
+
R
C
C
Ö
R1
R
55Dehydratisierung unter Bildung zyklischer Ether.
Intermolekulare Dehydratation
Oh
H2C
H2C
HO
+
Oh
HO
Ö
CH2 H2SO4, konz., 140 OC H2C
CH2
H2C
CH2
CH2
(50-55%)
Ö
1,4-Dioxan
Intramolekulare Cyclodehydratisierung
unter Bildung cyclischer Ether.
HO
CH2
5
Oh
1,5-Pentandiol
57 % H2SO4
- H2O
Ö
(100%)
Tetrahydropyran
56
Klassifizierung und Nomenklatur von Ethern
ÄtherKlassifizierung und Nomenklatur von Ethern
Nach Struktur
Kohlenwasserstoff
Radikale
H3C
Nomenklatur
IUPAC
Symmetrisch,
Dialkyl
Diethyl
Äther
2-Ethoxyethan
asymmetrisch,
Dialkyl
Methylethyl
Äther
Methoxyethan
asymmetrisch,
Alkylaryl
Methylphenylether
Methoxybenzol
Symmetrisch,
Diaryl
Diphenyl
Äther
Phenoxybenzol
Tetrahydrofuran
Tetrahydrofuran
Ö
zyklisch,
Alkyl
Furan
Ö
zyklisch,
aromatisch
Oxacyclopentadien
Ö
CH2
CH2
H3C
Trivial
Nomenklatur
CH3
CH2
CH3
Ö
Ö
CH3
Ö
57Wie kommt man
Intermolekulare Dehydratisierung von Alkoholen.
Symmetrische Dialkylether.
CH3CH2OH + HOCH2CH3
H
+
CH3CH2
Ö
CH2CH3 + H2O
Diethylether
Williamson-Reaktion.
Symmetrische und unsymmetrische Dialkyl- und Alkylarylether
SN2
+
С2Н5О Na + CH3I
C2H5OCH3+
Methylethyl
Stark
Äther
Nukleophil
NaI
NO2
O2N
Br
NO2
+
H3C
OK
+
DMF
-KBr
O2N
OCH3
1-Methoxy-2,4-dinitrobenzol
58Kronenether bekommen
Auf einen
Auf einen
+
Ö
CH2
CH2
CH2
CH2
Kl
Kl
Kl
CH2
Ö
+
Kl
CH2
CH2
Ö
Dinatrium
CH2
Catecholsalz
(Dinatrium-1,2-di-(2-chlorethyl)-ether
Benzoldiolat)
Oh
C4H9OH-H2O
Auf einen
100
Auf einen
OK
+
Ö
Ö
Dibenzo-18-Krone-6
Ö
KOH, H2O-THF
Ö
Oh
(45%)
erste Kronenluft,
K. Pederson (1967)
Ö
Ö
Ö
Ö
Kl
Ö
Ö
Ö
Ö
Ö
Ö
(Ä.Êðàì)
Ö
Kl
18-Krone-6
(40-60%)
Reaktion von Alkoholen mit Alkenen.
CH3
H3C
C
CH3
+
+
CH2HO
H
CH3
-H2O
H3C
C
Ö
CH3
CH3
Methyl-tert-butylether (MTBE).
Additiv mit hoher Oktanzahl
59physikalische Eigenschaften.
T pl., OS
T sieden., OS
CH3OCH3
-138,5
-23,2
CH3CH2OH
-117,3
64,7
CH3CH2OCH2CH3
-116,3
34,6
CH3CH2CH2CH2OH
-89,5
117,7
Die Struktur des Estermoleküls
.. ..
H
Schwache Basen
Schwache Nucleophile
0,142 Nanometer
H
Ö
C
111O
C
H
1) Reaktionen am Sauerstoffatom
2) Reaktionen am a-Kohlenstoffatom
3) C-O-Bindungsspaltungsreaktionen
H
H
H
60Chemische Eigenschaften
Reaktionen am Sauerstoffatom
R
R1
..
Oh.. +HX
R
X=Cl, HSO4 R1
..
Ö.
.
Protonation unter der Aktion
schwache Säuren. Ausbildung
Wasserstoffbrücken.
HX
Bildung von Charge-Transfer-Komplexen (CTC) mit starken Säuren.
R
..
Oh.. +HX
R1
(C2H5)2O
X=Br,I
+BF3
+
R
Ö.
.
HX
Bronsted-Säuren
R1
Dialkyloxon-Kation
+
(C2H5)2O
bf3
Lewis-Säuren
Ethertrifluorid
Bor. Komplex mit Übertragung
Ladung (bullpen)
61Bildung von Trialkyloxoniumsalzen.
C2H5
..
.. + CH
Ö
C2H5
R
R
2
5
F
C2H5
+BF3
..
Ö
+
C2H5 BF4
C2H5
Trifluorborat
Triethyloxonium
.O+.
R
+ .. Nu
Nu
bf4
bf4
C2H5
R
+
..
Ö
+
R
..
..
R
+
C2H5 BF4
C2H5
ROH
Stark
Alkylierungsmittel.
Reagiert mit
schwache Nucleophile.
Ö
C2H5
ROC2H5
+
C2H5
..
.. +
Ö
bf3
Trifluorborat
Triethyloxonium
62Reaktionen am a-Kohlenstoffatom
Alkoxyradikal - mehr
stabiler als Alkyl,
aufgrund der Delokalisierung des ungepaarten Elektrons.
SR-Mechanismus.
R
..
Ö
..
H
H
C
R1
+
H
R
R
-HR
..
Ö
..C.
R1
Radikalische Halogenierung
CH3
CH2
Ö
CH2
CH3+
Cl2
Uhr, -20
Kl
OK
-HCl
CH
CH3
Ö
CH2
CH3
1-Chlor-1-ethoxyethan
63Autooxidation
R
.. H
Ö
.. C
R1
H
R
.. H
OK.
..
R
.. H
Ö
.. C
R1
R1
O O
+R
-HR
+. Ö
Ö.
+R
.. H
OK
..
H
R
.. H
OK.
..
R
R1
R1
.. H
OK
..
R1
O O
R
.. H
OK
..
R1
OH
+R
.. H
OK
.
..
R1
Hydroperoxide detonieren leicht beim Erhitzen und beim Aufprall.
64C-O-Bindungsspaltungsreaktionen.
Reaktionsbedingungen:
1) Konz. HBr, HI; 120-150OC
2) BCl3, BI3; -20 OS
X
R
..
Ö
+
SN2
R
X
+
R1
Oh
R1
H
Protoniert - SN1
Äther
+
R O R1 X
Unprotonierter Äther
R1
+
+R
X
R
Oh
R1
X
X
+R
Ö
R,R1-primär,
sekundäres Alkyl,
Phenyl.
SN2-Mechanismus.
Schwache Basis.
Alkohol Guter Abgang
Gruppe
R-primär,
sekundäres Alkyl,
Phenyl.
R1-tertiär
Alkyl, Allyl,
Benzyl.
SN1-Mechanismus.
Alkoxid
Anion
Starkes Fundament.
schlechter Abgang
Gruppe.
65....
SN2
+H
C6H5 O C2H5
Ethoxybenzol
Fenetol
..
H3C
Br
H
H
C
..
+
+
C6H5O
H
CH3
Br
+
Ö
C
H
H
C2H5
..
O C6H5
H
CH3
Br
H
C
H
H
+
HO
C6H5
SN1
....
CH3
CH3 C
Ö
CH3
+
H
CH3
..
CH3 C
+
Ö
CH3
H3CHH
langsam -CH3OH
MTBE
CH3
CH3 C
+
CH3
Oh
CH3
+
+ CH3
CH3
CH3 C
+
CH3
+
Br
schnell
CH3
CH3 C
Br
CH3
66Ether reagieren bei niedrigen Temperaturen nicht mit Na.
Bei erhöhten Temperaturen werden Ether (insbesondere höhere Homologe)
gemäß der Gleichung aufteilen
R
Ö
R1
+ 2 Na
R ONa
Na-Alkoxid
+
R1 Na
Alkylnatrium
Aktives Alkylnatrium kann reagieren
mit Diethylether (P.P. Shorygin)
H5C2
Ö
C2H5
+HC
5
2
N / A
H5C2 ONa
Na-Ethoxid
+
C2H6
+
C2H4
Die Verwendung von Ethern.
Lösungsmittel. Synthese verschiedener Komplexe. Antiklopfmittel
zu tanken.
67Zyklische Ether.
CH2
CH2
Ö
Ethylenoxid,
Oxiran
CH3CH
CH2
Ö
Oxid
Propylen, 2-Methyloxiran
CH2 CH2
CH2O
1,3-Epoxypropan,
Oxetan
CH2 CH2
CH2
CH2
Ö
Tetrahydrofuran,
Tetramethylenoxid
Ö
CH2
CH2
CH2
Ö
CH2
1,4-Dioxan
68Osirane (Epoxide).
Wie kommt man
Direkte Oxidation von Ethen.
H2C
CH2
+ O2
Ag
H2CCH2
250-300 OC
industrieller Weg
Ethylenoxid erhalten
Epoxidierung von Alkenen (Reaktion von N.A. Prilezhaev).
R
CHCH2
+
Ö
R
C
Ö
Äther, Benzol,
CH2Cl2
Oh
+
CH2Cl2
O OH 0
Cyclohexen
Kl
CHCH2
+
R
C
Ö
Oksiran
Persäure
(Persäure)
Ö
R
Ö
Ö
OK
(80%)
Oh
Ö
+
Oh
Kl
m-Chlorperbenzoesäure-7-oxabicycloheptan
(Cyclohexenoxid,
Naja Säure
Cyclohexenoxid)
69Dehydrohalogenierung von Halogenhydrinen.
Ö
H3C
KW CH2
+
Nr
NBS
Ö
H2O, DMSO
Oh
H2C
Br
KW CH3
B..
H3C
KW CH2
Ö
70Die Struktur des Moleküls
H
0,150 Nanometer
H
C
H
C
Ö
61O
H
0,146 Nanometer
Energie
Stromspannung
105 kJ/mol
(25 kcal/mol)
H2C
CH2
..Ö..
H
Attacke
Nukleophil
+
71Chemische Eigenschaften
Wechselwirkung mit Nucleophilen
Reaktionen mit schwachen Nucleophilen. Säurekatalyse
+
H2C
H, H2O
CH2
Ö
CH2 1,2-Ethandiol
Ethylenglykol
OH OH
H2C
+
H3C HC
CH2
H, CH3OH
H3C HC
Ö
CH2 O CH3
Oh
1-Methoxy-2-propanol
Methylcellosolve
SN2-Mechanismus
CH2+H
RHC
Ö
+
RHC
..
CH2+HO
H
CH3
+O
H
Angriff durch Nukleophil vorbei
sterisch zugänglich
atomare Überlegungen
R
+
CHCH2O
Oh
CH3-H+
R
CHCH2O
CH3
Oh
72Mechanismus SN1
H3C
H3C
+
CH
C
2
Oh
weniger stabil
primäre Carbokation
schnell
H3C
C
H3C
CH2
H
Ö
+
H3C
H3C
langsam
CH2
C
H3C
+
Ö
H
H
H3C
Ö
C
+
CH3
H
+
H3C
+
C
CH2
+
.
.
HO
CH3
Oh
stabiler
tertiäre Carbokation
CH3
CH3
CH2OH
H3C
Ö
C
CH2OH
CH3
2-Methyl-2-methoxy-1-propanol
73Reaktionen mit starken Nucleophilen. SN2-Mechanismus.
C2H5ONa
C2H5OH
CH2 CH2 O C2H5
Oh
NaOH, H2OCHCH
2
2
OH OH
H2C
CH2
NH3
Ö
CH2 CH2
2-Ethoxyethanol
Monoethyl
Ethylenglykolether
1,2-Ethandiol
Ethylenglykol
2-Aminoethanol
OHNH2
NH2C2H5
CH2 CH2 NH C2H5
2-N-Ethylethanolamin
Oh
CH3MgI
CH2 CH2 CH3 + MgIOH
Oh
74SN2-Mechanismus
..
..
CH3CHCH2 + NaOCH3
Na-Methylat
Ö
CH3 CH CH2 O CH3
Auf einen
CH3OH
+
CH3 CH CH2 O CH3 + CH3ONa
Oh
..
H3C
C CH2 + H2N CH3
H3C
Ö
CH3
H
+
H3C CH2 N CH3
Ö
H
CH3
H3C C CH2 NH CH3
Oh
2-Methyl-1-methylamino-2-propanol
75Polymerisation
HO
+
H2C
CH2
HO CH2 CH2 O
Ö
H2C
H2C
n
CH2
Ö
CH2
Ö
HO CH2 CH2 O CH2 CH2 O
HO CH2 CH2 O
H
n+2
Polyethylenglykol,
carbovax
Anwendung
Ausgangsreagenzien für die Synthese verschiedener Verbindungen.
76Phenole
Oh
Oh
Oh
HO
Oh
Oh
Phenol,
einatomig
Phenol
Hydrochinon,
zweiatomig
Phenol
Fluoroglucin,
dreiatomig
Phenol
77Wie kommt man
Hydrolyse aromatischer Halogenderivate
Nicht aktivierter Substitutionsmechanismus
Kl
Auf einen
+NaOH
Oh
HCl
360oC, S
-NaCl
Chlorbenzol
Phenol
Aktivierte Substitution, SNAr
Kl
Auf einen
+ 2 NaOH
NO2
p-Nitrochlorbenzol
Oh
160oC, P
HCl
-NaCl,
-H2O
-NaCl
NO2
NO2
p-Nitrophenol
78Herstellung von Phenol aus Isopropylbenzolhydroperoxid
H
O O
H3CCH3
H3CCHCH3
O2
Oh
Hydroperoxid
Cumol
Cumol
Ö
Н2SO4, H2O
+
H3CCH3
Phenol
Aceton
Substitution der Sulfonatgruppe, alkalisches Schmelzen von Sulfonaten
SO2ONa
300OC
+
Oh
Auf einen
NaOH
-Na2SO3
H2SO4, H2O
-NaHSO4
Benzolsulfonat
Natrium
79Substitution einer Diazogruppe durch ein Hydroxyl
+
NH2
N2OSO3H
NaNO2 + 2H2SO4
H2O
+ N2 + H2SO4
5oC
Anilin
Oh
Phenyldiazonium
Hydrosulfat
80Physikalische Eigenschaften
Name
T Pl.,
Betriebssystem
T kochen.,
Betriebssystem
Löslichkeit
in 100ml Wasser
bei 25 °С, g
Ka∙1010
Phenol
43
182
9,3
1,1
p-Kresol
35,5
201
2,3
0,07
p-Fluorphenol
48
185
-
5,2
p-Chlorphenol
43
220
2,7
6,3
p-Bromphenol
33
236
-
14
o-Nitrophenol
45
217
600
m-Nitrophenol
96
194
p-Nitrophenol
114
279 versch.
Pyrocatechin
104
246
0,2 fliegende s
Dampf
1,35 nichtflüchtig
Dampf
1,69 nichtflüchtig
Dampf
46
Resorcin
110
281
123
600
600
1
3
81Wasserstoffbrücken
H
Ö
N
Ö
Ö
N
Ö
Ö
Ö
N
H
Ö
H
Ö
Ö
Assoziiertes p-Nitrophenol
H
H
Ö
H
Ö
Ö
H
+
CO
NEIN
Ö
H
H
Ö
Ö
Die Struktur des Moleküls
..Ö. H
.
.
+M>-I
.
.
.
.
. .. ..
Ö
sp2-® Rital
H
2pz-o rital
82Chemische Eigenschaften
Säureeigenschaften von Phenolen
..
Ö
R...H
Alkohol
Schwächer
Säure
.. ....
OH
.. .. ..
Ö
.. .
+
RO
+H
.. .
Ladung ist auf Sauerstoff lokalisiert
Eine stärkere Basis
..
....
....
.
.Ö
Ö
Ö
..
..
+H+
..
Phenol
ich
II
III
IV
Mehr
stark
Ladung delokalisiert
Säure
Schwächere Basis
Ö
Erhöhung der Basizität
< ArO < HO < RO
RC
Ö
Ö
> ArO H >HO H > RO H Entsäuerung
RC
OH
83Salzbildung
+ H2O
+NaOH
Phenol, wasserunlöslich
Oh
D
Säure
Eigenschaften
schwächen
Phenoxid
Natrium, löslich
im Wasser
Oh
EIN
Säure
Eigenschaften
Zunahme
Auf einen
Oh
Auf einen
Oh
+ NaHCO3
+ H2CO3
Stärker
Säure
Qualitative Reaktion auf Phenole.
Bildung farbiger Komplexe
Verbindungen mit FeCl3:
Phenol - rotviolett
Kresol - blau
Resorcin - dunkelviolett
Salicylsäure - rot
Der relativ hohe Säuregehalt von Phenolen wird bestimmt durch:
1. p-p-Konjugation von n-Elektronen von Sauerstoff und p-Elektronen von Aromaten
Kerne. Die Ladung ist delokalisiert.
2. Die О-Н-Bindung in Phenol ist stärker polarisiert, weil das O-Atom ist an das C-Atom gebunden
Zustand der sp2-Hybridisierung.
84Phenoxidion - umgebend
Nukleophil
O-Alkylierung von Phenoxidionen.
CH3I
- NaI
Oh
+
NaOH
Auf einen
CH3
SN2
H3C O SO2 O CH3
Ö
Methoxybenzol
Anizol
+
- NaOSO2OCH3
C-Alkylierung von Phenoxidionen.
O CH2 CHCH2
SN
CH2 CH CH2 Br
Aceton
O-Alkylierung
+
Auf einen
Auf einen
SN
CH2 CH CH2 Br
CH2CH CH2
Benzol
C-Alkylierung
Sauerstoff blockieren
Reaktionszentrum aufgrund
Bildung von Wasserstoff
Bindungen zwischen den Phenolationen
und überschüssiges Phenol.
85O-Acylierung von Phenoxidionen (SN).
Ö
H3C C
..
HO
..
Ö
H3C C
+
Oh
+
Ö
..
HO
..
Ö
CH2 CH3
+
H3C C
H2O HO=+1,5 kcal/mol
H2O HO=-4,6 kcal/mol
O CH2 CH3
Ö
H3C
NaOH
H2O
Oh
Neutral
molekülschwach
Nukleophil
C
Kl
H3C CO O CO CH3 , H+
Ö
H3C
C
Ö
+
Auf einen
SO2Cl
Anion stark
Nukleophil
Phenylacetat
SO2O
Phenylbenzolsulfonat
86Pommes-Neuordnung
Ö
H3C
Oh
Oh
C
Ö
AlCl3, T
CH3
+
Anbraten
Ö
o-Hydroxyacetophenon
Phenylacetat
H3C
Ö
p-Hydroxyacetophenon
Reaktionsschema
Ö
OC(O)CH3
+
Ö
C
H3C
OC(O)CH3
+
CO
AlCl3
H3C
Ö
C6H5OH
OC(O)CH3 + HO
C
CH3
87Claisen-Gruppenbildung
Ein Beispiel für eine sigmatrope Umlagerung - Verschiebung der s-Bindung
Ö
CH2
CH
Ö
CH2
CH2 190-220OC
=
Oh
Ö
CH
CH2 CHCH2
CH2
H
Allylphenylether
Allyloxybenzol
Cyclohexadienon
O CH2 CH CH CH3
220 OS
CH2 CHCH2
2-Allylphenol
Oh
CH HC CH2
CH3
Phenyl-(1-but-2-enyl)
Äther
1-(But-2-enyloxy)benzol
2-(1-Methylallyl)phenol
88Elektrophile Substitution SEAr
Oh
Oh
Oh
E
+E+
+
+
o-Isomer
H
+
E
p-Isomer
SEAr-Reaktionen im Phenoxidanion
Ö
Ö
Ö
E
+
E+
H
+
E
H
s-Komplex
s-Komplex ist ein neutrales Teilchen,
hat eine erhöhte Standfestigkeit
89Halogenierung, SEAr
Hochpolares Lösungsmittel - Dissoziation von Phenol
Oh
+
-H3O
+
Ö
Oh
Br
H2O
+ 3Br2
Phenoxidanion
Br
H2O
+ 3HBr
Br
2,4,6-Tribromphenol
Schwach polares Lösungsmittel, Phenol dissoziiert nicht.
Oh
Oh
Oh
+Cl2
Kl
OOK
+
CCl4
(74%)
o-Chlorphenol
(26%)
Cl p-Chlorphenol
90Mechanismus der Bromierung des Phenoxidions
Ö
Ö
H
Br2.5OC
Oh
Ö
Br
Br
Br
Br
-HBr
Br
...
H2O
Br
2,4,6-Tribromphenol
Halogenierung von Phenol in Gegenwart einer starken Säure
Oh
Oh
+
br2,
HBr, 5OC
H2O
+
HBr
Völlig überfordert
Phenoldissoziation
(81%)
Br
4-Bromphenol
91Nitrierung, SEAr
Oh
Oh
Oh
NO2
20% HNO3, 10OC
+
-H2O
+
o-Isomer wird abgetrennt
bei der Destillation mit Wasser
Fähre.
NO2
ipso-Nitrierung
Oh
Produkte
Oxidation
Oh
SO3H
HNO3, 0OC
H2SO4 , 100OC
SO3H
Oh
O2N
Oh
SO3H
HNO3,100OCO2N
NO2
ipso-Substitution
SO3H
NO2
(70%)
92Sulfonierung, SEAr
Oh
Oh
SO3H
20OC
+
Oh
H2SO4,
Konz.
Kinetisch
Kontrolle
SO3H (51%)
(49%)
Oh
Oh
SO3H
120OC
thermodynamisch
Kontrolle
+
(4%)
SO3H (96%)
93Friedel-Crafts Alkylation, SEAr.
Oh
+
CH3
H2C
C
CH3
KU-2
H3C
H3C
CH3
CH3
CCH3
CH3
Oh
C
CH3
CH3
p-Kresol
2,3-Di-tert.-butyl-4-methylphenol
Ionol
Oh
H3C
+
H3C
CH
CH3
HF, 0-8 OC H C
3
Oh
HC
CH3
CH
CH3
Oh
CH
CH3
CH3
2,4,6-Triisopropylphenol
94Friedel-Crafts Acylation, SEAr
Oh
Ö
+
H3C
C
Ö
AlCl3; 140OC
Ö
AlCl3
CH3 Fries-Umlagerung
Kl
CH3
Ö
Ö
+HO
HO
CH3
1-(2-Hydroxyphenyl)ethanon
1-(4-Hydroxyphenyl)ethanon
Oh
+
CH3COOH BF3
20
OK
Ö
C
HO
CH3
(95%)
95Kondensation von Phenol mit Phthalsäureanhydrid, SEAr
Eine Variation der Friedel-Crafts-Acylierungsreaktion (A. Bayer).
Oh
HO
Ö
Oh
C
2
+
Ö
H2SO4, 120OC
C
Ö
C
C
Ö
Ö
Phenolphthalein
Phthalisch
Anhydrid
Azo-Kombination, SEAr
+
N2Cl
Salzsäure
Phenyldiazonium
(Elektrophil)
+
Auf einen
+
N
N
Oh
4-Phenylazophenol
96Formylierung von Phenolen.
Riemeier-Thiemann-Reaktion.
Oh
Oh
60
Oh
CHO
OK
Kl
+
+ CHCl3 + NaOH CHCl-HO
3
CHCl3OH-
2
(20%)
o-Hydroxybenzaldehyd
CHO
(10%)
+
+ .CCl2
H2O
+ .CCl3
Dichlorcarben-Elektrophil, nicht
eine Anklage haben.
Kohlenstoff hat
6 Elektronen
Formylierung von Phenolen mit anderen Reagenzien
Oh
Oh
+ HCN + HCl
AlCl3
4-Oxybenzaldehyd
Benzol, 40
Betriebssystem
(30%)
CHO
Oh
Ö
+
H
C
N
CH3
CH3
DMF
Oh
POCl3
DM, 20
4-Oxybenzaldehyd
Betriebssystem
(85%)
CHO
97Kondensation von Phenolen mit Aldehyden und Ketonen
Oh
Oh
+
H
C
Oh
CH2OH
O NaOH, HO
2
4-Hydroxymethylphenol
+
H
2-Hydroxymethylphenol
Reaktionsmechanismus
CH2OH
Oh
Ö
CH2OH
CH2O
Ö
Ö
"-
C+
H
H
"-
H
NaOH, H2O
Ö
H
Oh
CH2O
CH2OH
Oh
Ö
2
+
H3C
C
HCl
CH3
CH3
HO
C
Oh
CH3
2,2-Di(4-hydroxyphenyl)propan
Bisphenol A
98Phenol-Formaldehyd-Harz (L. Backelund, 1909).
Die erste synthetische hochmolekulare Substanz.
Oh
n
+
nHCOH
Oh
20-150OC
NaOH, H2O
Oh
Oh
Bakelit
Oh
n
HO
HO
Oh
99Carboxylierung von Phenoxidionen.
Kolbe-Schmidt-Reaktion.
Auf einen
Oxidation.
+
CO2
Na2Cr2O7
COONa
180OC, 5 atm
Ö
Oh
Oh
H2SO4, H2O
Ö
Oh
OK
Ö
Oh
+
CO2
p-Chinon
250OC, 5 atm
OH NaCrO
2
2 7
Ö
H2SO4, H2O
KOCH
Wiederherstellung
Oh
Oh
H2, Ni, T, P
Cyclohexanol
100Epoxidharz
n
Ö
Ö
+
nCl
CH2
Ö
Epichlorhydrin
CH3
H2C
CHCH2O
Ö
C
CH3
C
OCH2CHCH2O
CH3
Oh
Ö
CH3
n
CH2CH CH2
Ö
Elastisches Material
Ö
Ö
H2C
CH2CH CH2
CHCH2
H2NCH2CH2NHCH2CH2NH2
CH2CH CH2
Ö
Polymerkettenvernetzungen, Feststoffbildung
Bromid-Butyl bekommen
Butylbromid, dessen Herstellung in dieser Arbeit beschrieben wird, wird in der organischen Synthese verwendet.
) für die Synthese von n-Octan:
2CH3CH2CH2CH2Br + 2Na CH3 (CH2) 6CH3 + 2NaBr 2) zur Gewinnung von Butin-1, das wiederum als Katalysator bei der Herstellung von Synthesekautschuk verwendet wird (Kondensation von Acetylen mit Formaldehyd): Brombutan -> Buten -> Dibrombutan -> Butin Eigenschaften von n-Butylalkohol CH 3-CH 2-CH 2-CH 2-OH Butylalkohol (n-Butanol) ist ein Vertreter der einwertigen Alkohole. Farblose viskose Flüssigkeit mit charakteristischem Geruch nach Fuselöl. Mischbar mit organischen Lösungsmitteln. Anwendung Butanol wird verwendet: · als Lösungsmittel in der Farben- und Lackindustrie, bei der Herstellung von Harzen und Weichmachern · Modifikatoren von Harnstoff- und Melamin-Formaldehyd-Harzen. · zur Gewinnung von Weichmachern: Dibutylphthalat, Tributylphosphat. · um Butylacetat und Butylacrylat und Ether mit Glykolen zu erhalten. · bei der Synthese vieler organischer Verbindungen. Anwendung als Autokraftstoff Kann, muss aber nicht konventionellen Kraftstoffen beigemischt werden. Die Energie von Butanol ist ähnlich der von Benzin. Butanol kann in Brennstoffzellen als Ausgangsstoff für die Wasserstoffproduktion verwendet werden. Im Jahr 2007 wurde Biobutanol in Großbritannien als Benzinadditiv verkauft. Molmasse 74,12 g/mol Dichte 0,81 g/cm 3 Siedetemperatur 117,4º AUS Löslichkeit in Wasser 7,9 g / 100 ml Brechungsindex 1,399 Methoden zur Gewinnung von Butanol 1)Oxosynthese aus Propylen in Gegenwart von HCo(CO) 4bei 120-160°С und 20-35 MPa: CH 3 -CH =CH 2+CO+H 2® CH 3CH 2CH 2CHO+ (CH 3)2CHCH =Ö CH 3(CH 2)3OH + (CH 3)2CHCH 2Oh 2)Aus Propylen in einer Stufe unter Druck. 1,0-1,5 MPa (nach Reppe): CH 3 -CH =CH 2+ 3CO + 2H 2Ö CH 3(CH 2)3OH + (CH 3)2CHCH 2OH+2CO 2
)Von Acetaldehyd über Acetaldol und Crotonaldehyd, der an Kupfer-, Kupfer-Chrom- oder Nickelkatalysatoren hydriert wird: 2CH 3CHO CH 3CH(OH)CH 2CHO CH 3CH =CHCHO CH 3(CH 2)3Oh )Aceton-Butyl-Fermentation von Lebensmitteln. rohes Material; das Verhältnis der resultierenden Produkte - Aceton: n-Butanol: Ethanol = 3:6:1 Eigenschaften von Butylbromid Butylbromid (CH 3CH 2CH 2CH 2Br) ist eine farblose viskose Flüssigkeit. Leicht löslich in Wasser, gut löslich in Ethanol, Aceton, Ether. Molmasse 137,02 g/mol Dichte 1,299 g/cm 3
Schmelzpunkt -112,4 º AUS Siedepunkt 101,6 º AUS Brechungsindex 1,4398 Empfangsmethode KBr + H 2ALSO 4® HBr + KHSO 43CH 2CH 2CH 2OH+HBr ® CH 3CH 2CH 2CH 2Br+H 2Ö Butylalkohol-Schwefelbromid Der Reaktionsmechanismus ist die nukleophile Substitution (S N 2)
3CH 2CH 2CH 2OH + KBr + H 2ALSO 4® CH 3CH 2CH 2CH 2Br+KHSO 4+H 2Ö Reagenzien: n-Butylalkohol …………………………. 11,5ml (9g) Kaliumbromid ……………………………. 18,5 gr Schwefelsäure ( ρ=1,84) …………………..15ml Calciumchlorid Geschirr und Ausstattung: Heizmantel, Rundkolben, Rückflusskühler, Trichter, Vorlage, Thermometer. Fortschritt der Synthese Montieren Sie die Syntheseapparatur, bestehend aus einem Erhitzer, einem Rundkolben und einem Rückflusskühler. In einen Rundkolben werden 17,5 ml Wasser eingefüllt, mit Kaliumbromid und Butylalkohol versetzt und ein Rückflusskühler aufgesetzt. Ein Trichter wird in die Forshtos des Kühlschranks eingeführt und 15 ml konzentrierte Schwefelsäure werden in kleinen Portionen (jeweils 2-3 ml) unter ständigem Rühren hindurchgegossen. Kessel werden in den Kolben geworfen und vorsichtig zum leichten Sieden erhitzt, 1 Stunde gekocht, dann der Rückflusskühler durch einen absteigenden Kühler (Liebig-Kühlschrank) ersetzt, die Heizung erhöht und Butylbromid in eine Vorlage mit abdestilliert Wasser. Die Destillation ist beendet, wenn die öligen Butylbromidtropfen nicht auf den Boden der Vorlage sinken. Der Inhalt des Auffangbehälters wird in einen Scheidetrichter überführt, die untere Schicht wird sorgfältig vom Wasser getrennt und in einem trockenen Kolben gesammelt. Um Wasserspuren zu entfernen, wird Butylbromid 10–15 Minuten lang mit wasserfreiem Calciumchlorid „abgelassen“, wobei der Kegel regelmäßig geschüttelt wird. Wenn die Flüssigkeit transparent wird, gilt der Trocknungsprozess als abgeschlossen. Butylbromid wird vom festen Niederschlag von Calciumchlorid durch Dekantieren (Ablassen über den Rand) in einen Destillationskolben abgetrennt. Die Apparatur zur einfachen Destillation wird vorher gründlich getrocknet. Der Empfänger wird gewogen. Butylbromid wird langsam destilliert, wobei eine im Bereich von 98–103 siedende Fraktion entnommen wird º C. Bestimmen Sie das Volumen des erhaltenen Produkts, messen Sie seinen Brechungsindex. Beenden Sie gemäß dem Handbuch 12,5 g. Beobachtungen zum Versuchsablauf. Nach der Reaktion von Kaliumbromid und n-Butanol mit Schwefelsäure trennte sich das Gemisch in zwei Schichten: Die obere ölige Schicht ist hellbraun und die untere transparent. Die Destillation wurde durchgeführt, bis die öligen Tropfen aufhörten, auf den Boden der Vorlage zu tropfen. Beim Trocknen quollen die Calciumchloridstücke deutlich, was auf eine große Wassermenge im resultierenden Produkt hinwies. Während der Destillation wurde das Produkt fast transparent. Das resultierende Produkt wurde durch ein IR-Spektrum identifiziert. Anhand des Spektrums wurden folgende Schlüsse gezogen: · Es gibt eine intensive C-H-Absorptionsbande in sp 3- Hybridzustand im Bereich von 2900 cm -1, was die Anwesenheit anzeigt - CH 2- Kohlenwasserstoffrest · Es gibt eine Absorptionsbande von 1250 cm -1, charakteristisch für eine Klasse von Etherverbindungen, die aufgrund einer möglichen intermolekularen Dehydratisierung des Alkohols im Rohprodukt vorhanden sein könnten · Beobachtung einer Bande mittlerer Intensität bei 1050 cm -1, was auf das Vorhandensein von primärem Alkohol hinweist