Wie unterscheiden sich die Isotope von Chlor? Nuklide
Einleitung………………………………………………………………………………………………………3
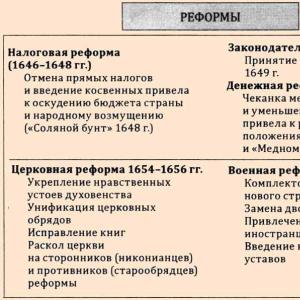
1. Symbol eines Elements, seine Position im Periodensystem der Elemente D.I. Mendelejew. Atommasse……………………………………………………………………………….4
2. Die Struktur des Kerns des Chloratoms. Mögliche Isotope. Beispiele………………………….5
3. Elektronische Formel des Atoms: Verteilung der Elektronen auf Ebenen, Unterebenen, Hunderzellen. Angeregter Zustand des Chloratoms…………………………………………………………….6
4. Wertigkeit des Aluminiumatoms im stationären und angeregten Zustand. Mögliche Oxidationsstufen des Chloratoms. Redox-Eigenschaften. Beispiele für Elektronenbewegungsschemata………………………………………………………………………………….8
5. Äquivalente von Chlor und seinen Verbindungen. Beispiele für Berechnungen……………………………..11
6. Chemische Eigenschaften von Chlor und seinen Verbindungen. Beispiele für Reaktionen…………………12
7. Arten von Konzentrationen……………………………………………………………………………….15
8. Elektrolytische Dissoziation. Schema des Hydroxid-Dissoziationsprozesses. Dissoziationskonstante……………………………………………………………………………………17
9. Berechnung von pH, pOH einer 0,01 m Lösung von Hydroxid oder Salz eines Elements………………………21
10. Hydrolyse……………………………………………………………………………..23
11. Qualitative Analyse von Chlor………………………………………………………………24
12. Methoden zur quantitativen Bestimmung des Chloratoms oder seiner Verbindungen……………27
12.1. Gravimetrische Methode zur Analyse des Chloratoms………………………………………………………...27
13. Fazit……………………………………………………………………………….29
Referenzen……………………………………………………………………………32
Einführung
Die Verbindung mit Wasserstoff – gasförmiger Chlorwasserstoff – wurde erstmals 1772 von Joseph Priestley gewonnen. Chlor wurde 1774 vom schwedischen Chemiker Karl Wilhelm Scheele gewonnen, der seine Isolierung bei der Reaktion mit Pyrolusit und Salzsäure in seiner Abhandlung über Pyrolusit beschrieb:
Scheele bemerkte den Geruch von Chlor, ähnlich dem Geruch von Königswasser, seine Fähigkeit, mit Gold und Zimt zu interagieren, sowie seine bleichenden Eigenschaften. Scheele schlug jedoch in Übereinstimmung mit der damals in der Chemie vorherrschenden Phlogiston-Theorie vor, dass Chlor dephlogistisierte Salzsäure sei. Bertholley und Lavoisieve begründeten im Rahmen der Sauerstofftheorie der Säuren, dass die neue Substanz dies tun sollte ein Oxid eines hypothetischen Elements sein Muria. Versuche, es zu isolieren, blieben jedoch erfolglos, bis es Davy gelang, durch Elektrolyse Speisesalz in Natriumchlor zu zerlegen und so dessen elementare Natur zu beweisen.
1. Symbol eines Elements, seine Position im Periodensystem der Elemente D.I. Mendelejew. Atommasse
X  lor (aus dem Griechischen χλωρός – „grün“) ist ein Element der 17. Gruppe des Periodensystems der chemischen Elemente (nach der veralteten Klassifikation - ein Element der Hauptuntergruppe der Gruppe VII), der dritten Periode, mit der Ordnungszahl 17. Gekennzeichnet durch das Symbol Cl (lat. Chlorum). Chemisch aktives Nichtmetall. Es gehört zur Gruppe der Halogene (ursprünglich wurde der Name „Halogen“ vom deutschen Chemiker Schweiger für Chlor verwendet – wörtlich wird „Halogen“ mit Salzoxid übersetzt –, aber es setzte sich nicht durch und wurde später im 17. Jahrhundert gebräuchlich (VIIA). ) Elementgruppe, zu der auch Chlor gehört).
lor (aus dem Griechischen χλωρός – „grün“) ist ein Element der 17. Gruppe des Periodensystems der chemischen Elemente (nach der veralteten Klassifikation - ein Element der Hauptuntergruppe der Gruppe VII), der dritten Periode, mit der Ordnungszahl 17. Gekennzeichnet durch das Symbol Cl (lat. Chlorum). Chemisch aktives Nichtmetall. Es gehört zur Gruppe der Halogene (ursprünglich wurde der Name „Halogen“ vom deutschen Chemiker Schweiger für Chlor verwendet – wörtlich wird „Halogen“ mit Salzoxid übersetzt –, aber es setzte sich nicht durch und wurde später im 17. Jahrhundert gebräuchlich (VIIA). ) Elementgruppe, zu der auch Chlor gehört).
Der einfache Stoff Chlor (CAS-Nummer: 7782-50-5) ist unter normalen Bedingungen ein giftiges Gas von gelblich-grüner Farbe, schwerer als Luft und mit stechendem Geruch. Das Chlormolekül ist zweiatomig (Formel Cl2).
Atommasse
(Molmasse)
[Komm 1] a. e.m. (g/mol)
2. Die Struktur des Kerns des Chloratoms. Mögliche Isotope. Beispiele
In der Natur kommen zwei stabile Chlorisotope vor: mit der Massenzahl 35 und 37. Ihr Gehalt beträgt 75,78 % bzw. 24,22 %.
|
Isotop |
Relative Masse, a.m.u. |
Halbwertszeit |
Art des Verfalls |
Kernspin |
|
Stabil | ||||
|
β-Zerfall von 36 Ar | ||||
|
Stabil | ||||
|
37,2 Minuten |
β-Zerfall in 38 Ar | |||
|
55,6 Minuten |
β-Zerfall zu 39 Ar | |||
|
1,38 Minuten |
β-Zerfall in 40 Ar |
3. Elektronische Formel des Atoms: Verteilung der Elektronen auf Ebenen, Unterebenen, Hunderzellen. Angeregter Zustand des Chloratoms

Chlor befindet sich im Periodensystem der chemischen Elemente in Periode 3, Gruppe VII, der Hauptuntergruppe (Halogenuntergruppe).
Ladung des Atomkerns Z = + = + 17
Anzahl der Protonen N(p+) = 17
Anzahl der Elektronen N(e-) = 17
In einem aufgeregten Zustand:
1) 3s2 3p5 3d0 + hn -> 3s2 3p4 3d1
3 ungepaarte Elektronen (2 Elektronen auf der 3p-Unterebene und 1 Elektron auf der 3d-Unterebene), daher ist die Valenz 3
Verbindungsbeispiel: HClO2, Cl2O3
2) 3s2 3p4 3d1 + hn -> 3s2 3p3 3d2
5 ungepaarte Elektronen (3 Elektronen auf der 3p-Unterebene und 2 Elektronen auf der 3d-Unterebene), daher ist die Valenz 5
Verbindungsbeispiel: HClO3, Cl2O5
3) 3s2 3p3 3d2 + hn -> 3s1 3p3 3d3
7 ungepaarte Elektronen (1 Elektron in der 3s-Unterebene, 3 Elektronen in der 3p-Unterebene und 3 Elektronen in der 3d-Unterebene), daher beträgt die Wertigkeit 5
4. Wertigkeit des Aluminiumatoms im stationären und angeregten Zustand. Mögliche Oxidationsstufen des Chloratoms. Redox-Eigenschaften. Beispiele für Elektronenbewegungsschemata
Valenzelektronen: 3s2 3p5
Im nicht angeregten Zustand hat ein Chloratom auf Energieniveau 3 ein ungepaartes Elektron, daher kann ein nicht angeregtes Chloratom die Wertigkeit 1 aufweisen. Wertigkeit 1 kommt in den folgenden Verbindungen vor:
Chlorgas Cl2 (oder Cl-Cl)
Natriumchlorid NaCl (oder Na+ Cl-)
Chlorwasserstoff HCl (oder H-Cl)
Hypochlorige Säure HOCl (oder H-O-Cl)
Redox-Eigenschaften.
HCl - Oxidationsstufe von Chlor -1
HClO3 – Oxidationsstufe von Chlor +5
HClO4 – Oxidationsstufe von Chlor +7
Eine mittlere Oxidationsstufe weist darauf hin, dass dieses Element sowohl reduzierende als auch oxidierende Eigenschaften aufweisen kann, dies ist HClO3
Oxidierende Eigenschaften weisen Elemente auf, die eine maximale Oxidationsstufe haben (sie entspricht der Nummer der Gruppe, in der sich das Element befindet). Das bedeutet, dass HClO4 ein Oxidationsmittel ist.
Das Element mit der niedrigsten Oxidationsstufe hat reduzierende Eigenschaften, d. h. HCl ist ein Reduktionsmittel.
Chlor ist ein starkes Oxidationsmittel. Als Oxidationsmittel können verschiedene Chlorverbindungen eingesetzt werden. Dabei handelt es sich um Chlor C12), hypochlorige Säure HCIO, Salze der hypochlorigen Säure – Natriumhypochlorit NaCIO oder Calciumhypochlorit Ca(CIO)2 und Chloroxid CIO2.
Durch Chlorierung werden Phenole, Kresole, Cyanide und Schwefelwasserstoff aus dem Abwasser entfernt. Zur Bekämpfung biologischer Verschmutzung von Bauwerken wird es als Biozid eingesetzt. Chlor wird auch zur Desinfektion von Wasser verwendet.
Chlor wird der Produktion in flüssiger Form mit einem Gehalt von mindestens 99,5 % zugeführt. Chlor ist ein hochgiftiges Gas und kann sich in kleinen Hohlräumen ansammeln und konzentrieren. Es ist ziemlich schwierig, mit ihm zu arbeiten. Wenn Chlor ins Wasser gelangt, hydrolysiert es zu Salzsäure. Mit einigen organischen Substanzen, die in Lösung vorliegen, kann C12 Chlorierungsreaktionen eingehen. Dadurch entstehen sekundäre Organochlorprodukte, die hochgiftig sind. Daher streben sie danach, den Einsatz von Chlor einzuschränken.
Hypochlorige Säure HCJ hat die gleiche Oxidationsfähigkeit wie Chlor. Seine oxidierenden Eigenschaften treten jedoch nur in einer sauren Umgebung auf. Darüber hinaus ist hypochlorige Säure ein instabiles Produkt – sie zersetzt sich mit der Zeit und im Licht.
Salze der unterchlorigen Säure werden häufig verwendet. Calciumhypochlorit Ca(Cl)2 ist in drei Qualitäten mit Aktivchlorkonzentrationen von 32 bis 35 % erhältlich. In der Praxis wird auch das zweibasische Salz Ca(Cl)2- 2Ca(OH)g 2H20 verwendet.
Das stabilste Natriumhypochloritsalz ist NaOCl * 5H20, das durch die chemische Reaktion von Chlorgas mit einer Alkalilösung oder durch Elektrolyse von Speisesalz in einem Bad ohne Diaphragma gewonnen wird.
ChloroxidCO2 ist ein grünlich-gelbes Gas, gut wasserlöslich und ein starkes Oxidationsmittel. Es wird durch Reaktion von Chlorit NaC102 mit Chlor, Salzsäure oder Ozon gewonnen. Bei der Wechselwirkung von Chloroxid mit Wasser kommt es nicht zu Chlorierungsreaktionen, wodurch die Bildung chlororganischer Substanzen ausgeschlossen ist. In jüngster Zeit wurden umfangreiche Untersuchungen durchgeführt, um die Bedingungen für den Ersatz von Chlor durch Chloroxid als Oxidationsmittel zu ermitteln. Eine Reihe russischer Fabriken haben fortschrittliche CO2-Technologien eingeführt.
DEFINITION
Chlor- das siebzehnte Element des Periodensystems. Bezeichnung - Cl vom lateinischen „chlorum“. Befindet sich in der dritten Periode, VIIA-Gruppe. Bezieht sich auf Nichtmetalle. Die Atomladung beträgt 17.
Die wichtigste natürliche Chlorverbindung ist Natriumchlorid (Speisesalz) NaCl. Der Großteil von Natriumchlorid kommt im Wasser der Meere und Ozeane vor. Auch das Wasser vieler Seen enthält erhebliche Mengen NaCl. Es kommt auch in fester Form vor und bildet in der Erdkruste stellenweise dicke Schichten aus sogenanntem Steinsalz. Auch andere Chlorverbindungen kommen in der Natur häufig vor, beispielsweise Kaliumchlorid in Form der Mineralien Carnallit KCl × MgCl 2 × 6H 2 O und Sylvit KCl.
Unter normalen Bedingungen ist Chlor ein gelbgrünes Gas (Abb. 1), das in Wasser gut löslich ist. Beim Abkühlen werden aus wässrigen Lösungen kristalline Hydrate freigesetzt, bei denen es sich um Clarate der ungefähren Zusammensetzung Cl 2 × 6H 2 O und Cl 2 × 8H 2 O handelt.
Reis. 1. Chlor in flüssigem Zustand. Aussehen.
Atom- und Molekülmasse von Chlor
Die relative Atommasse eines Elements ist das Verhältnis der Masse eines Atoms eines bestimmten Elements zu 1/12 der Masse eines Kohlenstoffatoms. Die relative Atommasse ist dimensionslos und wird mit A r bezeichnet (der Index „r“ ist der Anfangsbuchstabe des englischen Wortes „relative“, was „relativ“ bedeutet). Die relative Atommasse von atomarem Chlor beträgt 35,457 amu.
Die Massen von Molekülen sowie die Massen von Atomen werden in Atommasseneinheiten ausgedrückt. Die Molekülmasse einer Substanz ist die Masse eines Moleküls, ausgedrückt in atomaren Masseneinheiten. Die relative Molekülmasse einer Substanz ist das Verhältnis der Masse eines Moleküls einer bestimmten Substanz zu 1/12 der Masse eines Kohlenstoffatoms, dessen Masse 12 amu beträgt. Es ist bekannt, dass das Chlormolekül zweiatomig ist – Cl 2. Das relative Molekulargewicht eines Chlormoleküls ist gleich:
Mr (Cl 2) = 35,457 × 2 ≈ 71.
Isotope von Chlor
Es ist bekannt, dass Chlor in der Natur in Form der beiden stabilen Isotope 35 Cl (75,78 %) und 37 Cl (24,22 %) vorkommt. Ihre Massenzahlen betragen 35 bzw. 37. Der Kern eines Atoms des Chlorisotops 35 Cl enthält siebzehn Protonen und achtzehn Neutronen, und das Isotop 37 Cl enthält die gleiche Anzahl Protonen und zwanzig Neutronen.
Es gibt künstliche Chlorisotope mit Massenzahlen von 35 bis 43, von denen 36 Cl mit einer Halbwertszeit von 301.000 Jahren das stabilste ist.
Chlorionen
Das äußere Energieniveau des Chloratoms verfügt über sieben Elektronen, bei denen es sich um Valenzelektronen handelt:
1s 2 2s 2 2p 6 3s 2 3p 5 .
Durch chemische Wechselwirkung kann Chlor seine Valenzelektronen verlieren, d.h. ihr Donor sein und sich in positiv geladene Ionen verwandeln oder Elektronen von einem anderen Atom aufnehmen, d.h. seien ihr Akzeptor und verwandeln sich in negativ geladene Ionen:
Cl 0 -7e → Cl 7+ ;
Cl 0 -5e → Cl 5+ ;
Cl 0 -4e → Cl 4+ ;
Cl 0 -3e → Cl 3+ ;
Cl 0 -2e → Cl 2+ ;
Cl 0 -1e → Cl 1+ ;
Cl 0 +1e → Cl 1- .
Chlormolekül und -atom
Das Chlormolekül besteht aus zwei Atomen – Cl 2. Hier sind einige Eigenschaften, die das Chloratom und -molekül charakterisieren:
Beispiele für Problemlösungen
BEISPIEL 1
| Übung | Welche Menge Chlor muss man nehmen, um mit 10 Litern Wasserstoff zu reagieren? Gase unterliegen den gleichen Bedingungen. |
| Lösung | Schreiben wir die Gleichung für die Reaktion zwischen Chlor und Wasserstoff: Cl 2 + H 2 = 2HCl. Berechnen wir die Menge der reagierten Wasserstoffsubstanz: n (H 2) = V (H 2) / V m; n (H 2) = 10 / 22,4 = 0,45 mol. Nach der Gleichung ist n (H 2) = n (Cl 2) = 0,45 mol. Dann ist das Chlorvolumen, das mit Wasserstoff reagiert hat, gleich: |
Die meisten in der Natur vorkommenden Elemente bestehen aus mehreren Arten von Atomen, die sich in der relativen Atommasse unterscheiden.
Beispiel. Chlor kommt in der Natur als Gemisch aus zwei Arten von Atomen vor, von denen die eine 18 und die andere 20 Neutronen im Kern enthält.
Jede Atomart, unabhängig von der Zugehörigkeit zu einem bestimmten Element, wird eindeutig durch die Anzahl der Nukleonen (die Summe aus Protonen und Neutronen) beschrieben. Daher übersteigt die Zahl der Atomarten die Zahl der Elemente.
Jede Atomart (Kernart) wird als Nuklid bezeichnet.
Ein Nuklid ist eine Art von Atomen und Kernen, die einer bestimmten Anzahl von Protonen und Neutronen entspricht.
Nuklide, die zum gleichen Element gehören und eindeutig identifizierbar sind
Die Anzahl der Protonen, die sich jedoch in der Anzahl der Neutronen unterscheiden, nennt man Isotopennuklide oder einfach Isotope.
Isotope eines Elements sind Nuklide mit gleicher Kernladung (Anzahl Protonen).
Isotope eines Elements unterscheiden sich nur in der Anzahl der Neutronen und damit in der Gesamtzahl der Nukleonen.
Zum Beispiel: Die Kerne zweier natürlicher Chlorisotope enthalten 17 Protonen, aber 18 bzw. 20 Neutronen, also 35 bzw. 37 Nukleonen.
Aufgrund der Tatsache, dass die Anzahl der Protonen im Kern die Anzahl der Elektronen in der Hülle eines Atoms und die chemischen Eigenschaften des Elements bestimmt, folgt daraus, dass die Atome aller Isotope desselben Elements die gleiche Elektronik haben Struktur und die Isotope selbst haben ähnliche chemische Eigenschaften, weshalb sie nicht durch chemische Methoden getrennt werden können.
Es gibt Elemente in der Natur, die nur ein Isotop haben. Solche Elemente werden isotopenrein genannt. Im modernen Periodensystem gibt es 21 isotopenreine Elemente (sie sind unten in aufsteigender Reihenfolge aufgeführt): Be, F, Na, Al, P, Sc, Mn, Co, As, Y, Nb, Rh, I, Cs, Pr , Tb, Ho, Tm, Au, Bi, Th.
Die übrigen natürlichen Elemente sind eine Mischung aus zwei oder mehr Isotopen, deren Atome sich in der Anzahl der Nukleonen unterscheiden. Solche Elemente nennt man isotrop gemischt; sie stellen im Periodensystem die Mehrheit dar. Die Werte der relativen Atommassen solcher Elemente entsprechen dem natürlichen Isotopengemisch und werden über den Isotopengehalt gemittelt, daher weichen die Werte von Ag für viele Elemente stark von ganzzahligen Werten ab. Auch Kohlenstoff, der als Bezugspunkt für die relativen Atommassen anderer Elemente gilt, ist ein isotopengemischtes Element (zwei Isotope mit A, = 12 und A, = 13) und das Maß zur Bestimmung der relativen Atommasse eines der natürlichen Kohlenstoffisotope, nämlich Kohlenstoff –12. Das Element Zinn hat die größte Anzahl an Isotopen (zehn).
Bei Nukliden liegen die genauen Werte der relativen Atommassen immer nahe bei ganzzahligen Werten, sodass die Massen der Nuklide anhand dieser Werte von A r, sogenannten Massenzahlen, verglichen werden können.
Die Massenzahl eines Nuklids ist gleich der Anzahl der darin enthaltenen Nukleonen (die Summe aus Protonen und Neutronen).
Um ein bestimmtes Nuklid zu bezeichnen, werden spezielle Symbole verwendet. Links vom Symbol eines chemischen Elements wird die Massenzahl durch den hochgestellten Index und die Ladung des Kerns durch den unteren Index angegeben. Zum Beispiel: 6 12 C, 17 35 Cl usw.
Und daher unterschiedliche Atommasse.
Isotope werden mit denselben Symbolen wie ein chemisches Element bezeichnet, wobei oben links im Symbol eine Massenzahl hinzugefügt wird. Beispielsweise bedeuten Chlorisotope: 35Cl Und 37 Cl, oder die Massenzahl folgt dem Namen oder Symbol des Elements, zum Beispiel: Uran-233 oder Pu-239.
Isotope eines bestimmten chemischen Elements haben die gleiche Ladung am Atomkern, also die gleiche Ordnungszahl, und nehmen den gleichen Platz im Periodensystem ein, haben die gleiche Anzahl an Protonen im Atomkern, unterscheiden sich jedoch voneinander in die Anzahl der Neutronen. Somit enthält der Atomkern des Chlorisotops 35 Cl 17 Protonen, da die Ordnungszahl von Chlor 17 ist, und 18 Neutronen (35-17 = 18), und der Kern des Chlorisotops 37 Cl enthält 17 Protonen und 20 Neutronen (37-17 = 20) .
Einige chemische Elemente haben eine kleine Anzahl stabiler Isotope. So sind für Sauerstoff drei stabile Isotope bekannt: 16 O (der Kern besteht aus 8 Protonen und 8 Neutronen), 17 O (der Kern besteht aus 8 Protonen und 9 Neutronen) und 18 B (der Kern besteht aus 8 Protonen und 10 Neutronen). ). Auch für Wasserstoff sind drei Isotope bekannt: 1 H (der Kern besteht nur aus einem Proton), 2 H (der Kern besteht aus einem Proton und einem Neutron), 3 H (der Kern besteht aus einem Proton und zwei Neutronen). Einige chemische Elemente bestehen aus einer relativ großen Anzahl von Isotopen. Xenon hat beispielsweise 9 Isotope, Zinn hat 10 usw.
Die überwiegende Mehrheit der Isotope hat keine besonderen Namen, aber Isotope einiger Elemente, insbesondere Wasserstoffisotope, haben besondere Namen und sogar besondere Symbole. So heißt das Wasserstoffisotop 1 H Protium, das Isotop 2 H ist Deuterium und wird mit dem Symbol bezeichnet D und das Isotop 3 H ist Tritium (Symbol T). Einige Isotope kommen in der Natur recht häufig vor, beispielsweise das Sauerstoffisotop 16 O und das Wasserstoffisotop 1 H, während andere Isotope in sehr geringen Mengen vorkommen, beispielsweise die Sauerstoffisotope 17 O und 18 O sowie die Wasserstoffisotope 2 H und 3 H .
Hinsichtlich der chemischen Eigenschaften sind alle Isotope eines einzelnen Elements sehr ähnlich, sodass es keinen signifikanten Unterschied in den chemischen Reaktionen zwischen ihnen gibt. Eine Ausnahme bilden Wasserstoffisotope, die sich in ihren Eigenschaften deutlich voneinander unterscheiden.
Die Halbwertszeit instabiler Isotope kann sehr unterschiedlich sein, von 1? 10 -24 auf Werte, die das Alter des Universums überschreiten. Im letzteren Fall lässt sich durch präzise Messungen eine schwache Radioaktivität nachweisen, das Isotop kann jedoch als praktisch stabil angesehen werden.
Sorten von Atomen desselben Elements, die die gleiche Kernladung, aber unterschiedliche Massen haben, werden Isotope genannt (von den Wörtern „isos“ – das Gleiche, „topos“ – Ort).
Informationen über Isotope ermöglichen uns eine genaue Definition des Begriffs „chemisches Element“. Ein chemisches Element ist eine Atomart mit der gleichen Kernladung. Ein Isotop ist eine Atomart mit gleicher Kernladung und gleicher Masse.
Wir haben gelernt, dass Atome teilbar und nicht ewig sind. Es bleibt die Frage zu prüfen: Sind Atome desselben Elements wirklich in jeder Hinsicht identisch, insbesondere haben sie wirklich die gleiche Masse?
Da die Gesamtmasse der Elektronen, aus denen ein Atom besteht, im Vergleich zur Masse seines Kerns unbedeutend ist, müssen die Atomgewichte der Elemente Vielfache der Masse eines Protons oder Neutrons, also Vielfache von Eins, betragen. Mit anderen Worten, die Atomgewichte aller Elemente müssen in ganzen Zahlen (genauer gesagt in der Nähe von ganzen Zahlen) ausgedrückt werden. In einigen Punkten ist diese Schlussfolgerung gerechtfertigt. Es gibt jedoch viele Elemente, deren Atomgewichte in Bruchzahlen ausgedrückt werden. Das Atomgewicht von Chlor beträgt beispielsweise 35,45. Tatsächlich gibt es in der Natur kein einziges Chloratom, das eine solche Masse hat. Das Element Chlor ist eine Mischung aus zwei Arten von Atomen: Einige Chloratome haben eine Atommasse von 35, andere 37. Die mit chemischen Methoden ermittelte Atommasse von Chlor von 35,45 ist nur das Durchschnittsgewicht seiner Atome. Es gibt mehr leichtere Atome im Chlor als schwerere; Daher liegt die durchschnittliche Masse der Chloratome mit 35,45 näher am Atomgewicht der leichten Variante – den Chloratomen.
Wie Chlor sind die meisten chemischen Elemente Mischungen von Atomen mit unterschiedlichem Atomgewicht, aber gleicher Kernladung.
Das chemische Zeichen für Chlor, Cl, bezieht sich auf eine natürliche Mischung beider Chlorisotope. Wenn wir über jedes Isotop einzeln sprechen müssen, wird der Zahlenwert der Masse des betreffenden Isotopenatoms dem Chlorzeichen 35 Cl, 37 Cl zugeordnet.
Wie Chlor sind die meisten chemischen Elemente Isotopengemische. Die Isotopenkerne jedes Elements enthalten die gleiche Anzahl an Protonen, aber eine unterschiedliche Anzahl an Neutronen. Somit enthalten die Kerne der Isotope 35 Cl und 37 Cl jeweils 17 Protonen (die Seriennummer von Chlor beträgt 17) und eine unterschiedliche Anzahl von Neutronen: Die 35 Cl-Kerne enthalten 18 Neutronen und die 37 Cl-Kerne - 20 Neutronen.
Die Atommasse eines Elements ist umso kleiner, je mehr leichte Isotope das Element enthält. Wenn die Zusammensetzung eines Elements mit einer niedrigeren Ordnungszahl überwiegend aus Atomen seiner schweren Isotope besteht und die Zusammensetzung des darauf folgenden Elements Atome seiner leichteren Isotope enthält, dann ergibt sich, dass die durchschnittliche Masse eines Atoms eines Elements mit eine höhere Ordnungszahl ist nicht mehr, sondern kleiner als das durchschnittliche Gewicht des Atomelements mit einer niedrigeren Ordnungszahl. Dies wird beispielsweise bei Argon Ar und Kalium K beobachtet.
Die extreme Ähnlichkeit der chemischen Eigenschaften von Isotopen desselben Elements trotz der unterschiedlichen Massen ihrer Atome bestätigt die zuvor getroffene Schlussfolgerung: Die Eigenschaften chemischer Elemente hängen weniger vom Atomgewicht als vielmehr von der Ladung des Atomkerns ab.