كما تسمى الهياكل الداخلية للميتوكوندريا. هيكل ووظائف الميتوكوندريا والبلاستيدات
الميتوكوندريا
في خلايا الأنسجة الحيوانية ، تم العثور على الميتوكوندريا في عام 1882 ، وفي النباتات فقط في عام 1904 (في أنثرات زنابق الماء). كان من الممكن إنشاء وظائف بيولوجية بعد فصل وتنقية الكسر بواسطة الطرد المركزي الكسري. أنها تحتوي على 70 ٪ من البروتين وحوالي 30 ٪ من الدهون ، وكمية صغيرة من الحمض النووي الريبي والحمض النووي ، والفيتامينات A ، B 6 ، B 12 ، K ، E ، والأحماض الفوليك والبانتوثنيك ، الريبوفلافين ، الإنزيمات المختلفة. الميتوكوندريا لها غشاء مزدوج ، والعزل الخارجي للعضيات من السيتوبلازم ، والأشكال الداخلية تتطور من crista. تمتلئ المساحة الكاملة بين الأغشية بمصفوفة (الشكل 13).
وتتمثل المهمة الرئيسية للميتوكوندريا في المشاركة في التنفس الخلوي. تم تأسيس دور الميتوكوندريا في التنفس في 1950-1951. يتركز نظام إنزيم معقد لدورة كريبس على الأغشية الخارجية. أثناء أكسدة ركائز التنفس ، يتم إطلاق الطاقة المتراكمة فورًا في جزيئات ADP المشكلة ، أساسًا ATP ، خلال الفسفرة المؤكسدة التي تحدث في cristae. يتم استخدام الطاقة المخزنة في المركبات الكلية في المستقبل لتلبية جميع احتياجات الخلية.
يحدث تكوين الميتوكوندريا في الخلية بشكل مستمر من الأجسام المجهرية ، وغالبًا ما يرتبط حدوثها بتمايز الهياكل الغشائية في الخلية. يمكن استعادتها في الخلية بتقسيمها وتبرعمها. الميتوكوندريا ليست دائمة ، والعمر المتوقع هو 5-10 أيام.
الميتوكوندريا هي محطات الخلايا "السلطة". وهي تركز الطاقة ، التي يتم تخزينها في "مراكم" الطاقة - جزيئات ATP ، ولا تتبدد في الخلية. انتهاك بنية الميتوكوندريا يؤدي إلى تعطيل عملية التنفس ، ونتيجة لذلك ، إلى أمراض الجسم.
جهاز جولجي.جهاز جولجي (مرادف - dictiosomes) هو كومة من 3-12 مسطح ، مغلق ، وتحيط به أقراص الغشاء المزدوج تسمى الدبابات ، من حوافها التي يتم تثبيت العديد من الفقاعات (300-500). عرض الخزانات هو 6-90 A ، سمك الأغشية هو 60-70 A.
جهاز Golgi هو مركز لتوليف وتراكم وعزل السكريات ، ولا سيما السليلوز ، ويشارك في توزيع البروتينات ونقلها داخل الخلايا ، وكذلك في تكوين فراغات وليزوزومات. في الخلية النباتية ، كان من الممكن تتبع مشاركة جهاز Golgi في ظهور اللوحة المتوسطة ونمو غشاء السليلوز المستقيم الخلوي.
تم تطوير جهاز Golgi خلال فترة حياة الخلية النشطة. مع تقدم العمر ، ضمور تدريجيا ثم يختفي.
الجسيمات الحالة.الجسيمات الحالة - صغيرة إلى حد ما (حوالي 0.5 ميكرون في القطر) الهيئات مدورة. وهي مغلفة بغشاء البروتين الشحمي. محتويات الليزوزومات هي العديد من الإنزيمات المائية التي تؤدي وظيفة الهضم داخل الخلايا من الجزيئات البروتينية والأحماض النووية والسكريات. وتتمثل مهمتها الرئيسية في هضم أقسام فردية من الخلايا الأولية (الالتهام الذاتي - التهام الذات). تستمر هذه العملية بسبب البلعمة أو كثرة الكريات. الدور البيولوجي لهذه العملية ذات شقين. أولاً ، إنه واقي ، لأنه مع وجود نقص مؤقت في المنتجات الاحتياطية ، تدعم الخلية الحياة بسبب البروتينات الدستورية وغيرها من المواد ، وثانياً ، هناك إطلاق من العضيات الزائدة أو البالية (البلاستيدات ، الميتوكوندريا ، إلخ.) يمنع الغشاء الليزوزومي إطلاق الإنزيمات في السيتوبلازم خلاف ذلك ، سيتم هضمها تماما من هذه الانزيمات.
في الخلية الميتة ، يتم تدمير الليزوزومات ، وتكون الإنزيمات في الخلية ويتم هضم جميع محتوياتها. كل ما تبقى هو قذيفة السليلوز.
Lysosomes هي نتاج نشاط جهاز Golgi ، حويصلات منفصلة عنه ، حيث تراكمت هذه الأنزيمات هضم الأنزيمات.
Sferosomy - تقريب الهيئات البروتين الشحمي 0.3-0.4 ميكرون. في جميع الاحتمالات ، فهي مشتقات من جهاز Golgi أو الشبكة الإندوبلازمية. في شكلها وحجمها تشبه الليزوزومات. بما أن الأجسام الشبه الكروية تحتوي على الفوسفاتيز الحمضي ، فربما تكون مرتبطة بالليزومات. يعتقد بعض المؤلفين أن الكروسومات والليزوزومات تعادل بعضها البعض ، ولكن على الأرجح في الأصل والشكل فقط. هناك افتراض حول مشاركتهم في تخليق الدهون (A. Frey-Wissling).
ريبوسوم - عضويات صغيرة جدا ، قطرها حوالي 250A ، فهي شبه كروية الشكل. يرتبط بعضها بالأغشية الخارجية للشبكة الإندوبلازمية ، بعضها في حالة حرة في السيتوبلازم. يمكن أن تحتوي الخلية على ما يصل إلى 5 ملايين ريبوسوم. توجد الريبوسومات في البلاستيدات الخضراء والميتوكوندريا ، حيث تقوم بتوليف جزء من البروتينات التي تتكون منها هذه الكائنات العضوية ، والإنزيمات التي تعمل فيها.
وتتمثل المهمة الرئيسية في تخليق بروتينات معينة وفقا لمعلومات من النواة. تكوينها: البروتين وحمض الريباسي الريبي (RNA) بنسب متساوية. هيكلها هو وحدات فرعية صغيرة وكبيرة تتشكل من ريبونوكليوتيد.
الأنابيب الدقيقة.ميكروتثبول - مشتقات غريبة من الشبكة الإندوبلازمية. وجدت في العديد من الخلايا. يتحدث اسمها نفسه عن شكلها - واحد أو اثنين ، الموجود في مواز ، أنابيب مع تجويف في الداخل. خارج القطر داخل 250A. تم بناء جدران الأنابيب الدقيقة من جزيئات البروتين. تتشكل خيوط المغزل من الأنابيب الدقيقة أثناء انقسام الخلايا.
جوهر
تم اكتشاف النواة في خلية نباتية بواسطة ر. براون في عام 1831. تقع في وسط الخلية أو بالقرب من غشاء الخلية ، ولكنها محاطة بالسيتوبلازم من جميع الجوانب. في معظم الحالات ، هناك نواة واحدة في الخلية ، توجد العديد من النوى في خلايا بعض الطحالب ، وكذلك الفطريات. تحتوي الطحالب الخضراء غير الخلوية على مئات النوى. خلايا متعددة النوى من لاكتيرات غير مفصلية. لا توجد نوى في خلايا البكتيريا والطحالب الخضراء المزرقة.
غالبًا ما يكون شكل اللب قريبًا من شكل الكرة أو القطع الناقص. يعتمد على شكل وعمر ووظيفة الخلية. في الخلية المارستمية ، تكون النواة كبيرة ومستديرة الشكل وتحتل 3/4 حجم الخلية. في الخلايا المتنيّة للبشرة التي لها فجوة مركزية كبيرة ، يكون للنواة شكل عدسي ويتم تحريكها مع السيتوبلازم إلى محيط الخلية. هذا هو علامة على خلية متخصصة ، ولكن الشيخوخة بالفعل. يمكن للخلية التي تفتقر إلى النواة أن تعيش لفترة قصيرة فقط. الخلايا الخالية من الأسلحة النووية في أنابيب الغربال هي خلايا حية ، لكنها لا تعيش طويلاً. في جميع الحالات الأخرى ، الخلايا الخالية من الأسلحة النووية ميتة.
جوهر لديه قذيفة مزدوجة ، من خلال المسام التي محتويات
تستطيع النواة (النوكليوبلازم) التواصل مع محتويات السيتوبلازم. تم تجهيز أغشية الأغشية في النواة بالريبوسومات وتتواصل مع أغشية الشبكة الإندوبلازمية للخلية. في النوكليوبلازم ، توجد نواة أو كروموسومات واحدة أو اثنتان. Nucleoplasm هو نظام الغروية من Zola ، تشبه الجيلاتين سميكة في الاتساق. وفقًا للكيميائيين الحيويين الروسيين (Zbarsky I.B. et al.) ، يحتوي اللب على أربعة أجزاء من البروتينات: البروتينات البسيطة - الجلوبيولين 20٪ ، بروتينات الأكسجين الريبي النووي - 70٪ ، البروتينات الحمضية - 6٪ والبروتينات المتبقية 4٪. يتم توطينها في الهياكل النووية التالية: بروتينات الدنا (البروتينات القلوية) في الكروموسومات ، وبروتينات الحمض النووي الريبي (البروتينات الحمضية) في النواة ، جزئيًا في الكروموسومات (أثناء تخليق الرنا المرسال) وفي الغشاء النووي. تشكل الجلوبيولين أساس النوكليوبلازم. تشكل البروتينات المتبقية (الطبيعة غير محددة) غشاءًا نوويًا.
الجزء الأكبر من البروتينات الأساسية عبارة عن بروتينات قلوية معقدة ، بروتينات ديوكسي ريبونوكلوبروتينية ، والتي تعتمد على الحمض النووي.
جزيء الحمض النووي.جزيء الحمض النووي - متعدد النيوكليوتيدات ويتكون من النيوكليوتيدات. يتكون النوكليوتيدات من ثلاثة مكونات: جزيء السكر (ديوكسي ريبوز) ، جزيء النيتروجين وجزيء حمض الفوسفوريك. يرتبط Deoxyribose مع قاعدة النيتروجين glycosidic ، وحمض الفوسفوريك - رابطة الأثير. في الحمض النووي ، في مجموعات مختلفة ، هناك فقط 4 أنواع من النيوكليوتيدات التي تختلف عن بعضها البعض في القواعد النيتروجينية. اثنان منهم (الأدينين والجوانيين) ينتميان إلى مركبات نيتروجين البيورين ، والسيتوزين والثيمين للبيريميدين. لا توجد جزيئات الحمض النووي على نفس المستوى ، ولكنها تتكون من شقين حلزونيين ، أي اثنين من سلاسل متوازية الملتوية واحد حول الآخر شكل واحد جزيء الحمض النووي. يتم ربطها ببعضها البعض عبر رابطة هيدروجينية بين القواعد النيتروجينية ، وتربط قواعد البيورين في سلسلة واحدة قواعد بيريميدين في الأخرى (الشكل 14). تم اكتشاف بنية وكيمياء جزيء الحمض النووي من قبل علماء اللغة الإنجليزية (كريك) والأمريكان (واتسون) ونشرت في عام 1953. وتعتبر هذه النقطة بداية لتطور علم الوراثة الجزيئي. يبلغ الوزن الجزيئي للحمض النووي 4-8 مليون ، وعدد النكليوتيدات (خيارات مختلفة) يصل إلى 100 ألف. جزيء الحمض النووي مستقر للغاية ، ويضمن استقراره من خلال حقيقة أنه يتمتع بنفس السماكة - 20A (8A - عرض قاعدة بيريميدين + 12A - عرض قاعدة البيورين). إذا تم إدخال الفسفور المشع في الجسم ، فسيتم اكتشاف الملصق في جميع المركبات المحتوية على الفسفور ، باستثناء الحمض النووي (ليفي ، سيكويتز).
جزيئات الحمض النووي هي الناقل للوراثة ، لأن هيكلها يشفر معلومات عن تخليق البروتينات المحددة التي تحدد خصائص الجسم. يمكن أن تحدث التغييرات تحت تأثير العوامل المسببة للطفرات (الإشعاع الإشعاعي ، الفاعل ، العوامل الكيميائية - قلويدات ، كحوليات ، إلخ).
جزيء الحمض النووي الريبي.جزيئات الحمض الريبي النووي (RNA) جزيئات الحمض النووي أقل بكثير. هذه هي سلاسل واحدة من النيوكليوتيدات. هناك ثلاثة أنواع من الحمض النووي الريبي: الريبوسوم ، الأطول ، التي تشكل العديد من الحلقات ، والمعلومات (المصفوفة) والنقل ، الأقصر. الريبوسوم رينا هو المترجمة في الريبوسومات من الشبكة الإندوبلازمية وتمثل 85 ٪ من إجمالي الحمض النووي الريبي للخلية.
يشبه الحمض النووي الريبي المعلوماتي في بنيته ورقة البرسيم. مقدارها 5 ٪ من إجمالي الحمض النووي الريبي في الخلية. يتم تصنيعه في النواة. يحدث التجميع في الكروموسومات خلال فترة الطور. وتتمثل مهمتها الرئيسية في نقل المعلومات من الحمض النووي إلى الريبوسومات ، حيث يحدث تخليق البروتين.
RNA النقل ، كما تم إنشاؤه الآن ، هو مجموعة كاملة من المركبات ذات الصلة في التركيب والوظيفة البيولوجية. تحتوي كل خلية حية ، وفقًا لتقدير تقريبي ، على عدد يتراوح بين 40 إلى 50 من الحمض النووي الريبي للنقل ، وعددهم الإجمالي في الطبيعة ، بالنظر إلى اختلافات الأنواع ، ضخم. (Acad. V. Engelhardt). يطلق عليها النقل لأن جزيئاتها تعمل في صيانة النقل لعملية تخليق البروتين داخل الخلايا. مع الجمع بين الأحماض الأمينية المجانية ، فإنها توصلها إلى الريبوسومات في سلسلة البروتين قيد الإنشاء. هذه هي أصغر جزيئات الحمض النووي الريبي ، تتألف في المتوسط \u200b\u200bمن 80 نيوكليوتيدات. المترجمة في مصفوفة السيتوبلازم وتشكل حوالي 10 ٪ من الحمض النووي الريبي الخلوي
يحتوي الحمض النووي الريبي على أربع قواعد نيتروجينية ، ولكن على عكس الحمض النووي ، يكون اليوراسيل محل الثيمين في الحمض النووي الريبي.
هيكل الكروموسومات.تم اكتشاف الكروموسومات لأول مرة في أواخر القرن التاسع عشر بواسطة كلاسيكيات علم الخلايا الخلوي فليمنغ وستراسبيرجر (1882 ، 1884) ، والباحث الروسي في الخلية آي. دي. اكتشفهم Chistyakov في عام 1874.
العنصر البنيوي الرئيسي للكروموسومات هو النواة. لديهم شكل مختلف. هذه إما عصي مستقيمة أو منحنية ، أجسام بيضاوية ، كرات ، تختلف أحجامها.
اعتمادًا على موقع centromere ، تتميز الكروموسومات المباشرة والمتكافئة وغير المتكافئة. يظهر الهيكل الداخلي للكروموسومات في الشكل. 15 ، 16. تجدر الإشارة إلى أن deoxyribonucleoprotein هو مونومر من كروموسوم.
في كروموسوم بروتينات النوكسي البروتينية ، 90-92 ٪ ، منها 45 ٪ من الحمض النووي و 55 ٪ من البروتين (هيستون). يتم تمثيل الحمض النووي الريبي (إعلامي) أيضًا بكمية صغيرة في الكروموسوم.
يحتوي الكروموسوم أيضًا على بنية عرضية واضحة - وجود مناطق سميكة - أقراص ، والتي عادت إلى عام 1909. كانت تسمى الجينات. اقترح هذا المصطلح العالم الدنماركي يوهانسن. في عام 1911 ، أثبت العالم الأمريكي مورغان أن الجينات هي الوحدات الوراثية الرئيسية ويتم توزيعها في الكروموسومات في ترتيب خطي ، وبالتالي ، يحتوي الكروموسوم على أقسام مختلفة نوعيًا. في عام 1934 ، أثبت العالم الأمريكي "بينتر" توقف البناء المورفولوجي للكروموسومات ووجود الأقراص في الكروموسومات ، والأقراص هي أماكن لتراكم الحمض النووي. كان هذا بمثابة بداية لإنشاء خرائط الكروموسومات ، والتي تشير إلى موقع (موضع) موقع الجين الذي يحدد سمة أو أخرى من سمات الكائن الحي. الجين هو منطقة حلزونية مزدوجة للحمض النووي تحتوي على معلومات حول بنية البروتين الواحد. هذا جزء من جزيء الحمض النووي الذي يحدد تخليق جزيء بروتين واحد. الحمض النووي لا يشارك مباشرة في تخليق البروتين. أنه يحتوي فقط ويخزن معلومات حول هيكل البروتين.
هيكل الحمض النووي ، الذي يتألف من عدة آلاف من النيوكليوتيدات الموجودة على التوالي ، هو رمز الوراثة.
مدونة الوراثة. تخليق البروتين.كانت الرسالة الأولى حول رمز الحمض النووي (DNA) قد صدرت عن عالم الكيمياء الحيوية الأمريكي Nirenberg في عام 1961 في موسكو في المؤتمر الدولي للكيمياء الحيوية. جوهر رمز الحمض النووي هو على النحو التالي. يتوافق كل حمض أميني مع جزء من سلسلة الحمض النووي المكونة من ثلاثة نيوكليوتيدات متجاورة (ثلاثة توائم). لذلك ، على سبيل المثال ، فإن الموقع الذي يتكون من TT-T (ثلاثة أضعاف من 3 النيوكليوتيدات المحتوية على الثيمين) يتوافق مع ليسين الأحماض الأمينية ، ثلاثي أ (أدينين) - C (سيتوزين) - أ (أدينين) - سيستين ، إلخ. لنفترض أن الجين يمثله سلسلة من النيوكليوتيدات مرتبة حسب الترتيب التالي: A-C-A-T-T-T-A-A-C-C-A-A-G-G-G. بعد تقسيم هذه السلسلة إلى ثلاثة توائم ، سنقوم على الفور بفك الأحماض الأمينية وبأي ترتيب سيكون موجودًا في البروتين المركب.
عدد التوليفات الممكنة من 4 النيوكليوتيدات المتاحة من 3 هو 4 × 64. بناءً على هذه النسب ، سيكون عدد التراتيلات الثلاثة المختلفة الزائدة كافياً لتوفير معلومات حول تخليق العديد من البروتينات التي تحدد بنية ووظائف الجسم. لتخليق البروتين ، يتم إرسال نسخة دقيقة من هذه المعلومات إلى الريبوسومات في شكل messenger RNA. بالإضافة إلى I-RNA ، يشارك عدد كبير من جزيئات الأحماض النووية الريبونية (t-RNAs) ، والريبوزومات ، وعدد من الإنزيمات في فك التشفير والتوليف. يرتبط كل من الأحماض الأمينية العشرين بـ T-RNA - وهو جزيء به جزيء. كل من الأحماض الأمينية 20 لديه ر الحمض النووي الريبي. تحتوي T-RNAs على مجموعات كيميائية قادرة على "التعرف" على الأحماض الأمينية الخاصة بهم ، واختياره من الأحماض الأمينية المتاحة. يحدث هذا بمساعدة إنزيمات خاصة. بعد التعرف على الحمض الأميني ، يدخل t-RNA في مركب به. يرتبط الريبوسوم ببداية سلسلة (جزيء) i-RNA ، التي تتقدم عبر i-RNA ، وتتصل مع بعضها البعض بالضبط تلك الأحماض الأمينية التي يتم ترميز ترتيبها بواسطة تسلسل النيوكليوتيدات لهذا I-RNA. نتيجة لذلك ، يتم تكوين جزيء البروتين ، والذي يتم ترميز تكوينه في أحد الجينات.
نويات- جزء هيكلي لا يتجزأ من القلب. هذه هي الأجسام الكروية. فهي قابلة للتغيير للغاية ، وتغيير شكلها وهيكلها ، وتظهر وتختفي. هناك واحد ، اثنان. لكل مصنع عدد معين. تختفي النوى عندما تستعد الخلية للانقسام ، ثم تعود إلى الظهور ؛ يبدو أنهم متورطون في تخليق الأحماض الريبية. إذا تم تدمير النواة بواسطة شعاع مركَّز من الأشعة السينية أو الأشعة فوق البنفسجية ، فسيتم قمع الانقسام الخلوي.
دور النواة في حياة الخلية. تعمل النواة كمركز للتحكم في الخلية - فهي توجه النشاط الخلوي وتحتوي على ناقلات الوراثة (الجينات) التي تحدد خصائص كائن معين. يمكن تحديد دور النواة إذا ، باستخدام التقنيات المجهرية ، وإزالته من الخلية ومراقبة نتيجة لذلك. تم إجراء سلسلة من التجارب التي تثبت دورًا مهمًا في تنظيم نمو الخلايا بواسطة Hemmerling على الطحالب الخضراء أحادية الخلية Acetobularia. يصل ارتفاع هذه الأعشاب البحرية إلى 5 سم ، ويبدو وكأنه فطر ، يشبه "الجذور" و "الساقين". أعلاه ينتهي "قبعة" كبيرة على شكل قرص. تحتوي خلية هذه الطحالب على نواة واحدة تقع في الجزء القاعدي من الخلية.
وجد Hammerling أنه في حالة قطع الساق ، يستمر الجزء السفلي في العيش ويتم تجديد الغطاء بالكامل بعد العملية. الجزء العلوي ، الخالي من النواة ، يبقى لبعض الوقت ، لكن في النهاية يموت ، ولا يستطيع استعادة الجزء السفلي. وبالتالي ، فإن نواة الحميد ضرورية للتفاعلات الأيضية الكامنة وراء النمو.
النواة تعزز تشكيل جدار الخلية. يمكن توضيح ذلك من خلال التجارب التي أجريت على Alga Voucheria و Spyrogyra. من خلال تحرير محتويات الخلايا من قطع خيوط في الماء ، يمكننا الحصول على كتل من السيتوبلازم مع واحدة ، مع العديد من النوى وبدون نوى. في الحالتين الأوليين ، تشكل غشاء الخلية بشكل طبيعي. في غياب النواة ، لم تتشكل قذيفة.
في التجارب التي أجراها I.I. Gerasimov (1890) مع spirogyra ، وجد أن الخلايا ذات النواة المزدوجة تضاعف طول وسمك البلاستيدات الخضراء. في الخلايا الخالية من الأسلحة النووية ، تستمر عملية التمثيل الضوئي ، يتشكل نشا الاستيعاب ، لكن عملية التحلل المائي الخاصة به مخففة ، وهو ما يفسره عدم وجود إنزيمات مائية يمكن تصنيعها في الريبوسومات فقط وفقًا للحمض النووي للنواة. حياة البروتوبلاست بدون النواة هي حياة رديئة وقصيرة الأجل. في تجارب II. عاشت خلايا جراسيموف الخالية من الأسلحة النووية 42 يومًا وتوفيت. واحدة من أهم وظائف النواة هي إمداد السيتوبلازم بحمض الريبونك ، وهو ضروري لتخليق البروتين في الخلية. تؤدي إزالة النواة من الخلية إلى انخفاض تدريجي في محتوى الحمض النووي الريبي في السيتوبلازم وتباطؤ تخليق البروتين فيه.
الدور الأكثر أهمية للنواة هو في نقل السمات من خلية إلى أخرى ، من كائن حي إلى كائن حي ، وهي تقوم بذلك في عملية الانشطار النووي والخلية بأكملها.
انقسام الخلايا.تتكاثر الخلايا بالقسمة. في هذه الحالة ، تتشكل خليتان ابنتيتان من خلية واحدة مع نفس المجموعة من المواد الوراثية الموجودة في الكروموسومات مثل الخلية الأم. في الخلايا الجسدية ، يتم تمثيل الكروموسومات بواسطة اثنين ، ما يسمى بالكروموسومات المتماثلة ، والتي يتم فيها وضع الجينات الأليلية (حاملات الأحرف المتعارضة ، على سبيل المثال ، بتلات البازلاء البيضاء والحمراء ، إلخ) ، علامات على أزواج من الوالدين. في هذا الصدد ، في الخلايا الجسدية للجسم النباتي ، هناك دائمًا مجموعة مزدوجة من الكروموز ، تدل على 2p. الكروموسومات لها شخصية بارزة. تعد كمية ونوعية الكروموسومات ميزة مميزة لكل نوع. لذلك ، في خلايا الفراولة تبلغ مجموعة الصبغيات المزدوجة 14 ، (2 ن) ، وشجرة التفاح 34 ، والخرشوف القدس 102 ، إلخ.
الانقسام الخيطي - تم وصف انقسام الخلايا الجسدية لأول مرة بواسطة E. Russov (1872) و I.D. Chistyakov (1874). يكمن جوهرها في حقيقة أن خليتين ابنتيتين لهما نفس مجموعة الكروموسومات تتشكل من الخلية الأم عن طريق الانقسام ، وتتكون دورة الخلية من الطور البيني والانقسام المناسب. أثبتت طريقة التصوير الإشعاعي المجهري أن الأطول والأكثر صعوبة هو الطور البيني - فترة النواة "المريحة" ، خلال هذه الفترة هناك مضاعفة المواد النووية. ينقسم الطور البيني إلى ثلاث مراحل:
Q1 - ما قبل التركيب (مدتها 4-6 ساعات) ؛
S - الاصطناعية (10-20 ساعة) ؛
Q2 - بعد التركيب (2-5 ساعات).
خلال مرحلة Q1 ، الاستعدادات جارية لاستعادة الحمض النووي. وفي المرحلة S ، يتم تقليل الحمض النووي ، وتضاعف الخلية من تزويد الحمض النووي. في مرحلة Q2 ، تتشكل الإنزيمات والهياكل اللازمة لتحفيز الانقسام. وهكذا ، في الطور البيني ، تنقسم جزيئات الحمض النووي في الكروموسومات إلى شقين متطابقين ، ويتم تجميع معلومات الحمض النووي الريبي على المصفوفة الخاصة بهم. يحمل الأخير معلومات حول بنية بروتينات معينة في السيتوبلازم ، وفي النواة ، يكمل كل من خيوط الحمض النووي النصف المفقود من جزيئه. في عملية المضاعفة هذه (الاختزال) ، تتجلى خاصية فريدة من الحمض النووي ، والتي تتمثل في قدرة الحمض النووي على إعادة إنتاج نفسه بدقة. يتم الحصول على جزيئات DNA الناتجة عن الابنة تلقائيًا عن طريق النسخ الدقيقة للجزيء الأصلي ، وذلك بسبب أثناء النسخ المتماثل ، تنضم القواعد التكميلية (АТ؛ Т-Ц ؛ إلخ) من البيئة إلى كل شوط.
في مرحلة الانقسام الانقسامي ، تصبح الكروموسومات المضاعفة ملحوظة. في الطور ، تقع جميعها في المنطقة الاستوائية ، وتقع في صف واحد. تتشكل خيوط المغزل (من الأنابيب المجهرية التي تربط بعضها البعض). تختفي قشرة النواة والنواة. تنقسم الكروموسومات السميكة بالطول إلى اثنين من الكروموسومات. هذا هو جوهر الانقسام. أنه يوفر توزيع دقيق لجزيئات الحمض النووي مضاعفة بين الخلايا ابنة. هذا يضمن نقل المعلومات الوراثية المشفرة في الحمض النووي.
في الطور ، تبدأ كروموسومات الابنة في الانتقال إلى أقطاب متقابلة. في الوسط ، تظهر الشظايا الأولى من غشاء الخلية (بلازما حادة).
في الطور ، تتشكل النوى في خلايا ابنتها. يتم توزيع محتويات الخلية الأم (عضوي) بين الخلايا الابنة الناتجة. يتكون غشاء الخلية بالكامل. هذا يكمل الحركة الخلوية (الشكل 17).
الانقسام الاختزالي - شعبة الحد تم اكتشافه ووصفه في التسعينيات من القرن الماضي بواسطة ف. بيليف. يتمثل جوهر الانقسام في أنه من خلية جسدية تحتوي على مجموعة 2n (ثنائية ، ثنائية الصبغية) من الكروموسومات ، يتم تشكيل أربع خلايا أحادية الصبغة ، مع "n" ، نصف مجموعة من الكروموسومات. هذا النوع من الانقسام معقد ويتألف من مرحلتين. الأول هو الحد من كروموسوم. توجد كروموسومات مضاعفة في المنطقة الاستوائية في أزواج (كروموسومات متوازية متوازية). في هذه اللحظة ، يمكن أن يحدث الاقتران (التصاق) بالكروم ، والتقاطع المتقاطع (التبادل) ، ونتيجة لذلك ، يتم تبادل مواقع الصبغ. نتيجة لذلك ، يصبح جزء من جينات الكروموسومات الأب جزءًا من الكروموسومات الأمهات والعكس صحيح. لا يتغير مظهر كل من الكروموسومات كنتيجة لذلك ، ولكن تكوينه النوعي يختلف. يتم إعادة توزيع وراثة الأب والأم وخلطها.
في طور الانقسام الاختزالي ، تتباعد الكروموسومات المتجانسة بمساعدة خيوط المغزل عند القطبين ، والتي بعد فترة راحة قصيرة (تختفي الخيوط ، لكن الحاجز بين النواة الجديدة لا تبدأ) ، تبدأ عملية الانقسام - مرحلة طورية حيث تتواجد كل الكروموسومات في مستوى واحد على الكروموسومات ابنة. مع مرحلة الانقسام الخيطي بمساعدة المغزل ، فإنها تتباعد عند القطبين ، حيث تتشكل أربع نوى ، ونتيجة لذلك ، أربع خلايا فردية. في خلايا بعض الأنسجة أثناء نموها ، وتحت تأثير بعض العوامل ، يحدث انقسام غير مكتمل ويتضاعف عدد الكروموسومات في النوى بسبب حقيقة أنها لا تتباعد في القطبين. نتيجة لمثل هذه الانتهاكات ذات الطبيعة الطبيعية أو الاصطناعية ، تنشأ تيتربلويد و polyploids. بمساعدة الانقسام الاختزالي ، تتشكل الخلايا الجرثومية - الأمشاج ، وكذلك الجراثيم ، وعناصر التكاثر الجنسي وغير الجنسي للنباتات (الشكل 18).
البقع هي الانشطار المباشر للنواة. مع amitosis ، لا يتشكل مغزل الانقسام ولا تتحلل قشرة النواة ، كما هو الحال في الانقسام. في السابق ، كان يعتبر البغض شكلاً بدائيًا من الانقسام. لقد ثبت الآن أنه يرتبط بتدهور الجسم. إنها نسخة مبسطة من الانشطار أكثر تعقيدا من النواة. يحدث البقع في خلايا وأنسجة النواة ، السويداء ، حمة الدرنات ، أعناق الأوراق ، إلخ.
الحبيبات الخيطية - هو عضوي حلزوني ، دائري ، ممدود أو متفرع.
تم اقتراح مفهوم الميتوكوندريا لأول مرة من قبل Benda في عام 1897. يمكن اكتشاف الميتوكوندريا في الخلايا الحية باستخدام التباين الطيفي والتجاهر المجهري في شكل حبيبات أو حبيبات أو خيوط. هذه هياكل متنقلة تمامًا يمكنها التحرك والاندماج مع بعضها البعض. عندما تكون ملوثة بطرق خاصة في الخلايا الميتة تحت المجهر الضوئي ، فإن الميتوكوندريا تشبه الحبوب الصغيرة (حبيبات) التي يتم توزيعها بشكل منتشر في السيتوبلازم أو تتركز في بعض المناطق المحددة.
نتيجة لتدمير الجلوكوز والدهون في وجود الأكسجين ، يتم توليد الطاقة في الميتوكوندريا ، ويتم تحويل المواد العضوية إلى الماء وثاني أكسيد الكربون. بهذه الطريقة ، تحصل الكائنات الحيوانية على الطاقة الأساسية اللازمة للحياة. تتراكم الطاقة في أدينوسين ثلاثي الفوسفات (ATP) ، وبشكل أكثر دقة ، في روابطها الكلية الكلية. ترتبط وظيفة الميتوكوندريا ارتباطًا وثيقًا بأكسدة المركبات العضوية واستخدام الطاقة المنبعثة أثناء تحللها لتخليق جزيئات ATP. لذلك ، غالبا ما تسمى الميتوكوندريا محطات الطاقة الخلوية ، أو عضيات التنفس الخلوي. يعمل ATP كمورد للطاقة ، حيث يقوم بنقل إحدى مجموعات الفوسفات الطرفية الغنية بالطاقة ، إلى جزيء آخر ، ويتحول إلى ADP.
من المعتقد أنه في التطور ، كانت الميتوكوندريا كائنات حية أولية بدائية النواة وأصبحت تكافلية في جسم خلية قديمة. بعد ذلك ، أصبحت ضرورية للغاية ، والتي ارتبطت بزيادة محتوى الأكسجين في الغلاف الجوي للأرض. فمن ناحية ، قامت الميتوكوندريا بإزالة الأكسجين السام الزائد للخلية ، ومن ناحية أخرى ، قدمت الطاقة.
بدون الميتوكوندريا ، تكون الخلية غير قادرة عملياً على استخدام الأكسجين كمادة توفر الطاقة ، ولا يمكنها سوى تلبية احتياجاتها من الطاقة من خلال العمليات اللاهوائية. وهكذا ، الأكسجين هو السم ، ولكن السم أمر حيوي للخلية ، والأكسجين الزائد ضار بنفس القدر من النقص.
تستطيع الميتوكوندريا تغيير شكلها والانتقال إلى تلك المناطق من الخلية حيث تكون الحاجة إليها أعلى. لذلك ، في خلايا عضلية القلب ، توجد الميتوكوندريا بالقرب من العضل الليفي ، في خلايا الأنابيب الكلوية بالقرب من نتوءات القاعدية ، وما إلى ذلك. تحتوي الخلية على ما يصل إلى ألف ميتوكوندريا ، ويعتمد عددها على نشاط الخلية.
الميتوكوندريا لها متوسط \u200b\u200bحجم مستعرض 0.5 ... 3 ميكرون. اعتمادا على الحجم ، تتميز الميتوكوندريا الصغيرة والمتوسطة والكبيرة والعملاقة (أنها تشكل شبكة متفرعة - الشبكة الميتوكوندريا). يرتبط حجم وعدد الميتوكوندريا ارتباطًا وثيقًا بنشاط الخلية واستهلاكها للطاقة. وهي متغيرة للغاية ، وبناءً على نشاط الخلية ، ومحتوى الأكسجين ، والتأثيرات الهرمونية ، يمكن أن تنتفخ وتغير عدد وبنية الكريستات ، وتختلف في عددها ، وشكلها وحجمها ، وكذلك النشاط الأنزيمي.
تعتمد الكثافة الظاهرية للميتوكوندريا ، ودرجة تطور سطحها الداخلي ، وغيرها من المؤشرات على احتياجات الطاقة للخلية. في الخلايا اللمفاوية لا يوجد سوى عدد قليل من الميتوكوندريا ، وفي خلايا الكبد هناك 2 ... 3 آلاف.
تتكون الميتوكوندريا من مصفوفة ، غشاء داخلي ، مساحة حول الميتوكوندريا ، وغشاء خارجي. الغشاء الخارجي للميتوكوندريا يفصل بين العضيات من الهيالوبلازم. عادة ما يكون له ملامح ناعمة ومغلقة بحيث يكون كيس غشاء.
يتم فصل الغشاء الخارجي من الداخل عن طريق المساحة المحيطة بالميتوكوندريا بعرض حوالي 10 ... 20 نانومتر. الغشاء الداخلي للميتوكوندريا يحد من المحتوى الداخلي الفعلي للميتوكوندريا - المصفوفة. يشكل الغشاء الداخلي نتوءات عديدة داخل الميتوكوندريا ، والتي لها مظهر من التلال المسطحة ، أو cristae.
في الشكل ، يمكن أن تتخذ الكريستات شكل الصفائح (التربيقية) والأنابيب (متعددة الأشكال عند القطع) ، ويتم توجيهها طولياً أو مستعرضًا فيما يتعلق بالميتوكوندريا.
تمتلئ كل الميتوكوندريا بمصفوفة ، والتي تبدو في صورة مجهرية إلكترونية أكثر كثافة من السيتوبلازم المحيط. مصفوفة الميتوكوندريا متجانسة (متجانسة) ، في بعض الأحيان غرامة الحبيبات ، من كثافات الإلكترون المختلفة. تم الكشف عن خيوط رفيعة بسماكة حوالي 2 ... 3 نانومتر وحبيبات بحجم 15 ... 20 نانومتر. فروع المصفوفة هي جزيئات الحمض النووي ، والحبيبات الصغيرة عبارة عن ريبوسومات الميتوكوندريا. تحتوي المصفوفة على إنزيمات ، واحدة من الحمض النووي المفصل الذين تقطعت بهم السبل ، ورايبوزومات الميتوكوندريا ، والعديد من أيونات الكالسيوم.
ويمثل نظام الحكم الذاتي لتخليق البروتين من الميتوكوندريا جزيئات الحمض النووي خالية من هيستون. الحمض النووي قصير وله شكل حلقة (دوري) ويحتوي على 37 جينة. على عكس الحمض النووي النووي ، لا يوجد عمليا أي تسلسل نيوكليوتيدات غير مشفر فيه. ميزات الهيكل والتنظيم تجمع الحمض النووي للميتوكوندريا مع الحمض النووي للخلايا البكتيرية. على الحمض النووي للميتوكوندريا ، يحدث توليف من جزيئات الحمض النووي الريبي من أنواع مختلفة: المعلومات ، ونقل (النقل) والريبوسوم. معلومات الحمض النووي الريبي للميتوكوندريا لا تتعرض للربط (الأجزاء المقطوعة التي لا تحمل حمولة المعلومات). لا يمكن للصغر حجم جزيئات الحمض النووي الميتوكوندريا تحديد تخليق جميع البروتينات الميتوكوندريا. تخضع معظم بروتينات الميتوكوندريا للتحكم الجيني لنواة الخلية ويتم تصنيعها في السيتوبلازم ، حيث يتم التعبير عن الحمض النووي للميتوكوندريا بشكل ضعيف ويمكن أن يوفر تكوين جزء فقط من إنزيمات سلسلة الفسفرة المؤكسدة. لا يشفر الحمض النووي للميتوكوندريا أكثر من عشرة بروتينات موضعية في الأغشية وهي بروتينات هيكلية مسؤولة عن التكامل السليم لمجمعات البروتين الوظيفية الفردية للأغشية الميتوكوندريا. يتم أيضًا تصنيع البروتينات التي تقوم بوظائف النقل. مثل هذا النظام من تخليق البروتين لا يوفر جميع وظائف الميتوكوندريا ، وبالتالي فإن استقلالية الميتوكوندريا محدودة ونسبية.
في الثدييات ، تنتقل الميتوكوندريا أثناء الإخصاب فقط عبر البويضة ، ويدخل الحيوان المنوي الحمض النووي في الكائن الحي الجديد.
في مصفوفة الميتوكوندريا ، تتشكل الريبوسومات التي تختلف عن الريبوسومات السيتوبلازمية. يشاركون في تخليق عدد من بروتينات الميتوكوندريا غير المشفرة بواسطة النواة. الريبوسومات الميتوكوندريا لها رقم ترسيب 60 (على عكس السيتوبلازم مع عدد الترسبات من 80). رقم الترسيب هو معدل الترسب أثناء الطرد المركزي والطرد المركزي الفائق. من حيث البنية ، تكون الريبوسومات الميتوكوندريا قريبة من الريبوسومات للكائنات بدائية النواة ، ولكنها أصغر حجماً وحساسة لبعض المضادات الحيوية (الكلورامفينيكول ، التتراسيكلين ، إلخ).
غشاء الميتوكوندريا الداخلي لديه درجة عالية من الانتقائية في نقل المواد. يتم ربط إنزيمات سلسلة الفسفرة المؤكسدة وبروتينات حامل الإلكترون و ATP و ADP والبيروفيت وأنظمة النقل الأخرى القريبة من بعضها البعض بسطحه الداخلي ، ونتيجة للترتيب الوثيق للأنزيمات على الغشاء الداخلي ، يتم ضمان الترابط العالي (التوصيل البيني) للعمليات الكيميائية الحيوية. كفاءة العمليات الحفازة.
يكشف المجهر الإلكتروني جزيئات الفطر البارزة في تجويف المصفوفة. لديهم ATP الاصطناعية (أشكال ATP من ADP) النشاط. يحدث النقل الإلكتروني على طول السلسلة التنفسية ، المترجمة في الغشاء الداخلي ، الذي يحتوي على أربعة مجمعات إنزيمية كبيرة (السيتوكرومات). عندما تمر الإلكترونات عبر سلسلة الجهاز التنفسي ، يتم ضخ أيونات الهيدروجين من المصفوفة في الفضاء المحيط بالكوندكوندريا ، مما يضمن تكوين التدرج البروتوني (مضخة). يتم استخدام طاقة هذا التدرج (الاختلافات في تركيز المواد وتكوين غشاء محتمل) لتخليق ATP ونقل المستقلبات والأيونات غير العضوية. تقوم البروتينات الحاملة الموجودة في الغشاء الداخلي بنقل الفوسفات العضوي و ATP و ADP والأحماض الأمينية والأحماض الدهنية والأحماض الثلاثية والكربوكسيلية من خلالها.
غشاء الميتوكوندريا الخارجي أكثر نفاذية للمواد ذات الوزن الجزيئي المنخفض ، لأنه يحتوي على العديد من قنوات البروتين المحبة للماء. توجد مجمعات مستقبلات محددة على الغشاء الخارجي ، يتم من خلاله نقل البروتينات من المصفوفة إلى الفضاء المحيط بالميتوكوندريا.
من حيث تركيبته وخصائصه الكيميائية ، فإن الغشاء الخارجي قريب من الأغشية الأخرى داخل الخلايا والبلازما. أنه يحتوي على الإنزيمات التي تستقلب الدهون ، وتنشط (تحفيز) تحويل الأمينات ، أوكسيديز الأمينية. إذا ظلت إنزيمات الغشاء الخارجي نشطة ، فهذا مؤشر على السلامة الوظيفية للميتوكوندريا.
هناك نوعان من الأجزاء الفرعية المستقلة في الميتوكوندريا. نظرًا لأن المساحة المحيطة بالميتوكوندريا ، أو الغرفة الخارجية للميتوكوندريا (المقصورة الفرعية الخارجية) ، قد نشأت نتيجة لاختراق مجمعات البروتين في الهيالوبلازم ، فإن الحيز الفرعي الداخلي (مصفوفة الميتوكوندريا) يتكون جزئيًا بسبب النشاط التخليقي للحمض النووي للميتوكوندريا. تحتوي الحجرة الفرعية الداخلية (المصفوفة) على الحمض النووي ، والحمض النووي الريبي ، والريبوسومات. لديه مستوى عالٍ من أيونات الكالسيوم + 2 مقارنةً بالهيالوبلازم. في الجزء الفرعي الخارجي ، تتراكم أيونات الهيدروجين. النشاط الأنزيمي للأجزاء الفرعية الخارجية والداخلية ، تكوين البروتينات مختلفة للغاية. الجزء الداخلي الفرعي به كثافة إلكترون أعلى من الجزء الخارجي.
علامات الميتوكوندريا المحددة هي أوكسيديز السيتوكروم وأنزيمات هيدروجيناز السكسينات ، والتي يسمح الكشف عنها بالتوصيف الكمي لعمليات الطاقة في الميتوكوندريا.
وتتمثل المهمة الرئيسية للميتوكوندريا - التوليف اعبي التنس المحترفين. في البداية ، يتم تدمير السكريات (الجلوكوز) في الهيالوبلازم إلى أحماض اللبنيك والبيروفيك (البيروفات) مع التوليف المتزامن لكمية صغيرة من ATP. نتيجة لتحلل جزيء الجلوكوز واحد ، يتم استخدام جزيئين ATP ، ويتم تشكيل أربعة. وهكذا ، جزيئين ATP فقط تشكل التوازن الإيجابي. تحدث هذه العمليات بدون الأكسجين (تحلل اللاهوائي).
تحدث جميع المراحل اللاحقة من إنتاج الطاقة في عملية الأكسدة الهوائية ، والتي توفر تخليق كمية كبيرة من ATP. في هذه الحالة ، يتم تدمير المواد العضوية لثاني أكسيد الكربون والماء. ويرافق الأكسدة عن طريق نقل البروتونات إلى متقبلاتها. يتم تنفيذ هذه التفاعلات باستخدام عدد من الإنزيمات في دورة حمض الكربوكسيل ، والتي توجد في مصفوفة الميتوكوندريا.
بنيت أنظمة نقل الإلكترون والتفسفر المرتبطة بها من ADP (الفسفرة المؤكسدة) في الأغشية cristal. في هذه الحالة ، يحدث نقل الإلكترونات من بروتين متقبل للإلكترون إلى آخر ، وأخيرا ربطها بالأكسجين ، نتيجة لتكوين الماء. في الوقت نفسه ، يتم تخزين جزء من الطاقة المنبعثة خلال هذه الأكسدة في سلسلة نقل الإلكترون في شكل رابطة ماكروية خلال الفسفرة ADP ، مما يؤدي إلى تكوين عدد كبير من جزيئات ATP - أي ما يعادل الطاقة الرئيسية داخل الخلايا. تحدث عملية الفسفرة المؤكسدة على أغشية cristae من الميتوكوندريا باستخدام بروتينات سلسلة الأكسدة وإنزيم فسفورياز ADP ATP الموجود هنا. نتيجة الفسفرة المؤكسدة ، تتشكل 36 جزيء ATP من جزيء الجلوكوز واحد.
بالنسبة لبعض الهرمونات والمواد الموجودة في الميتوكوندريا ، هناك مستقبلات متخصصة (تقارب). ثلاثي يودوثيرونين يسرع عادة النشاط الصناعي من الميتوكوندريا. يعمل Interleukin-1 وتركيزات عالية من ثلاثي يودوثيرونين على فصل سلاسل الفسفرة المؤكسدة ، مما يؤدي إلى تورم الميتوكوندريا ، والذي يترافق مع زيادة في تكوين الطاقة الحرارية.
تتشكل الميتوكوندريا الجديدة عن طريق الانقسام ، أو الانقباض ، أو في مهدها. في الحالة الأخيرة ، تتشكل البروتوميتوكوندريا ، ويزداد حجمها تدريجياً.
بروتوميتوكوندريا هي عضيات صغيرة ذات أغشية خارجية وداخلية. لا يحتوي الغشاء الداخلي على أو يحتوي على cristae متخلفة. يتميز الأورجانيلا بمستوى منخفض من الفسفرة الهوائية. مع تشكيل انقباض ، يتم توزيع محتويات الميتوكوندريا بين عضوتين جديدتين كبيرتين إلى حد ما. مع أي طريقة للتكاثر ، فإن كل من الميتوكوندريا المشكلة حديثًا لها جينومها الخاص.
يتم تدمير الميتوكوندريا القديمة عن طريق التحلل الذاتي (الهضم الذاتي من قبل الخلية باستخدام الليزوزومات) لتشكيل الجسيمات الذاتية. من autolysosome ، يتم تشكيل الجسم المتبقية. مع الهضم الكامل ، تفرز محتويات الجسم المتبقية ، التي تتكون من مواد عضوية منخفضة الوزن الجزيئي ، عن طريق الإفراز. مع الهضم غير المكتمل ، يمكن أن تتراكم بقايا الميتوكوندريا في الخلية في شكل أجسام أو حبيبات ذات طبقات مع نيبوفوسين. تتراكم أملاح الكالسيوم غير القابلة للذوبان في جزء من الميتوكوندريا مع تشكيل البلورات - التكلسات. يمكن أن يؤدي تراكم منتجات تنكس الميتوكوندريا إلى ضمور الخلايا.
هيكل ووظيفة الميتوكوندريا هي قضية معقدة إلى حد ما. وجود كائن عضوي هو سمة مميزة لجميع الكائنات النووية تقريبًا - سواء بالنسبة للنباتات الذاتية (النباتات القادرة على التمثيل الضوئي) وللحالات غير المتجانسة ، والتي هي جميعها حيوانات تقريبًا وبعض النباتات والفطريات.
الغرض الرئيسي من الميتوكوندريا هو أكسدة المواد العضوية والاستخدام اللاحق للطاقة المنبعثة نتيجة لهذه العملية. لهذا السبب ، تمتلك العضيات أيضًا محطات طاقة خلايا اسم (غير رسمية) ثانية. وتسمى أحيانا "البلاستيدات هدم".
ما هي الميتوكوندريا
المصطلح من أصل يوناني. ترجمت ، هذه الكلمة تعني "خيط" (mitos) ، "بذرة" (chondrion). الميتوكوندريا هي كائنات عضوية دائمة ذات أهمية كبيرة للأداء الطبيعي للخلايا وتمكن الكائن الحي بأكمله من الوجود.

"المحطات" لديها بنية داخلية محددة ، والتي تختلف تبعا للحالة الوظيفية للميتوكوندريا. يمكن أن يكون شكلها من نوعين - بيضاوي أو مستطيل. هذا الأخير في كثير من الأحيان مظهر المتفرعة. يتراوح عدد العضيات في خلية واحدة من 150 إلى 1500.
حالة خاصة هي الخلايا الجرثومية. يوجد فقط عضوي حلزوني واحد في الحيوانات المنوية ، بينما تحتوي الأمشاج الأنثوية على مئات الآلاف من الميتوكوندريا. في الخلية ، لا يتم تثبيت العضيات في مكان واحد ، ولكن يمكن أن تتحرك على طول السيتوبلازم ، تتحد مع بعضها البعض. حجمها 0.5 ميكرون ، يمكن أن يصل الطول إلى 60 ميكرون ، في حين أن الحد الأدنى للرقم هو 7 ميكرون.

إن تحديد حجم "محطة كهرباء" واحدة ليس بالأمر السهل. والحقيقة هي أنه عندما يتم فحصها في المجهر الإلكتروني ، لا يدخل سوى شريحة واحدة من العضية إلى الشريحة. يحدث أن الميتوكوندريا الحلزونية تحتوي على عدة أقسام يمكن أخذها في هياكل منفصلة ومستقلة.
فقط صورة ثلاثية الأبعاد تسمح لنا بمعرفة البنية الخلوية الدقيقة وفهم ما إذا كنا نتحدث عن 2-5 من الكائنات العضوية منفصلة أو عن واحدة ذات شكل معقد من الميتوكوندريا.
الميزات الهيكلية
يتكون غشاء الميتوكوندريا من طبقتين: خارجي وداخلي. يشمل الأخير العديد من النواتج والطيات التي لها شكل شبيه بالأنبوب.
كل غشاء له تركيبة كيميائية خاصة ، وكمية معينة من الإنزيمات والغرض المحدد. يتم فصل الغلاف الخارجي من الداخل بمساحة بين الغشاء بسمك 10-20 نانومتر.
هيكل العضوي في الشكل مع التسميات التوضيحية تبدو واضحة للغاية.

هيكل الميتوكوندريا
من خلال النظر في مخطط الهيكل ، يمكن إجراء الوصف التالي. تسمى المساحة اللزجة داخل الميتوكوندريا المصفوفة. تكوينه يخلق بيئة مواتية لتدفق العمليات الكيميائية اللازمة فيه. يحتوي على حبيبات مجهرية تساهم في التفاعلات والعمليات الكيميائية الحيوية (على سبيل المثال ، تتراكم أيونات الجليكوجين وغيرها من المواد).
تحتوي المصفوفة على الحمض النووي ، الإنزيمات المساعدة ، الريبوسومات ، الحمض النووي الريبي ، الأيونات غير العضوية. توجد سينسيز ATP والسيتوكروم على سطح الطبقة الداخلية للقذيفة. تساهم الإنزيمات في عمليات مثل دورة كريبس (CTK) ، الفسفرة التأكسدية ، إلخ.
وبالتالي ، يتم تنفيذ المهمة الرئيسية للمادة الحبيبية بواسطة المصفوفة والجانب الداخلي للقذيفة.
وظيفة الميتوكوندريا
يمكن وصف الغرض من "محطات الطاقة" بمهمتين رئيسيتين:
- إنتاج الطاقة: تتم عمليات الأكسدة فيها مع الإصدار اللاحق لجزيئات ATP ؛
- تخزين المعلومات الوراثية ؛
- المشاركة في تخليق الهرمونات والأحماض الأمينية وغيرها من الهياكل.
تتم عملية الأكسدة وإنتاج الطاقة على عدة مراحل:


رسم تخطيطي لتوليف ATP
تجدر الإشارة إلى: نتيجة لدورة كريبس (دورة حامض الستريك) ، لا تتشكل جزيئات ATP ، وتتأكسد الجزيئات ويتم إطلاق ثاني أكسيد الكربون. هذه خطوة متوسطة بين تحلل السكر وسلسلة نقل الإلكترون.
جدول "وظائف وهيكل الميتوكوندريا"

ما الذي يحدد عدد الميتوكوندريا في الخلية
يتراكم العدد السائد من المواد العضوية بالقرب من تلك الأجزاء من الخلية حيث توجد حاجة لموارد الطاقة. على وجه الخصوص ، يتم جمع عدد كبير من العضيات في منطقة العضل الليفي ، والتي تعد جزءًا من خلايا العضلات التي تضمن تقلصها.

في الخلايا الجرثومية الذكرية ، تتركز البنى حول محور السوط - من المفترض أن الحاجة إلى الـ ATP ترجع إلى الحركة المستمرة لذيل المشيج. يبدو ترتيب الميتوكوندريا في البروتوزوا ، التي تستخدم أهداب خاصة للحركة ، وكأنها تتراكم عضيات تحت الغشاء في قاعدتها بنفس الطريقة تمامًا.
بالنسبة للخلايا العصبية ، تتم ملاحظة توطين الميتوكوندريا بالقرب من المشابك التي تنتقل عبرها إشارات الجهاز العصبي. في الخلايا التي توليف البروتينات ، تتراكم العضيات في مناطق الإرغوبوبلازم - فهي توفر الطاقة التي توفر هذه العملية.
الذي اكتشف الميتوكوندريا
اكتسبت بنية الخلية اسمها في 1897-1898 بفضل C. Brand. كان أوتو فابورغ قادرًا على إثبات ارتباط التنفس الخلوي بالميتوكوندريا في عام 1920.
استنتاج
الميتوكوندريا هي أهم عنصر في الخلية الحية ، حيث تعمل كمحطة للطاقة التي تنتج جزيئات ATP ، وبالتالي تضمن عمليات النشاط الحيوي الخلوي.
يعتمد عمل الميتوكوندريا على أكسدة المركبات العضوية ، مما يؤدي إلى توليد الطاقة الكامنة.
الغشاء الخارجي
الغشاء الداخلي
قالب م على ، مصفوفة ، عرف. لديها ملامح سلسة ، لا تشكل نتوءات أو طيات. يمثل حوالي 7 ٪ من مساحة جميع أغشية الخلايا. يبلغ سمكها حوالي 7 نانومتر ، وهي غير متصلة بأي أغشية أخرى من السيتوبلازم ومغلقة في نفسها ، لذا فهي عبارة عن كيس غشائي. يتم فصل الغشاء الخارجي عن الداخل مساحة الغشاء حوالي 10-20 نانومتر واسعة. الغشاء الداخلي (حوالي 7 نانومتر) يحد من المحتوى الداخلي الفعلي للميتوكوندريا ،
مصفوفة أو ميتوبلازم. من الخصائص المميزة للغشاء الداخلي للميتوكوندريا قدرتها على تشكيل نتوءات عديدة داخل الميتوكوندريا. وغالبًا ما يكون لهذه النتوءات شكل تلال مسطحة أو كريست. المسافة بين الأغشية في crista حوالي 10-20 نانومتر. غالبًا ما يمكن أن تتفرغ الكريستات أو تشكل عمليات على شكل إصبع ، وتنحني ولا يكون لها اتجاه واضح. في البروتوزوا ، تبدو الطحالب أحادية الخلية ، في بعض خلايا النباتات والحيوانات العليا ، تشبه الغشاء الداخلي للأنابيب (cristae الأنبوبية).
تحتوي مصفوفة الميتوكوندريا على بنية متجانسة دقيقة الحبيبات ، وأحيانًا خيوط رقيقة يتم جمعها في كرة (حوالي 2-3 نانومتر) ويتم اكتشاف حبيبات حوالي 15-20 نانومتر فيها. أصبح من المعروف الآن أن فروع مصفوفة الميتوكوندريا هي جزيئات الحمض النووي في تكوين النوكليويد الميتوكوندريا ، والحبيبات الصغيرة هي ريبوسومات الميتوكوندريا.
وظيفة الميتوكوندريا
1. يحدث تخليق ATP في الميتوكوندريا (انظر الفسفرة التأكسدية)
غشاء pH ~ 4 ، مصفوفة pH ~ 8 | محتوى البروتين في م: 67 ٪ هو المصفوفة ، و 21 ٪ هو اكتشاف المنجم ، و 6 ٪ هو داخل المنجم و 6 ٪ في بين الألغام
Handrioma - نظام الميتوكوندريا واحد
m-na الخارجي: مسام porin تسمح بمرور حتى 5 كيلو دالتون الداخلية م نا: كارديوليبين منيع م جيدا للأيونات |
الإنتاج الدولي: مجموعات الإنزيمات النوكليوتيدات فسفوريلات والسكريات النيوكليوتيدات
م داخلية على:
مصفوفة: إنزيمات التمثيل الغذائي - أكسدة الدهون ، أكسدة الكربوهيدرات ، دورة حمض الكربوكسيليك ، دورة كريبس
المنشأ من البكتيريا: لا تحتوي على الأميبا Pelomyxa palustris وحدة من حقيقيات النوى ، يعيش في التعايش مع البكتيريا الهوائية | الحمض النووي الخاص | يشبه البكتيريا
الحمض النووي الميتوكوندريا
تقسيم المايوكوندريا
تكرارها
في الطور | لا يرتبط النسخ المتماثل مع المرحلة S | خلال دورة الكلور ، يتم تقسيم الميتوكرات مرة واحدة إلى قسمين ، مما يشكل انقباضًا ، والقيود أولاً على الجزء الداخلي من m-not | ~ 16.5 كيلو بايت | حلقة تشفير 2 الرنا الريباسي 22 الحمض النووي الريبي و 13 البروتينات |
نقل البروتين: إشارة الببتيد | الضفيرة البرمائية | مستقبلات التعرف على الميتوكوندريا |
الفسفرة المؤكسدة
دائرة نقل الإلكترون
سينسيز اعبي التنس المحترفين
في خلايا الكبد ، يعيش م ~ 20 يوما الانقسام الميتوكوندريا عن طريق تشكيل انقباض
16569 برميل \u003d 13 بروتينًا ، 22tRNA ، 2pRNA | m-na الخارجي الناعم (porins - نفاذية البروتينات حتى 10 كيلو دالتون) مطوية الداخلية (crista) m-na (75٪ بروتينات): بروتينات حاملة النقل ، f-you ، مكونات سلسلة الجهاز التنفسي ومصفوفة سينسيز ATP ، Cardiolipin) ( المخصب مع دورة سترات f-tami) أمور 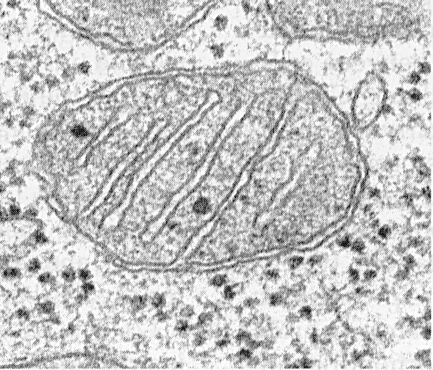
الميتوكوندريا أو الغضروفية (من اليونانية. ميتوس - خيط ، شندريون - الحبوب ، سوما - الجسم) هي عضيات حبيبية أو خيطية موجودة في السيتوبلازم من البروتوزوا والنباتات والحيوانات. يمكن ملاحظة الميتوكوندريا في الخلايا الحية ، حيث أن لها كثافة عالية إلى حد ما. في الخلايا الحية ، يمكن أن تتحرك الميتوكوندريا وتتحرك وتندمج مع بعضها البعض.
في الأنواع المختلفة ، تختلف أحجام الميتوكوندريا بشكل كبير ، وكذلك شكلها متغير (الشكل 199). ومع ذلك ، في معظم الخلايا ، يكون سمك هذه الهياكل ثابتًا نسبيًا (حوالي 0.5 ميكرون) ، ويتقلب الطول ، ليصل إلى 7-60 ميكرون في أشكال خيطية.
دراسة حجم وعدد الميتوكوندريا ليست بهذه البساطة. هذا يرجع إلى حقيقة أن حجم وعدد الميتوكوندريا المرئية على أقسام رفيعة جدًا لا تتوافق مع الواقع.
تظهر الحسابات التقليدية أن حوالي 200 ميتوكوندريا موجودة في خلية الكبد. هذا يمثل أكثر من 20 ٪ من مجموع السيتوبلازم وحوالي 30-35 ٪ من إجمالي كمية البروتين في الخلية. مساحة سطح جميع الميتوكوندريا في خلايا الكبد أكبر بـ 4-5 مرات من سطح غشاء البلازما. معظم الميتوكوندريا في البويضات (حوالي 300000) وفي فوضى الأميبا العملاقة الفوضى (ما يصل إلى 500000).
في خلايا النباتات الخضراء ، يكون عدد الميتوكوندريا أقل من الخلايا الحيوانية ، حيث أن البلاستيدات الخضراء يمكن أن تؤدي جزءًا من وظائفها.
توطين الميتوكوندريا في الخلايا مختلفة. عادة ، تتراكم الميتوكوندريا بالقرب من تلك المناطق من السيتوبلازم حيث هناك حاجة إلى ATP التي تشكلت في الميتوكوندريا. لذلك ، في العضلات والهيكل العظمي ، وتقع الميتوكوندريا بالقرب من myofibrils. في الحيوانات المنوية ، تشكل الميتوكوندريا حالة دوامة حول محور السوط ؛ هذا ربما يرجع إلى الحاجة إلى استخدام ATP لتحريك ذيل الحيوانات المنوية. بالمثل ، في البروتوزوا وفي الخلايا الأخرى المجهزة بأهداب ، تتوضع الميتوكوندريا مباشرة تحت غشاء الخلية في قاعدة الأهداب ، والتي تتطلب عمل ATP. في محاور الخلايا العصبية ، توجد الميتوكوندريا بالقرب من المشابك العصبية ، حيث تحدث عملية انتقال النبض العصبي. في الخلايا الإفرازية التي توليف كميات كبيرة من البروتينات ، ترتبط الميتوكوندريا ارتباطًا وثيقًا بمناطق إرغوبوبلازما. ربما يزودون ATP لتنشيط الأحماض الأمينية وتخليق البروتين على الريبوسومات.
البنية التحتية للميتوكوندريا.
الميتوكوندريا ، بغض النظر عن حجمها أو شكلها ، لديها بنية عالمية ، بنيتها التحتية موحدة. تقتصر الميتوكوندريا على أغشية اثنين (الشكل 205). يفصل الغشاء الخارجي للميتوكوندريا عن الهيالوبلازم ، وله ملامح ناعمة ، ولا يشكل نتوءات أو طيات ، ويبلغ سمكه حوالي 7 نانومتر. يمثل حوالي 7 ٪ من مساحة جميع أغشية الخلايا. لا يرتبط الغشاء بأي أغشية أخرى من السيتوبلازم ، وهو مغلق على نفسه وهو كيس غشائي. يتم فصل الغشاء الخارجي من الداخل عن طريق مساحة غشاء بعرض حوالي 10-20 نانومتر. الغشاء الداخلي (حوالي 7 نانومتر) يحد من المحتوى الداخلي الفعلي للميتوكوندريا ، مصفوفة أو ميتوبلازم. يشكل الغشاء الداخلي للميتوكوندريا العديد من الانتفاخات داخل الميتوكوندريا. وغالبًا ما يكون لهذه النتوءات شكل تلال مسطحة أو كريست.
السطح الكلي للغشاء الميتوكوندريا الداخلي في خلية الكبد هو ما يقرب من ثلث سطح جميع أغشية الخلايا. تحتوي الميتوكوندريا الموجودة في خلايا عضلة القلب على ثلاثة أضعاف ما تحتويه الميتوكوندريا في الكبد ، مما يعكس الاختلافات في الأحمال الوظيفية للميتوكوندريا في خلايا مختلفة. المسافة بين الأغشية في crista حوالي 10-20 نانومتر.
لا تمنع طبقات الميتوكوندريا الممتدة من الغشاء الداخلي وتمتد نحو المصفوفة تمامًا تجويف الميتوكوندريا ولا تنتهك استمرارية المصفوفة التي تملأها.
اتجاه cristae فيما يتعلق بالمحور الطويل للميتوكوندريا يختلف بالنسبة للخلايا المختلفة. الاتجاه يمكن أن يكون عمودي (الكبد والكلى) cristae. في عضلة القلب ، لوحظ وجود ترتيب طولي لل cristae. يمكن لـ Crista أن تتفرع أو تشكل عمليات على شكل إصبع ، وأن تنحني ولا يكون لها اتجاه واضح (الشكل 208). في البروتوزوا ، تبدو الطحالب أحادية الخلية ، في بعض خلايا النباتات والحيوانات العليا ، تشبه الغشاء الداخلي للأنابيب (cristae الأنبوبية).
تحتوي مصفوفة الميتوكوندريا على بنية متجانسة دقيقة الحبيبات ، حيث يتم الكشف عن جزيئات الحمض النووي في شكل خيوط رقيقة يتم جمعها في كرة (حوالي 2-3 نانومتر) وريبوزومات الميتوكوندريا في شكل حبيبات يتراوح حجمها بين 15-20 نانومتر. تشكل رواسب أملاح المغنيسيوم والكالسيوم في المصفوفة حبيبات كثيفة كبيرة (20-40 نانومتر).
وظائف الميتوكوندريا.
تقوم الميتوكوندريا بتوليف الـ ATP ، والذي يحدث نتيجة لعمليات أكسدة الركائز العضوية والتفسفر في ADP.
المراحل الأولية من أكسدة الكربوهيدرات تسمى الأكسدة اللاهوائية ، أو تحلل وتحدث في الهيالوبلازم ولا تتطلب مشاركة الأكسجين. الركيزة الأكسدة أثناء إنتاج الطاقة اللاهوائية هي hexoses ، وقبل كل شيء ، الجلوكوز. بعض البكتيريا لديها القدرة على استخراج الطاقة عن طريق أكسدة البنتوز ، والأحماض الدهنية أو الأحماض الأمينية.
في الجلوكوز ، تبلغ كمية الطاقة الكامنة الموجودة في الروابط بين ذرات C و H و O حوالي 680 سعرة حرارية لكل مول (أي ، 180 غرام من الجلوكوز).
في الخلية الحية ، يتم إطلاق هذه الكمية الضخمة من الطاقة في شكل عملية تدريجية ، يتم التحكم فيها بواسطة عدد من الإنزيمات المؤكسدة ، ولا ترتبط بانتقال طاقة الرابطة الكيميائية إلى حرارة ، كما يحدث أثناء الاحتراق ، ولكنها تنتقل إلى رابطة منضدية كبيرة في جزيئات ATP ، التي يتم تصنيعها باستخدام الطاقة المنبعثة من جزيئات ATP ADP والفوسفات.
وتشارك التقرحات التي تشكلت نتيجة انحلال السكر في الدم ، وفي المقام الأول حمض البيروفيك ، في أكسدة أخرى في الميتوكوندريا. في هذه الحالة ، يحدث استخدام طاقة انشقاق جميع الروابط الكيميائية ، مما يؤدي إلى إطلاق ثاني أكسيد الكربون ، إلى استهلاك الأكسجين وتوليف كمية كبيرة من ATP. ترتبط هذه العمليات بدورة الأكسدة للأحماض الكربوكسيلية ومع السلسلة التنفسية لنقل الإلكترون ، حيث تحدث الفسفرة ADP وتوليف جزيئات "الوقود" الخلوية و ATP (الشكل 209).
في دورة حمض الكربوكسيل (دورة كريبس ، أو دورة حامض الستريك) ، يفقد البيروفات المتكونة نتيجة تحلل الغلوتين أولاً جزيء ثاني أكسيد الكربون ، ويتأكسد إلى أسيتات (مركب ثنائي الكربون) ، ويتحد مع أنزيم أ. يشكل السترات الكربونية (حمض الستريك). ثم هناك دورة أكسدة لهذا المركب المكون من ستة كربون إلى أكسالات أسيتات الكربون الأربعة ، مرتبطًا مرة أخرى بأسيتيل أنزيم أ ، ثم تتكرر الدورة. خلال هذه الأكسدة ، يتم إطلاق جزيئين من ثاني أكسيد الكربون ، ويتم نقل الإلكترونات التي تم إطلاقها خلال الأكسدة إلى جزيئات أنزيم متقبل (NAD- نيكوتيناميد أدينين ثنائي النوكليوتيد) ، الأمر الذي يؤدي إلى زيادة إشراكهم في سلسلة نقل الإلكترون. لذلك ، في دورة الأحماض الكربوكسيلية لا يوجد تخليق ATP بحد ذاته ، ولكن هناك أكسدة للجزيئات ، ونقل الإلكترون إلى المستقبلات وانبعاث ثاني أكسيد الكربون. جميع الأحداث المذكورة أعلاه داخل الميتوكوندريا تحدث في المصفوفة الخاصة بهم.
تؤدي أكسدة الركيزة الأولية إلى إطلاق ثاني أكسيد الكربون والماء ، ولكن لا يتم إطلاق الطاقة الحرارية ، كما يحدث أثناء الاحتراق ، ولكن يتم تشكيل جزيئات ATP. يتم تصنيعها من قبل مجموعة أخرى من البروتينات التي لا ترتبط مباشرة بالأكسدة. في أغشية الميتوكوندريا الداخلية ، توجد مجمعات كبيرة من البروتين ، إنزيمات ، مواد اصطناعية ATP على سطح الأغشية التي تنظر إلى المصفوفة. في المجهر الإلكتروني ، تكون مرئية في شكل ما يسمى بأجسام "عيش الغراب" ، التي تبطن سطح الأغشية تمامًا ، وتنظر إلى المصفوفة. الأجسام لها ساق ورأس ، قطرها 8-9 نانومتر. وبالتالي ، يتم ترجمة إنزيمات كل من سلسلة الأكسدة والإنزيمات التوليفية ATP في الأغشية الميتوكوندرية الداخلية (الشكل 201 ب).
السلسلة التنفسية هي النظام الرئيسي لتحويل الطاقة في الميتوكوندريا. هنا ، يحدث الأكسدة المتسلسلة واستعادة عناصر سلسلة الجهاز التنفسي ، ونتيجة لذلك يتم إطلاق الطاقة في أجزاء صغيرة. بسبب هذه الطاقة ، في ثلاث نقاط في السلسلة ، يتكون ATP من ADP والفوسفات. لذلك ، يقال أن الأكسدة (نقل الإلكترون) يرتبط بالتفسف (ADP + Fn → ATP ، أي يحدث الفسفرة المؤكسدة).
يتم تخزين الطاقة المنبعثة أثناء نقل الإلكترون في شكل التدرج البروتوني على الغشاء. اتضح أنه أثناء نقل الإلكترون في الغشاء الميتوكوندريا ، يوجه كل مجمع من سلسلة الجهاز التنفسي طاقة الأكسدة الحرة لتحريك البروتونات (الشحنات الإيجابية) من خلال الغشاء ، من المصفوفة إلى الفضاء بين الأغشية ، مما يؤدي إلى تكوين اختلافات محتملة في الغشاء: تنتشر الشحنات الإيجابية في الفضاء بين الغشاء ، سلبية - من جانب مصفوفة الميتوكوندريا. عندما يتم الوصول إلى الفرق المحتمل (220 mV) ، يبدأ مجمع البروتين من synthetase ATP في نقل البروتونات مرة أخرى إلى المصفوفة ، مع تحويل أحد أشكال الطاقة إلى شكل آخر: إنه يشكل ATP من ADP والفوسفات غير العضوي. هذا هو مزيج من العمليات المؤكسدة مع الاصطناعية ، مع الفسفرة من ADP. بينما تتأكسد الركائز ، بينما يتم ضخ البروتونات من خلال الغشاء الداخلي للميتوكوندريا ، يحدث تخليق ATP المرتبط بهذا ، أي يحدث الفسفرة المؤكسدة.
يمكن فصل هاتين العمليتين. في هذه الحالة ، يستمر نقل الإلكترون ، كما يحدث أكسدة الركيزة ، ولكن لا يحدث تخليق ATP. في هذه الحالة ، يتم تحويل الطاقة المنبعثة أثناء الأكسدة إلى طاقة حرارية.
الفسفرة المؤكسدة في البكتيريا.
في الخلايا بدائية النواة القادرة على الفسفرة المؤكسدة ، يتم توطين عناصر دورة حمض الكربوكسيل مباشرة في السيتوبلازم ، وترتبط السلسلة التنفسية والإنزيمات الفسفورية بغشاء الخلية ، مع نتوءاتها البارزة داخل السيتوبلازم ، مع ما يسمى بالميزوسومات. تجدر الإشارة إلى أن هذه الميزوسومات البكتيرية يمكن أن ترتبط ليس فقط بعمليات التنفس الهوائي ، ولكن أيضًا في بعض الأنواع التي تشارك في انقسام الخلايا ، في عملية توزيع الحمض النووي في خلايا جديدة ، في تكوين جدار الخلية ، إلخ.
على غشاء البلازما في الميزوسومات لبعض البكتيريا ، يتم تنفيذ عمليات متزامنة لكل من الأكسدة وتخليق ATP. تم العثور على جزيئات كروية مشابهة لتلك الموجودة في الميتوكوندريا في خلايا حقيقية النواة في مجهر إلكتروني في أجزاء من أغشية البلازما في البكتيريا. وهكذا ، في الخلايا البكتيرية القادرة على الفسفرة المؤكسدة ، يلعب غشاء البلازما دورًا مشابهًا للغشاء الميتوكوندري الداخلي للخلايا حقيقية النواة.
زيادة في عدد الميتوكوندريا.
يمكن أن تزيد الميتوكوندريا من أعدادها خاصة مع انقسام الخلايا أو بزيادة الحمل الوظيفي للخلية. هناك تجديد مستمر للميتوكوندريا. على سبيل المثال ، في الكبد ، يبلغ متوسط \u200b\u200bعمر الميتوكوندريا حوالي 10 أيام.
تحدث زيادة في عدد الميتوكوندريا من خلال نمو وتقسيم الميتوكوندريا السابقة. تم التعبير عن هذا الافتراض لأول مرة بواسطة Altman (1893) ، الذي وصف الميتوكوندريا تحت مصطلح "bioblasts". من الممكن ملاحظة انقسام الميتوكوندريا الطويلة عند الانقسام الحي ، إلى أجزاء أقصر بواسطة انقباض ، وهو ما يشبه الطريقة الثنائية لتقسيم البكتيريا.
تم إنشاء زيادة حقيقية في عدد الميتوكوندريا عن طريق الانقسام عند دراسة سلوك الميتوكوندريا في الخلايا الحية من زراعة الأنسجة. أثناء دورة الخلية ، تنمو الميتوكوندريا إلى عدة ميكرونات ، ثم تنقسم إلى أجزاء أصغر.
الميتوكوندريا يمكن أن تندمج مع بعضها البعض وتتضاعف وفقًا للمبدأ: الميتوكوندريا من الميتوكوندريا.
الإنتاج الذاتي للميتوكوندريا.
تحتوي العضيات ثنائية الغشاء على نظام كامل للتكاثر التلقائي. في الميتوكوندريا والبلاستيدات ، يوجد حمض نووي يتم فيه تجميع المعلومات ونقل الحمض النووي الريبي والريبوزوم والريبوزومات ، والتي تقوم بتوليف بروتينات الميتوكوندريا والبلاستيد. ومع ذلك ، فإن هذه الأنظمة ، على الرغم من الحكم الذاتي ، محدودة في قدراتها.
الحمض النووي في الميتوكوندريا هو جزيء دوري دون هيستون وبالتالي يشبه الكروموسومات البكتيرية. حجمها حوالي 7 ميكرونات ، 16-19 ألف زوج من النوكليوتيدات من الحمض النووي تدخل في جزيء دوري واحد من الميتوكوندريا الحيوانية. في البشر ، يحتوي الحمض النووي للميتوكوندريا على 16.5 ألف np ، يتم فك تشفيره بالكامل. وقد وجد أن الحمض النووي للميتوكوندال في الأجسام المختلفة متجانسة للغاية ، وفرقها يكمن فقط في حجم الإنترونات والمواقع غير المنقولة. جميع الحمض النووي الميتوكوندريا هي نسخ متعددة يتم تجميعها في مجموعات ، مجموعات. لذلك في واحدة من الميتوكوندريا في الكبد الفئران يمكن أن تحتوي على 1 إلى 50 جزيئات الحمض النووي دوري. المبلغ الإجمالي للحمض النووي الميتوكوندريا لكل خلية حوالي واحد في المئة. لا يرتبط تركيب الحمض النووي الميتوكوندريا بتوليف الحمض النووي في النواة.
مثلما هو الحال في البكتيريا ، يتم جمع الحمض النووي للميتوكوندال في منطقة منفصلة - حيث يبلغ قطرها حوالي 0.4 ميكرون. في الميتوكوندريا الطويلة ، يمكن أن يكون هناك من 1 إلى 10 نكليويد. عند تقسيم الميتوكوندريا الطويلة ، يتم فصل قسم يحتوي على النوكليويد (على غرار التقسيم الثنائي للبكتيريا). يمكن أن تتقلب كمية الحمض النووي في نويات الميتوكوندريا الفردية 10 مرات حسب نوع الخلايا.
في بعض الثقافات ، في الخلايا من 6 إلى 60 ٪ من الميتوكوندريا لا يوجد لديها نوي ، وهو ما يمكن تفسيره من حقيقة أن تقسيم هذه العضيات يرتبط على الأرجح بالتفتت ، وليس بتوزيع النيوكليدات.
كما ذكرنا سابقًا ، يمكن للميتوكوندريا أن تنقسم وتندمج مع بعضها البعض. عندما تندمج الميتوكوندريا مع بعضها البعض ، يمكن أن يحدث تبادل لمكوناتها الداخلية.
من المهم التأكيد على أن الرنا الريباسي والريبوسومات في الميتوكوندريا والسيتوبلازم مختلفان اختلافًا حادًا. إذا تم العثور على الريبوسومات 80s في السيتوبلازم ، فإن الريبوسومات الميتوكوندرية للخلايا النباتية تنتمي إلى الريبوسومات 70s (تتكون من وحدات فرعية من 30s و 50s ، تحتوي على الحمض النووي الريبي RNAs المميزة في 16 و 23s من خلايا بدائية النواة) ، ووجدت الريبوسومات الأصغر في الميتوكوندريا للخلايا الحيوانية (حوالي 50s).
يتم تصنيع RNAs الريبوسوم الميتوكوندريا على الحمض النووي الميتوكوندريا. في mitoplasm على الريبوسومات هو تخليق البروتينات. يتوقف ، على النقيض من التخليق على الريبوسومات السيتوبلازمية ، تحت تأثير كلورامفينيكول المضادات الحيوية ، الذي يمنع تخليق البروتين في البكتيريا.
على جينوم الميتوكوندريا ، يتم تصنيع 22 من الحمض النووي الريبي النقل. يختلف الرمز الثلاثي للنظام الميتوكوندريا الاصطناعي عن ذلك المستخدم في الهيالوبلازم. على الرغم من وجود جميع المكونات اللازمة لتركيب البروتينات على ما يبدو ، فإن جزيئات الحمض النووي للميتوكوندريا الصغيرة لا يمكنها تشفير جميع بروتينات الميتوكوندريا ، فقط جزء صغير منها. لذلك الحمض النووي في حجم 15 ألف ص. يمكن تشفير البروتينات ذات الوزن الجزيئي الكلي لحوالي 6x10 5. في الوقت نفسه ، يصل إجمالي الوزن الجزيئي لبروتينات جسيمات المجموعة التنفسية الكاملة للميتوكوندريا إلى حوالي 2x10 6.
بالنظر إلى أنه بالإضافة إلى بروتينات الفسفرة المؤكسدة ، تشتمل الميتوكوندريا أيضًا على إنزيمات دورة حمض الكربوكسيليك ، وأنزيمات تخليق الحمض النووي الريبي وأنزيم الحمض النووي الريبي ، وأنزيمات تنشيط الحمض الأميني ، وبروتينات أخرى ، ويمكن ملاحظة أنه من أجل تشفير هذه البروتينات العديدة والـ rRNA والـ rRNA ، من الواضح أن جزيء الحمض النووي للميتوكوندريا القصير ينقصه. أظهر فك تشفير تسلسل النوكليوتيدات في الحمض النووي للميتوكوندريا البشري أنه يشفر فقط 2 من الحمض النووي الريبي الريبوسومي و 22 من الحمض النووي الريبي المنقول وما مجموعه 13 سلسلة مختلفة من الببتيد.
لقد ثبت الآن أن معظم بروتينات الميتوكوندريا تخضع للتحكم الوراثي من نواة الخلية ويتم تصنيعها خارج الميتوكوندريا. يتم تصنيع معظم البروتينات الميتوكوندريا على الريبوسومات في العصارة الخلوية. تحتوي هذه البروتينات على سلاسل إشارة خاصة يتم التعرف عليها بواسطة المستقبلات الموجودة على الغشاء الخارجي للميتوكوندريا. يمكن إدخال هذه البروتينات فيها (انظر التشبيه مع غشاء البيروكسيوم) ، ثم الانتقال إلى الغشاء الداخلي. يحدث هذا النقل عند نقاط التلامس للأغشية الخارجية والداخلية ، حيث يتم تمييز هذا النقل. يتم تصنيعها أيضا معظم الدهون الميتوكوندريا في السيتوبلازم.
كل هذا يشير إلى الأصل التوافقي الداخلي للميتوكوندريا ، أن الميتوكوندريا هي كائنات حية مثل البكتيريا التي تتعايش مع خلية حقيقية النواة.
كوندريت.
مجموع كل الميتوكوندريا في خلية واحدة تسمى ورم غضروفي. يمكن أن يكون مختلفا اعتمادا على نوع الخلايا. في العديد من الخلايا ، تتكون الأورام الغضروفية من العديد من الميتوكوندريا المتناثرة الموجودة بشكل موحد في جميع أنحاء السيتوبلازم أو المترجمة في مجموعات في مواقع الإنفاق الشديد ATP. في كلتا هاتين الحالتين ، تعمل الميتوكوندريا وحدها ، وعملها التعاوني ، وربما تنسقها بعض الإشارات من السيتوبلازم. هناك نوع مختلف تمامًا من الورم الغضروفي ، ولكن بدلاً من الميتوكوندريا الصغيرة المتناثرة ، توجد الميتوكوندريا المتفرعة العملاقة في الخلية.
تم العثور على هذه الميتوكوندريا في الطحالب الخضراء أحادية الخلية (على سبيل المثال ، شلوريلا). أنها تشكل شبكة معقدة من الميتوكوندريا أو شبكية الميتوكوندريا (Reticulum miyochondriale). وفقًا لنظرية التناضح الكيميائي ، فإن المعنى البيولوجي لظهور مثل هذا الهيكل العملاق المتفرع من الميتوكوندريا ، المتحد بأغشيةه الخارجية والداخلية ، هو أن تخليق الـ ATP يمكن أن يحدث في أي وقت على سطح الغشاء الداخلي لهذه الميتوكوندريا المتفرعة ، والتي سوف تذهب إلى أي مكان في السيتوبلازم ، هناك حاجة لهذا.
في حالة الميتوكوندريا المتفرعة العملاقة في أي وقت ، يمكن أن تتراكم إمكانات كافية لبدء تخليق ATP على الغشاء الداخلي. من هذه المواقف ، فإن شبكية الميتوكوندريا ، كما هي ، موصل كهربائي ، كبل يربط بين النقاط البعيدة لهذا النظام. كانت شبكة الميتوكوندريا مفيدة للغاية ليس فقط للخلايا المتنقلة الصغيرة ، مثل الكلوريلا ، ولكن أيضًا للوحدات الهيكلية الأكبر مثل العضل الليفي العضلي في العضلات الهيكلية.
من المعروف أن العضلات الهيكلية تتكون من كتلة من الألياف العضلية ، symplasts تحتوي على العديد من النوى. يصل طول هذه الألياف العضلية إلى 40 ميكرون ، بسمك 0.1 ميكرون - وهذا هيكل عملاق يحتوي على عدد كبير من الألياف العضلية ، وكلها تتقلص في وقت واحد ، بشكل متزامن. من أجل الانكماش ، يتم تسليم كمية كبيرة من ATP لكل وحدة تقلص ، myofibril ، والتي توفرها الميتوكوندريا على مستوى الأقراص z. على المقاطع الطولية للعضلات ذات الهيكل العظمي للعضلات الهيكلية ، يُظهر المجهر الإلكتروني العديد من الأجزاء الصغيرة المستديرة من الميتوكوندريا الموجودة بالقرب من الأورام اللحمية. الميتوكوندريا العضلية ليست كرات أو قضبان صغيرة ، بل هي هياكل عنكبوتية ، تتفرع عملياتها وتمتد عبر مسافات طويلة ، وأحيانًا عبر القطر الكامل من الألياف العضلية.
في الوقت نفسه ، يحيط المتفرعة عن الميتوكوندريا كل عضل ليفي في ليف العضلات ، ويزودهم بـ ATP اللازم لتقلص العضلات. لذلك ، في طائرة القرص Z ، تمثل الميتوكوندريا شبكة شبكية نموذجية من الميتوكوندريا. يتم تكرار هذه الطبقة أو الأرضية من شبكية الميتوكوندريا مرتين لكل قسيم عضلي ، ولألياف العضلات بأكملها الآلاف من الطبقات "الأرضية" الموجودة في الشبكة الميتوكوندريا. بين "الطوابق" على طول العضل الليفي توجد الميتوكوندريا الخيطية التي تربط هذه الطبقات بالميتوكوندريا. وهكذا ، تم إنشاء صورة ثلاثية الأبعاد لشبكة شبكية الميتوكوندريا ، تمر عبر كامل حجم الألياف العضلية.
وقد ثبت كذلك أن بين فروع الشبكة الميتوكوندريا والميتوكوندريا الطولية الخيطية هناك مركبات أو اتصالات خاصة بين الميتوكوندريا (MMC). يتم تشكيلها بواسطة أغشية الميتوكوندريا الخارجية المتجاورة بإحكام عند الاتصال بالميتوكوندريا ، وتكون مساحة الأغشية والأغشية في هذه المنطقة ذات كثافة إلكترون متزايدة. من خلال هذه التكوينات الخاصة ، يحدث اتحاد وظيفي بين الميتوكوندريا المجاورة وشبكيات الميتوكوندريا في نظام طاقة تعاوني واحد. يتم تقليل جميع الألياف العضلية الليفية في الألياف العضلية بشكل متزامن بطولها بالكامل ، وبالتالي ، يجب أيضًا أن يحدث إمداد ATP في أي جزء من هذه الآلة المعقدة بشكل متزامن ، وهذا يمكن أن يحدث فقط إذا تم توصيل عدد كبير من الموصلات الميتوكوندريا المتفرعة مع بعضها البعض باستخدام جهات الاتصال.
حقيقة أن جهات الاتصال بين الكثيرين (MMK) متورطة في ارتباط طاقة الميتوكوندريا مع بعضها البعض كانت ممكنة على خلايا عضلة القلب ، خلايا عضلة القلب.
لا تشكل الأورام الغضروفية في خلايا عضلة القلب هياكل متفرعة ، ولكن يتم تمثيلها بواسطة العديد من الميتوكوندريا الصغيرة المطولة الموجودة دون ترتيب خاص بين العضل الليفي. ومع ذلك ، فإن جميع الميتوكوندريا المجاورة تنضم إلى بعضها البعض بمساعدة جهات الاتصال بالميتوكوندريا من نفس النوع كما هو الحال في العضلات الهيكلية ، فقط عددهم كبير للغاية: في المتوسط \u200b\u200b، هناك 2-3 MMC لكل الميتوكوندريا التي تربط الميتوكوندريا في سلسلة واحدة ، حيث يكون لكل رابط السلسلة (Streptio mitochondriale) هي ميتوكوندريا منفصلة.
اتضح أنه تم العثور على جهات الاتصال بين الميتوكوندريا (MMC) ، كهيكل إلزامي لخلايا القلب ، في خلايا عضلية القلب من البطينين الأذينين من جميع الفقاريات: الثدييات والطيور والزواحف والبرمائيات والأسماك العظمية. علاوة على ذلك ، تم العثور على MMCs (ولكن في عدد أقل) في خلايا القلب لبعض الحشرات والرخويات.
يختلف مقدار MMC في عضلات القلب اعتمادًا على الحمل الوظيفي على القلب. يزداد عدد MMC مع زيادة النشاط البدني للحيوانات ، وعلى العكس ، عندما ينخفض \u200b\u200bالحمل على عضلة القلب ، يحدث انخفاض حاد في عدد MMC.







