Ковалентной связи. Строение молекул
6.2.1. Определение типа химической связи по разности
электроотрицательностей атомов, образующих связь
Образование различных типов химической связи зависит от способности атомов отдавать или притягивать электроны. Такая способность характеризуется величиной электроотрицательности (ЭО). Чем больше величина ЭО. тем больше способность атомов притягивать электроны. Если разность ЭО (ΔЭО) между двумя атомами, образующими связь равна нулю (ΔЭО = 0), то такая связь неполярная ковалентная. При 0 < ΔЭО < 2 связь полярная ковалентная. Ионная связь образуется при Δ ЭО > 2.
Пример 3. Определите, какой тип связи а соединениях КС1, Н 2 , SO 2 .
Решение. Пользуясь величинами ЭО для каждого атома (приложение, табл. П4), находим ΔЭО.
Наиболее полярной является связь Na–H, так как в этом случае величина ΔЭО – самая наибольшая.
6.2.2. Нахождение электрического момента диполя связи и молекулы
Для оценки полярности связи и молекулы используют электрический момент диполя μ, равный произведению длины диполя на электрический заряд q (q = 1,602 · 10 -19 Кл), т.е. μ = 1q . Для полярных связей и молекул μ > 0, для неполярных μ = 0. Электрический момент диполя – система двух равных и противоположных по знаку электрических зарядов – есть векторная величина, направленная от положительного к отрицательному заряду. Единица измерения μ – Дебай (D ): D = 3,33 · 10 –30 Kл · м. Электрический момент диполя двухатомной молекулы равен электрическому моменту диполя связи. Электрический момент диполя многоатомной молекулы равен векторной сумме электрических моментов диполей всех связей.
Пример 5. Определите электрический момент диполя молекулы HF и его направление, если μ связи равен 1,9D (приложение, табл. П5).
Решение. Молекула HF – двухатомная, имеет линейное строение: H–F. Следовательно, электрический момент диполя связи равен электрическому моменту диполя молекулы (1,91D ) и направлен от водорода, имеющего положительный заряд, к отрицательному фтору: H®F (ЭО Н = 2,1; ЭО F = 4,0).
Пример 6. Молекула BeН 2 имеет линейное строение. Валентный угол Н–Ве–Н составляет 180°. Связи Ве–Н полярны (ЭО Ве = 1,5; ЭО H = 2,1). Молекула Н 2 О имеет угловое строение (валентный угол Н-О-Н равен 104°30"). Связи Н–О полярны (ЭО H = 2,1; ЭО O = 3,5). Будут ли обе молекулы полярные?
Решение. В молекуле ВеН 2 связи полярные и вектор электрического момента диполя связи Ве–Н 2 направлен от (+) к (–), т.е. от бериллия с меньшей величиной ЭО к водороду с большей величиной ЭО, а именно H . Векторная сумма электрических моментов диполей связей, одинаковых по величине и противоположных по знаку, равна нулю. Следовательно, молекула неполярна ( = 0).
В молекуле Н 2 О полярные связи Н–О располагаются под углом 104°30" (рис. 1). Поэтому их электрические моменты диполей связей взаимно неРис. 1. Электрический момент диполя
молекулы Н 2 О
Решение. Электрический заряд q = 1,602 · 10 –19 Кл. Электрический момент диполя молекулы находим по формуле
μ = 1 · q = 1,602 · 10 –19 · 3,37 · 10 –11 = 5,4 · 10 -30 Кл · м. (1,63 D ).
Ответ: 5,4 · 10 –30 Кл·м. = (1,63 D ).
6.2.3. Объяснение строения молекул по методу валентных связей (ВС)
Образование молекул по методу ВС может происходить по обменному или донорно-акцепторному механизму. Первый основан на перекрывании одноэлектронных атомных орбиталей; второй связан с наличием атомов-доноров, имеющих электронную пару, и атомов-акцепторов, у которых есть свободные атомные орбитали.
Пример 8. Объясните образование химических связей в молекуле NН 3 и ее строение по обменному механизму.
Решение . Для объяснения образования химических связей в молекуле NH 3 по обменному механизму необходимо написать электронные формулы атомов азота и водорода; определить их валентные электроны и ковалентность каждого атома.
Азот
7 N 1s
2 2s
2 2р
3 – р
s
2 2р
3 . Ковалентность атома равна трем 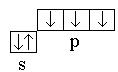 . Поэтому образуются три ковалентные связи.
. Поэтому образуются три ковалентные связи.
Водород 1 Н 1s 1 – s s 1 ; ковалентность равна 1 , атом образует одну ковалентную связь.
В образовании трёх химических связей N–H в молекуле NН 3 принимают участие три одноэлектронные р -орбитали атома азота и одна одноэлектронная s -орбиталь каждого из трёх атомов водорода. Перекрывание s-p орбиталей происходит в направлении наибольшей вытянутости р -орбиталей в пространстве, расположенных под углом 90°. После перекрывания форма молекулы NH 3 – тригональная пирамида с валентным углом H–N–H, равным 107°20" (рис. 2).
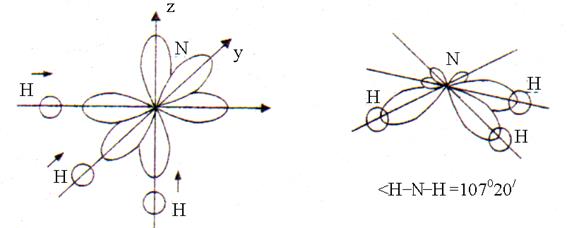
Рис. 2. Строение молекулы аммиака
Отклонение величины угла от 90° вызвано тем, что связь N–H полярна (ЭО N = 3,0; ЭО Н = 2,1). Связующие электронные пары несколько смещены от атомов водорода к атому азота (ЭО N > ЭО H). Поэтому положительно заряженные атомы водорода, а также электронные пары трёх связей N–H отталкиваются друг от друга, что приводит к увеличению валентного угла до 107°20".
Пример 9. Объясните образование иона аммония NH 4 + из молекулы аммиака NH 3 и иона водорода Н + по донорно-акцепторному механизму.
Решение. Образование связей в молекуле NН 3 по обменному механизму дано в примере 8. Как следует из объяснений, три ковалентные связи образуются по обменному механизму за счёт трех валентных одноэлектронных р -орбиталей атома азота. Но, кроме того, атом азота имеет ещё валентную двухэлектронную s -орбиталь (2s 2), которая может быть донором по отношению к акцептору – иону водорода, имеющему свободную орбиталь. Поэтому атом азота может образовывать четвёртую ковалентную связь по донорно-акцепторному механизму. Образование четвёртой ковалентной связи (донорно-акцепторной) в ионе аммония NH 4 + можно представить схемой:
Донор Акцептор
Ион аммония имеет форму тетраэдра за счёт s 1 р 3 -гибридизации (см. п. 6.2.4).
6.2.4. Определение типа гибридизации атомных орбиталей
и пространственной конфигурации молекулы по методу ВС
Пример 10. Определите тип гибридизации атомных орбиталей, пространственную конфигурацию и полярность молекулы ВН 3 .
Решение
.
Бор:
5 В ls
2 2s
2 2p
1 – р
-элемент; валентные электроны 2s
2 2p
1 ; ковалентность атома в нормальном (невозбуждённом) состоянии равна единице 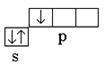 .
.
Водород 1 Н 1s 1 – s -элемент; валентные электроны 1s 1 ; ковалентность равна единице . В нормальном состоянии атом бора может образовывать только одну химическую связь за счёт одного непарного р -электрона. Однако состав молекулы ВН 3 указывает на то, что бор образует три химические связи, т.е. его ковалентность равна трём. Это возможно при переводе атома из нормального в возбуждённое состояние (рис. 3).
Рис. 3. Образование гибридных орбиталей атома бора
Три гибридные орбитали располагаются симметрично в пространстве под углом 120 0 друг к другу и направлены к вершинам правильного треугольника. Три гибридные орбитали атома бора образуют с одноэлектронными s -орбиталями трёх атомов водорода три химические связи в молекуле ВН 3 , которая имеет форму правильного треугольника (рис. 4).
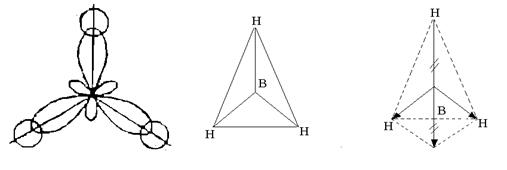
Рис. 4. Строение молекулы ВН 3
Несмотря на то, что связи В–Н полярны (ЭО B = 2,0; ЭО Н = 2,1), молекула неполярна, т.к. имеет симметричное строение. Результирующая векторной суммы электрических моментов диполей трех связей В–Н равна нулю (см. рис. 4).
Гибридизация атомных орбиталей определяет пространственную конфигурацию молекул и ионов (табл. 2).
Таблица 2
Пространственные структуры некоторых молекул и ионов
6.2.5. Объяснение образования и свойств двухатомных молекул типа В 2 по методу молекулярных орбиталей (МО)
Согласно методу МО в молекуле нет атомных орбиталей (АО), а есть связывающие и разрыхляющие МО, полученные линейной комбинацией (смешиванием) АО. При комбинации n АО образуется n МО, из них число связывающих равно числу энергии АО. Энергия связывающих МО меньше энергии АО, а энергия разрыхляющих МО больше энергии АО. Порядок размещения электронов на МО тот же, что и в случае АО; прежде всего заполняются МО с низкой энергией (принцип минимальной энергии) в соответствии с принципом Паули и правилом Гунда.
Наиболее простой случай образования МО имеет место при комбинации АО двух атомов одного и того же элемента (В 2). При комбинации двух s-s AО образуются две МО, называемые σ (сигма) орбиталями. Одна из них связывающая (), другая – разрыхляющая (). Две s-МО получаются также комбинацией двух р х -р х АО ( и ). Комбинацией двух р у -р у и двух р z -p z АО образуются две p св -МО ( и ) и две p раз -МО ( и ).
Образование МО из атомных и изменение их энергии можно представить в виде энергетической диаграммы, где по вертикали откладываются значения энергии орбиталей (рис. 5).
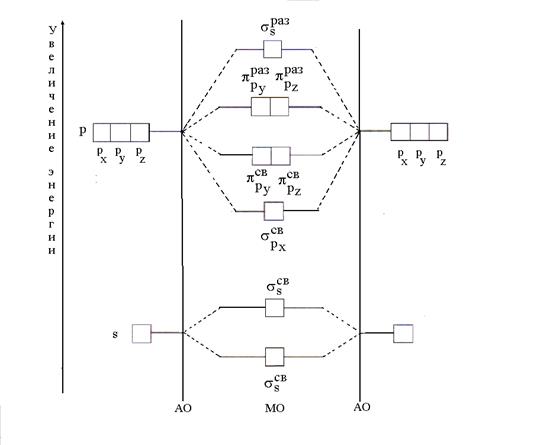
Рис. 5. Энергетическая схема образования МО при комбинации АО двух атомов одного и того же элемента (В 2)
Метод МО позволяет определить магнетизм молекулы. Так, наличие непарных электронов в молекуле обусловливает её парамагнетизм, а отсутствие таковых – диамагнетизм. По методу МО можно найти кратность связи. Кратность w равна полуразности числа электронов на связывающих n св и разрыхляющих n раз МО:
Если число электронов на связывающих и разрыхляющих МО равное, то кратность связи равна нулю. Следовательно, эти электроны не оказывают влияния на образование химической связи.
По методу МО также можно объяснить устойчивость молекулы. Устойчивость молекулы связана с энергетическим балансом всех связывающих и разрыхляющих электронов. Ориентировочно можно считать, что один разрыхляющий электрон сводит на нет действие одного связывающего электрона. Таким образом, чем больше электронов на связывающих МО и меньше их на разрыхляющих МО, тем устойчивее молекула.
Пример 11. Объясните по методу МО образование молекулы О 2 . Определите кратность связи и ее магнетизм.
Решение. Молекула О 2 состоит из атома одного и того же элемента – кислорода. Его электронная формула следующая: 8 О 1s 2 2s 2 2p 4 . Валентные электроны атома кислорода 2s 2 2p 4 принимают участие в образовании химической связи, т.е. МО получаются линейной комбинацией 2s - и 2р - АО двух атомов кислорода.
Распределение двенадцати валентных электронов в молекуле кислорода происходит в соответствии с принципом минимальной энергии. Сначала заполняются и МО по два электрона с антипараллельными спинами (принцип Паули). Затем шесть электронов разместятся на трех связывающих МО ( ; ; ) по два электрона с антипараллельными спинами. Оставшиеся два электрона займут разрыхляющие МО ( и ) по одному электрону с параллельными спинами согласно правилу Гунда. После размещения электронов на МО энергетическая диаграмма молекулы кислорода будет иметь следующий вид (рис. 6).
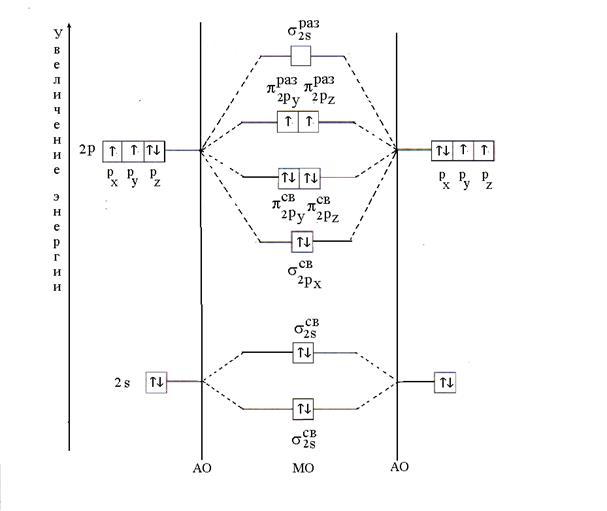
Рис. 6. Энергетическая диаграмма молекулы О 2
Кратность связи в молекуле кислорода, рассчитанная по формуле (2), равна двум. Наличие двух непарных электронов определяет парагнетизм молекулы.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
101. В молекуле этина (ацетилена) С 2 Н 2 между атомами углерода имеется тройная связь: одна s и две p связи. Образование двух p связей происходит за счет перекрывания р у -р у и двух р z -p z атомных орбиталей. Каким образом возникает s связь? Определите тип гибридизации при образовании s связи. Нарисуйте строение молекулы этина и рассчитайте энергию связи, используя данные табл. 3.
Ответ: ΔН = – 245 кДж/моль.
102. Используя энергетическую диаграмму, полученную методом МО, объясните, почему молекула неустойчивая, а ион устойчив. Рассчитайте кратность связи в обоих случаях. Как и почему изменяется энергия химической связи при переходе к .
103. Объясните образование химических связей в молекуле Н 2 О по методу ВС. Изобразите пространственную конфигурацию молекулы. Вычислите длину связи Н–О, используя данные табл.2. Ответ: 0,97 · 10 –10 м.
104. Объясните строение молекулы СН 4 по методу ВС. Определите тип гибридизации при образовании химических связей. Используя данные табл.4, докажите, что связи в молекуле ковалентно-полярные. Почему электрический момент диполя молекулы равен нулю? . Какой атом выступает в роли донора, а какой – в роли акцептора?
108. Объясните строение молекулы СCl 4 по методу ВС. Определите тип гибридизации при образовании химических связей. Вычислите длину связи C–Cl в этой молекуле, используя данные табл. 2. Ответ: 1,765 · 10 –10 м.
109. Объясните строение молекулы СО 2 по методу ВС. Изобразите пространственную конфигурацию молекулы. Определите тип гибридизации при образовании химических связей. Используя данные табл. 4, докажите, что связи ковалентные полярные. Почему молекула СО 2 неполярна?
110. Молекула BF 3 имеет плоскостную треугольную конфигурацию, а NF 3 – объемную (пирамидальную). Используя метод ВС, объясните, в чем причина различия в строении этих молекул? Какая молекула неполярна и почему? Результат подтвердите величинами электрических моментов диполей молекул (см. табл. 5).
111. Молекула СН 4 и ион имеют одинаковую пространственную конфигурацию. Как это можно объяснить с точки зрения гибридизации атомных орбиталей центрального атома? Почему электрический момент диполя молекулы СН 4 равен нулю?
112. По методу валентных связей объясните строение молекулы этана С 2 Н 6 (Н 3 С–СН 3). Каков тип гибридизации химической связи? Вычислите энергию связи С–С, если стандартная энтальпия образования С 2 Н 6 из газообразных углерода и водорода равна – 2798,8 кДж/моль, а энергия связи С–Н равна –411,3 кДж/моль.
Ответ: ΔН = – 331,0 кДж/моль.
113. Используя метод ВС, объясните, почему молекулы Н 2 О и Н 2 S имеют угловое строение, при этом валентный угол <(H–O–H) = 104 0 30¢ больше валентного угла <(H–S–H) = 92 0 . На основании данных табл.5 вычислите длины диполей молекул и покажите направления электрических моментов диполей связей в них.
Ответ: 3,83 · 10 –11 и 1,55 · 10 –11 м.
114. Используя метод ВС, объясните строение молекулы PCl 3 и AlCl 3 . Какова разница геометрических конфигураций молекул? Почему молекула PCl 3 полярна, а AlCl 3 имеет электрический момент диполя равный нулю?
115. Используя метод ВС, объясните строение молекулы CS 2 . Определите тип гибридизации. Какую геометрическую конфигурацию имеет молекула? Почему электрический момент диполя равнен нулю?
; . Рассчитайте кратность связи и определите, какая из них будет наиболее устойчивой?120. По методу МО постройте энергетические диаграммы для ; ; . Рассчитайте кратность связи и их магнитные свойства.







