9.2 Стандартный водородный электрод. Электродный потенциал.
Можно с высокой точностью измерить ЭДС цепи, составленной из двух электродов. Однако нельзя ни измерить, ни вычислить абсолютную разность потенциалов на границе металл–раствор. Для практических целей достаточно иметь условные величины, характеризующие потенциалы различных электродов, отнесенные к потенциалу некоторого электрода, выбранного за стандартный.
В качестве условно-нулевого потенциала выбран потенциал стандартного водородного электрода:
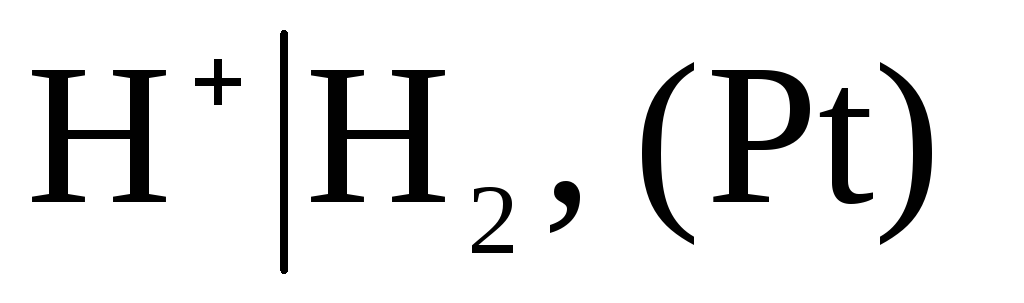 ,
,
в
котором давление продуваемого водорода
равно 1 атм, а активность ионов водорода
в растворе равна единице (рис. 1). При
любых температурах
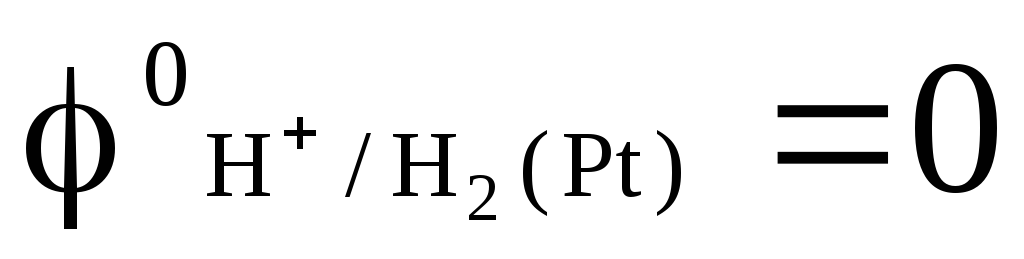 .
.
Электродная реакция для водородного электрода записывается в следующем виде:
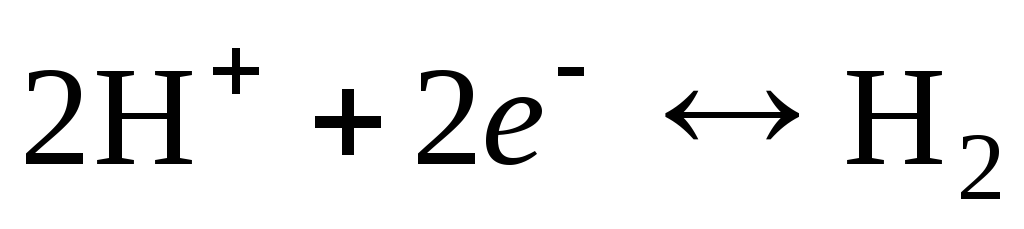 .
.
![]()
Рис. 1. Общий вид водородного электрода.
За электродный потенциал любого электрода решили принимать ЭДС цепи, составленной из рассматриваемого электрода и стандартного водородного электрода. При этом справа в цепи расположен рассматриваемый электрод, а слева – стандартный водородный электрод.
Пример 9.1. Составить ГЭ для определения стандартного электродного потенциала электродов Cu 2+ /Cu и Zn 2+ /Zn.
1). Составим гальванический элемент из стандартного водородного и медного электродов:
Суммарная
потенциалобразующая реакция:
,
т.е. перенос электронов в цепи происходит
слева направо (от левого электрода к
правому). При стандартных условиях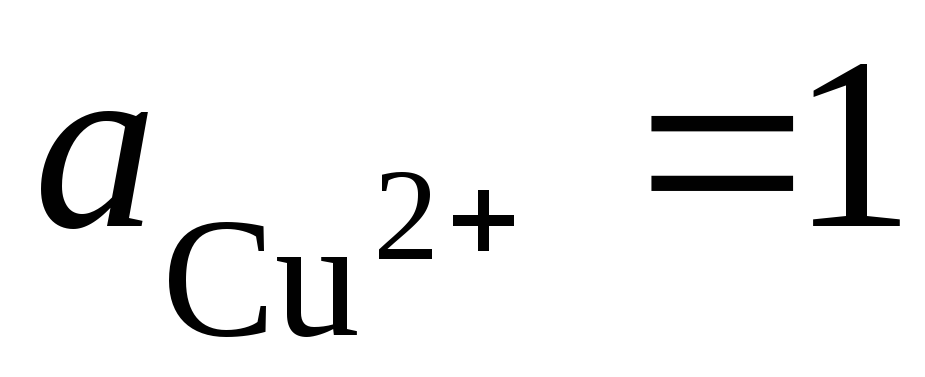 ,
ЭДС этого элемента составит E=0,337 В.
Следовательно,
,
ЭДС этого элемента составит E=0,337 В.
Следовательно,
![]() .
.
2). Аналогичным образом оставим гальванический элемент из стандартного водородного и цинкового электродов:
Суммарная
реакция:
,
т.е. перенос электронов в цепи происходит
справа налево. При стандартных условиях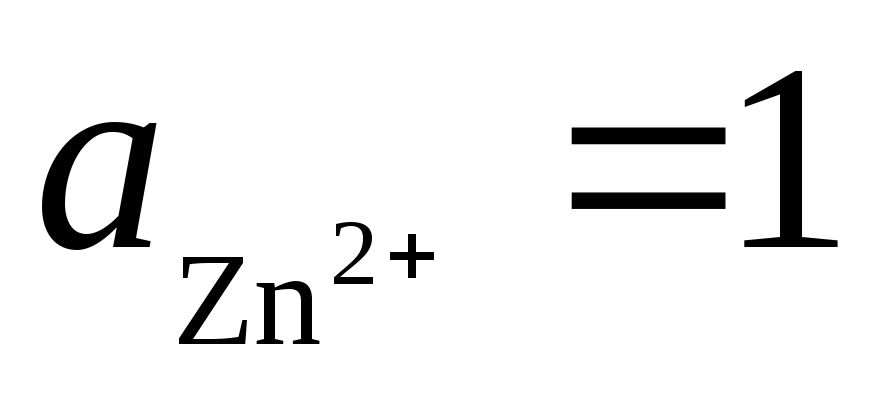
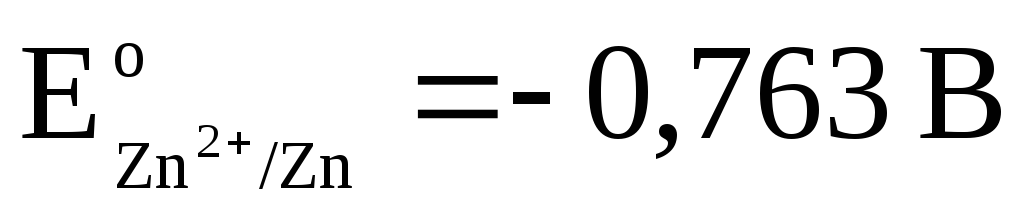 .
.
9.3 Уравнение Нернста для эдс гальванического элемента.
Электрической характеристикой электрода является электродный потенциал , а гальванического элемента (электрохимической цепи) ‑ электродвижущая сила (ЭДС) ,
ЭДС правильно разомкнутой электрохимической цепи в отсутствии диффузионного потенциала соответствует разности потенциалов правого (положительного) и левого (отрицательного) электродов и всегда положительна.
ЭДС гальванического элемента
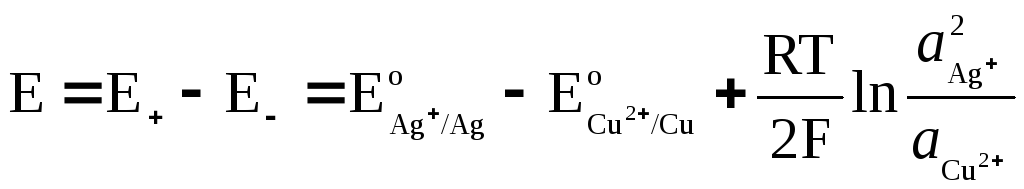
где
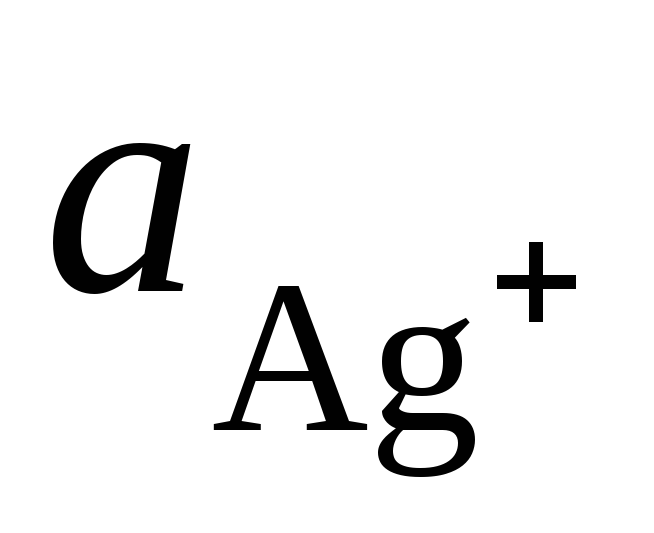 и
и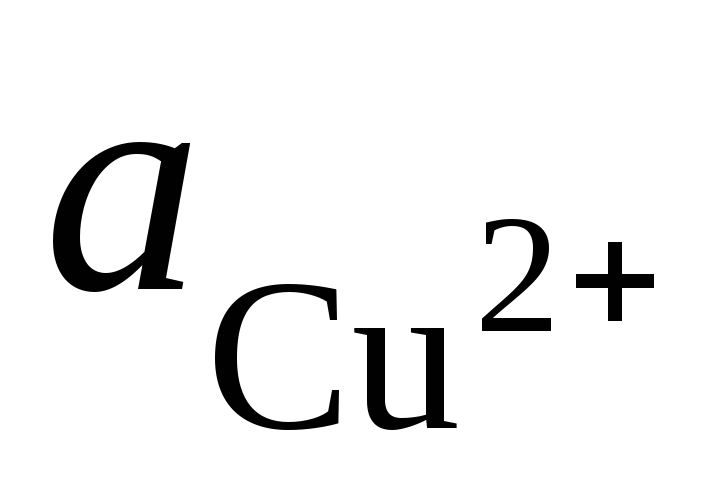 – активности ионов Ag +
и Cu 2+
в растворах их солей.
– активности ионов Ag +
и Cu 2+
в растворах их солей.
Обозначим
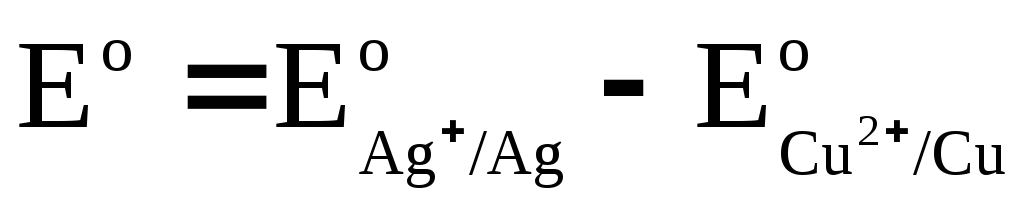 ,
,
где Е о – стандартная ЭДС гальванического элемента. Тогда
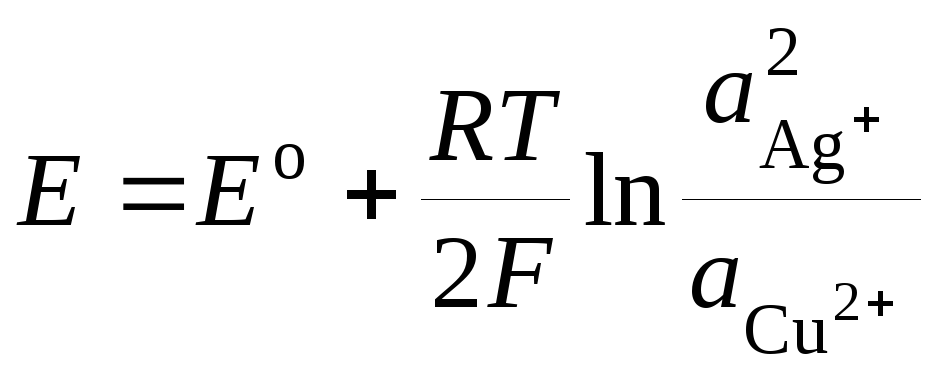 .(3)
.(3)
Уравнение (3) носит название уравнения Нернста для ЭДС гальванического элемента .
Если в гальваническом элементе протекает обратимая химическая реакция
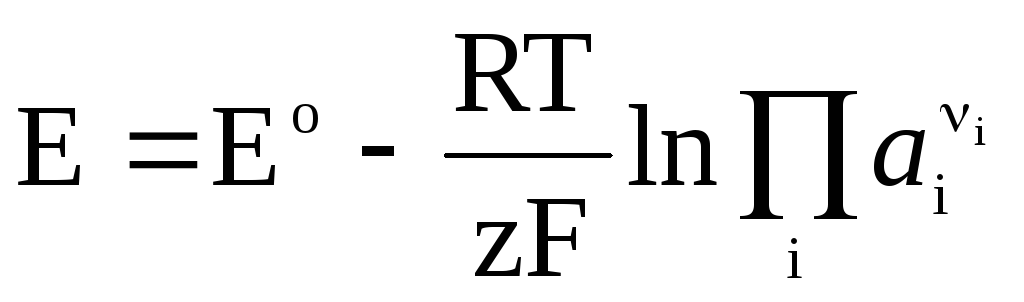 , (4)
, (4)
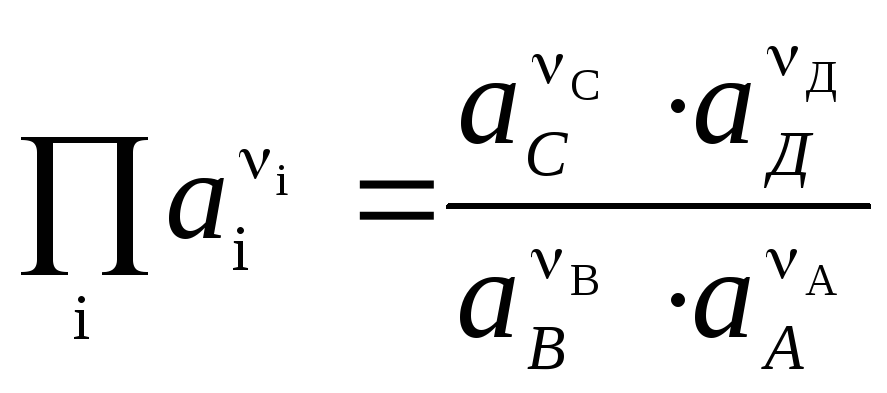
Уравнение Нернста в форме (4) применимо для расчета ЭДС любого гальванического элемента (по суммарной химической реакции) и потенциала любого электрода (по электродной реакции). ЭДС связана с термодинамическими характеристиками реакции. Известно, что
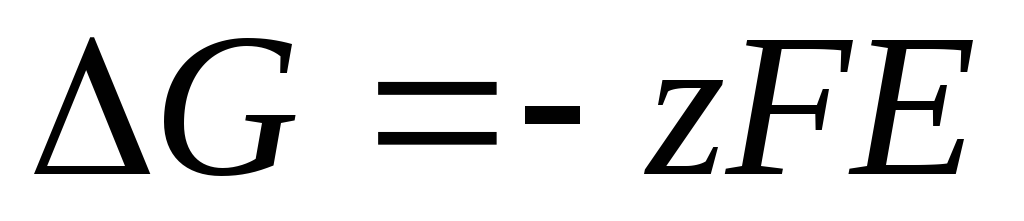 .
.
9.4 Классификация обратимых электродов.
Классификация обратимых электродов основана на свойствах веществ, участвующих в потенциалопределяющих процессах.
1. Электроды первого рода.
Электроды
первого рода
– это металлические электроды, обратимые
относительно катионов (в том числе
амальгамные) (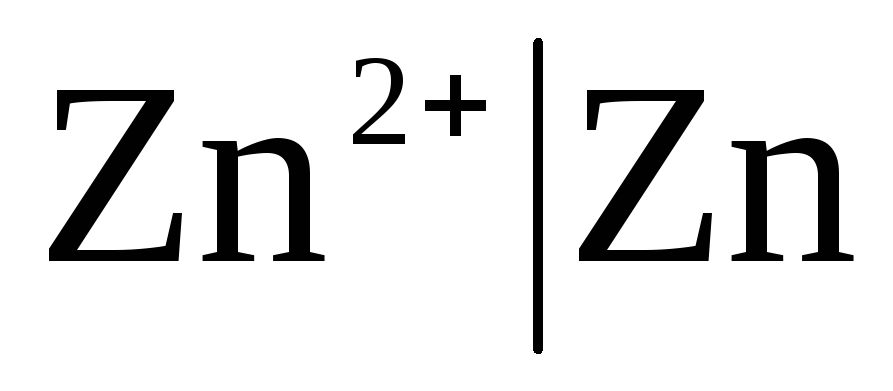 )
и металлоидные, электроды обратимые
относительно анионов (
)
и металлоидные, электроды обратимые
относительно анионов (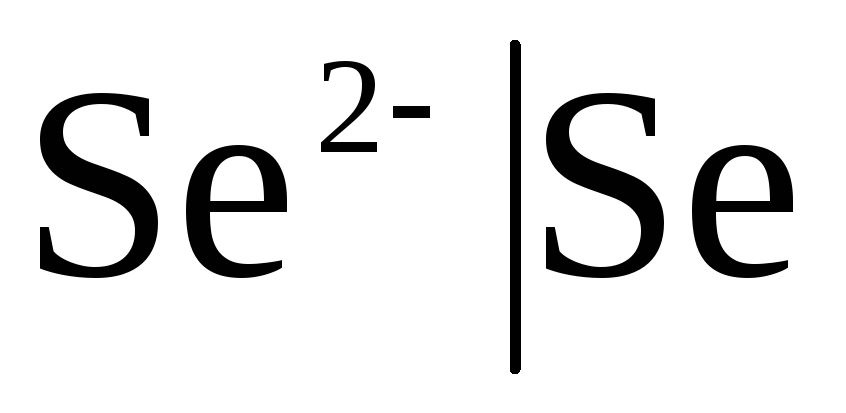 ).
).
Если электрод обратим относительно катиона Zn 2+ /Zn, то для него можно записать:
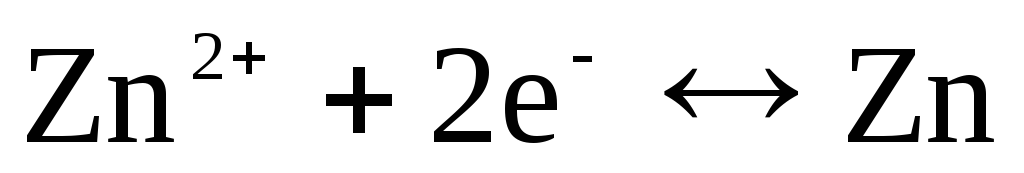 ,
,
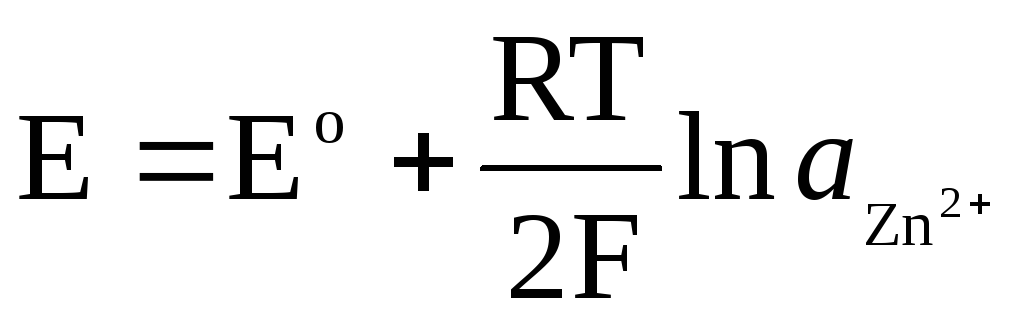
Для амальгамного электрода Zn 2+ /Zn(Hg):
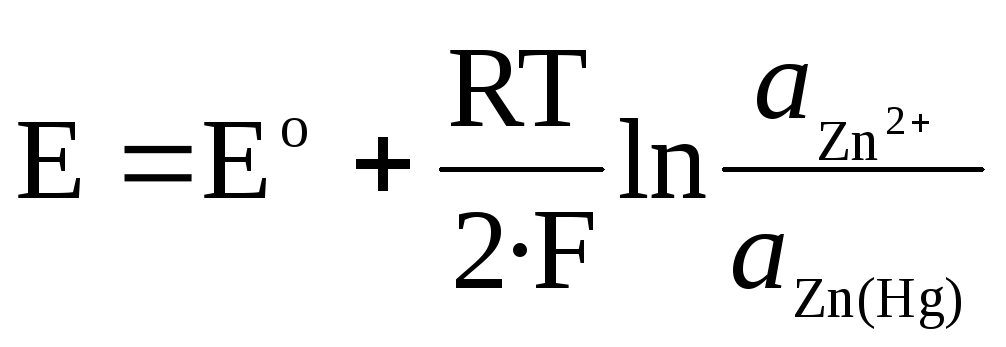 .
.
Если электрод обратим относительно аниона, то
![]() ,
,
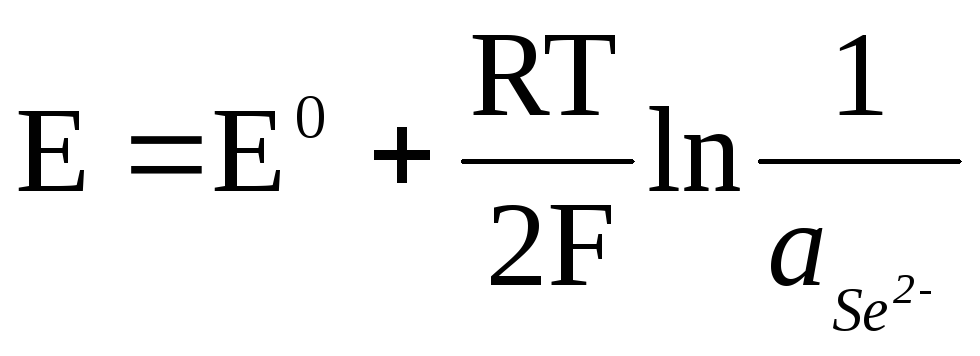 .
.
К
электродам первого рода относятся также
газовые
электроды
(водородный
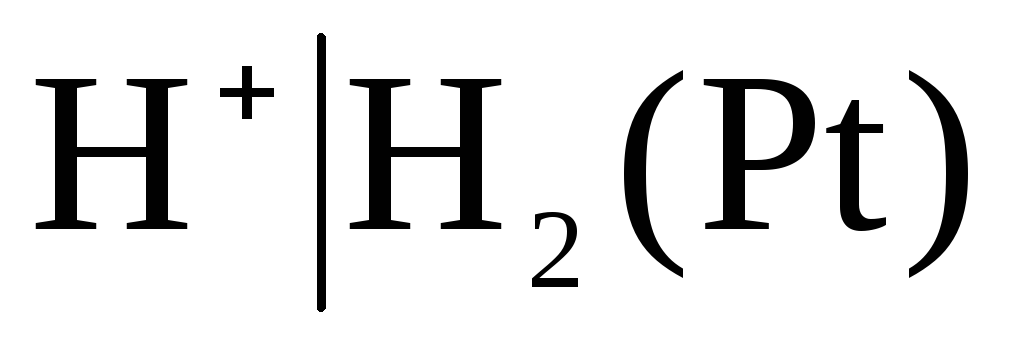 ,
хлорный
,
хлорный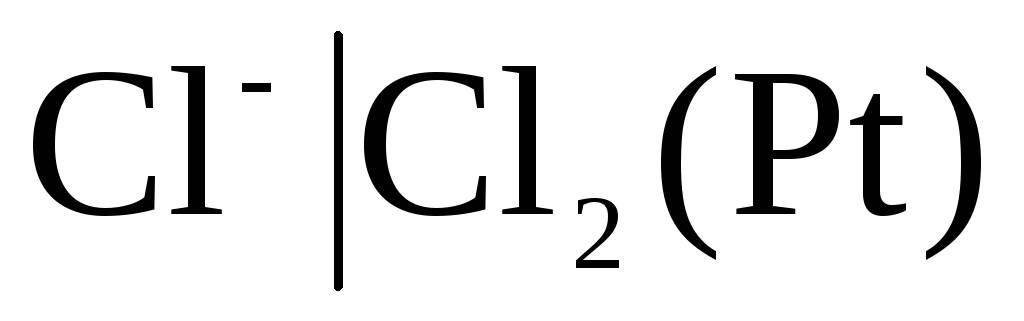 и
др.). Они могут быть обратимы по отношению
к катиону (H +)
или аниону (Cl -).
Например, водородный электрод обратим
по отношению к катиону. Уравнение
электродного процесса для него может
быть записано в виде:
и
др.). Они могут быть обратимы по отношению
к катиону (H +)
или аниону (Cl -).
Например, водородный электрод обратим
по отношению к катиону. Уравнение
электродного процесса для него может
быть записано в виде:
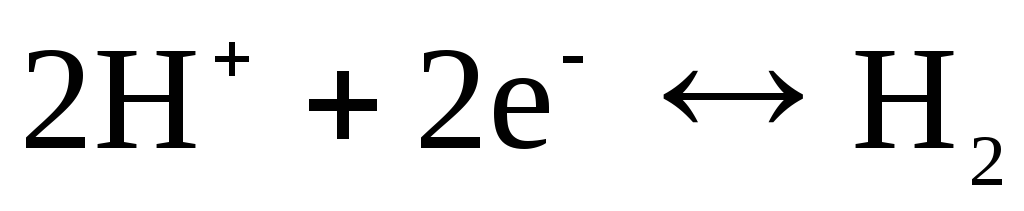 .
.
Потенциал водородного электрода определяется выражением
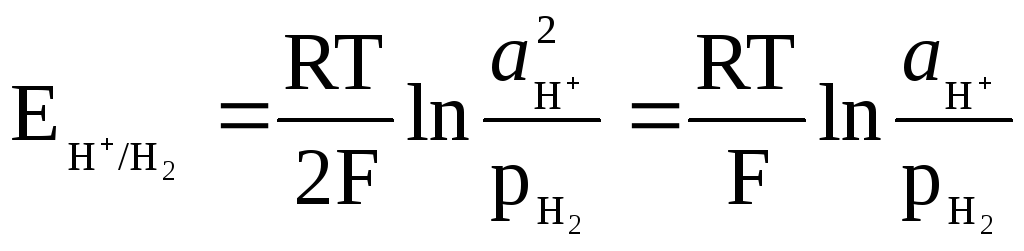 ,
,
и может быть связан с pH раствора.
Для
хлорного электрода
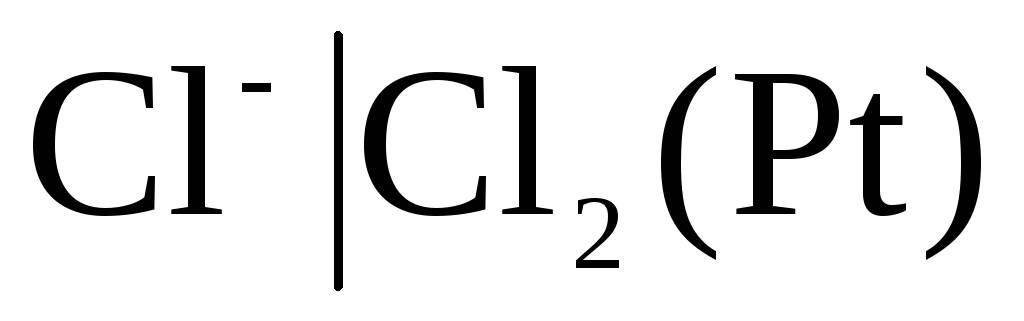 с потенциалопределяющей реакцией
с потенциалопределяющей реакцией
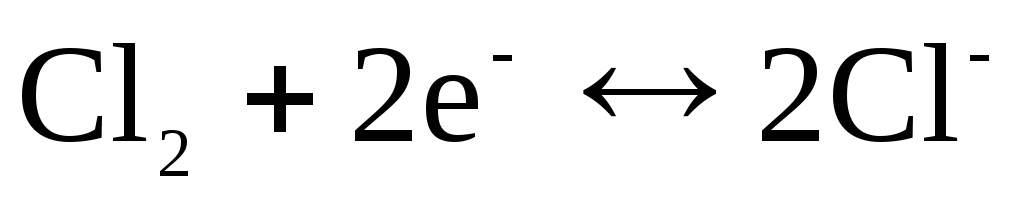 .
.
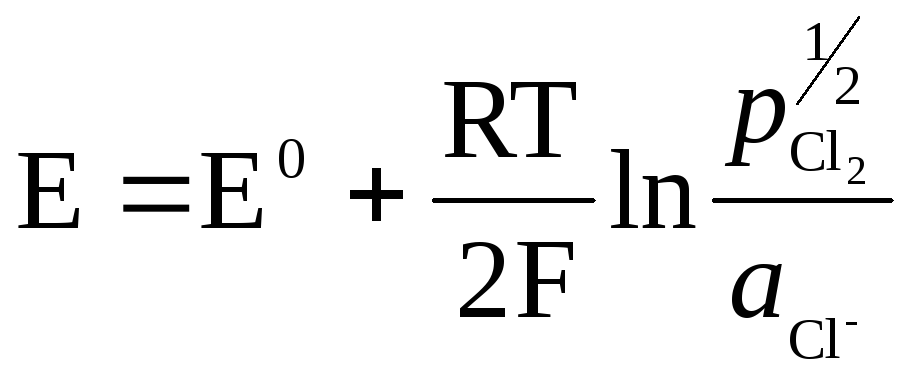
Металл (Pt) в газовых электродах необходим для создания контакта между газом и раствором, должен быть инертен по отношению к веществам, находящимся в растворе, и способен катализировать только один потенциалопределяющий процесс.







